Chimica organica/Alcani (Proprietà): differenze tra le versioni
mNessun oggetto della modifica |
|||
| Riga 1: | Riga 1: | ||
{{Chimica organica}} |
{{Chimica organica}} |
||
===Come verificare la stabilità relativa di due molecole=== |
=== Come verificare la stabilità relativa di due molecole === |
||
Una delle strade |
Una delle strade più percorse per verificare la stabilità relativa di due molecole organiche consiste nel trasformarle, attraverso reazioni chimiche, nella stessa sostanza, più stabile di entrambe, quantificando l'energia liberata nei due casi. '''La specie che per trasformarsi ha liberato meno energia è la più stabile'''.<br /> |
||
Gli alcani (C<sub>n</sub>H<sub>2n+2</sub>) in presenza di un eccesso di [[w:ossigeno|ossigeno]] ed elevate temperature reagiscono con l'O<sub>2</sub> per formare nCO<sub>2</sub> e (n+1)H<sub>2</sub>O con reazione esotermica (combustione), cioè con produzione di calore. Questa razione risponde pienamente allo scopo. |
Gli alcani (C<sub>n</sub>H<sub>2n+2</sub>) in presenza di un eccesso di [[w:ossigeno|ossigeno]] ed elevate temperature reagiscono con l'O<sub>2</sub> per formare nCO<sub>2</sub> e (n+1)H<sub>2</sub>O con reazione esotermica (combustione), cioè con produzione di calore. Questa razione risponde pienamente allo scopo. |
||
Naturalmente maggiore è la lunghezza della catena dell'alcano, maggiore è il calore che viene prodotto. La stabilità di due alcani a peso molecolare diverso può essere confrontata dividendo il calore totale sprigionato per il numero dei carboni che compongono la catena. É da notare come contemporaneamente al calore sviluppato aumenti anche la temperatura di attivazione della reazione |
Naturalmente maggiore è la lunghezza della catena dell'alcano, maggiore è il calore che viene prodotto. La stabilità di due alcani a peso molecolare diverso può dunque essere confrontata dividendo il calore totale sprigionato per il numero dei carboni che compongono la catena. É da notare come contemporaneamente al calore sviluppato aumenti anche la temperatura di attivazione della reazione: gli alcani a peso molecolare sopra il C<sub>30</sub> sono cattivi combustibili. Un esempio è dato dal [w:bitume|bitume]]. |
||
===Alcani: Stabilità relativa degli isomeri=== |
=== Alcani: Stabilità relativa degli isomeri === |
||
{|{{Tabella_Ch_Org}} |
{|{{Tabella_Ch_Org}} |
||
|{{Col1_Ch_Org}} | '''Stabilità relativa di due isomeri del pentano''' |
|{{Col1_Ch_Org}} | '''Stabilità relativa di due isomeri del pentano''' |
||
| Riga 13: | Riga 13: | ||
|} |
|} |
||
===La tensione d'anello nei cicloalcani=== |
=== La tensione d'anello nei cicloalcani === |
||
Poichè i cicloalcani sono caratterizzati da un numero diverso di atomi di carbonio, un confronto sulla loro stabilità relativa può essere basato sul calore di combustione sviluppato solo dividendo tale quantità per il numeri di carboni. Il calore sviluppato per carbonio decresce da ciclopropano a cicloesano, risale dal cicloesano fino al cicloalcano a 15 carboni (pentadecano), poi si stabilizza. I carboni che compongono un alcano sono ibridati sp<sub>3</sub>, così che i gruppi ad essi legati tendono a formare angoli di 109.5 gradi tra loro. La configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l'eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita '''tensione d'anello'''. |
Poichè i cicloalcani sono caratterizzati da un numero diverso di atomi di carbonio, un confronto sulla loro stabilità relativa può essere basato sul calore di combustione sviluppato solo dividendo tale quantità per il numeri di carboni. Il calore sviluppato per carbonio decresce da ciclopropano a cicloesano, risale dal cicloesano fino al cicloalcano a 15 carboni (pentadecano), poi si stabilizza. I carboni che compongono un alcano sono ibridati sp<sub>3</sub>, così che i gruppi ad essi legati tendono a formare angoli di 109.5 gradi tra loro. La configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l'eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita '''tensione d'anello'''. |
||
| Riga 19: | Riga 19: | ||
Il cicloesano, se in conformazione planare, non fa eccezione. Esistono tuttavia due conformazioni perfettamente compatibili con l'ibridazione sp<sub>3</sub> dei carboni: quelle a '''sedia'''. Si parla di conformazioni poichè per passare dall'una all'altra sono necessarie solo rotazioni di legami σ. La figura, coerentemente, le mostra in equilibrio tra loro<br /> |
Il cicloesano, se in conformazione planare, non fa eccezione. Esistono tuttavia due conformazioni perfettamente compatibili con l'ibridazione sp<sub>3</sub> dei carboni: quelle a '''sedia'''. Si parla di conformazioni poichè per passare dall'una all'altra sono necessarie solo rotazioni di legami σ. La figura, coerentemente, le mostra in equilibrio tra loro<br /> |
||
Proiettare il cicloesano secondo Newman evidenzia il fatto che i protoni siano perfettamente sfalsati. <br /> |
Proiettare il cicloesano secondo Newman evidenzia il fatto che i protoni siano perfettamente sfalsati. <br /> |
||
Nelle conformazioni a sedia è possibile |
Nelle conformazioni a sedia è possibile notare come 4 carboni identifichino un piano. Rispetto a questo si possono notare idrogeni protesi verso l'alto e verso il basso. Quelli diretti al di sopra del piano sono alternativamente rivolti perpendicolarmente rispetto al piano stesso ('''assiali''') e quasi parallelamente ('''equatoriali'''). La stessa cosa vale per quelli diretti al di sotto del piano. <br /> La rappresentazione di Newman mostra come un gruppo in direzione equatoriale si trovi al di sopra del piano costituito dai carboni quando il gruppo in assiale legato al medesimo carbonio sia diretto in basso. |
||
{| {{Tabella_Ch_Org}} |
{| {{Tabella_Ch_Org}} |
||
| Riga 29: | Riga 29: | ||
|} |
|} |
||
==Approfondimenti== |
== Approfondimenti == |
||
; Software gratuiti |
; Software gratuiti |
||
: [http://www.arguslab.com/ Arguslab] permette, tra le molte funzioni di cui dispone, di calcolare le energie che caratterizzano le molecole organiche e di disegnare gli orbitali molecolari |
: [http://www.arguslab.com/ Arguslab] permette, tra le molte funzioni di cui dispone, di calcolare le energie che caratterizzano le molecole organiche e di disegnare gli orbitali molecolari |
||
Versione delle 16:45, 17 mar 2008
Come verificare la stabilità relativa di due molecole
Una delle strade più percorse per verificare la stabilità relativa di due molecole organiche consiste nel trasformarle, attraverso reazioni chimiche, nella stessa sostanza, più stabile di entrambe, quantificando l'energia liberata nei due casi. La specie che per trasformarsi ha liberato meno energia è la più stabile.
Gli alcani (CnH2n+2) in presenza di un eccesso di ossigeno ed elevate temperature reagiscono con l'O2 per formare nCO2 e (n+1)H2O con reazione esotermica (combustione), cioè con produzione di calore. Questa razione risponde pienamente allo scopo.
Naturalmente maggiore è la lunghezza della catena dell'alcano, maggiore è il calore che viene prodotto. La stabilità di due alcani a peso molecolare diverso può dunque essere confrontata dividendo il calore totale sprigionato per il numero dei carboni che compongono la catena. É da notare come contemporaneamente al calore sviluppato aumenti anche la temperatura di attivazione della reazione: gli alcani a peso molecolare sopra il C30 sono cattivi combustibili. Un esempio è dato dal [w:bitume|bitume]].
Alcani: Stabilità relativa degli isomeri
| Stabilità relativa di due isomeri del pentano |
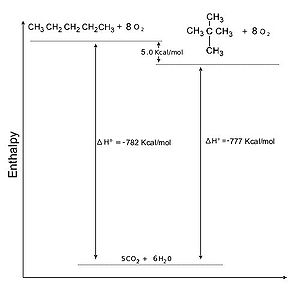 |
La tensione d'anello nei cicloalcani
Poichè i cicloalcani sono caratterizzati da un numero diverso di atomi di carbonio, un confronto sulla loro stabilità relativa può essere basato sul calore di combustione sviluppato solo dividendo tale quantità per il numeri di carboni. Il calore sviluppato per carbonio decresce da ciclopropano a cicloesano, risale dal cicloesano fino al cicloalcano a 15 carboni (pentadecano), poi si stabilizza. I carboni che compongono un alcano sono ibridati sp3, così che i gruppi ad essi legati tendono a formare angoli di 109.5 gradi tra loro. La configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l'eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita tensione d'anello.
Caso cicloesano
Il cicloesano, se in conformazione planare, non fa eccezione. Esistono tuttavia due conformazioni perfettamente compatibili con l'ibridazione sp3 dei carboni: quelle a sedia. Si parla di conformazioni poichè per passare dall'una all'altra sono necessarie solo rotazioni di legami σ. La figura, coerentemente, le mostra in equilibrio tra loro
Proiettare il cicloesano secondo Newman evidenzia il fatto che i protoni siano perfettamente sfalsati.
Nelle conformazioni a sedia è possibile notare come 4 carboni identifichino un piano. Rispetto a questo si possono notare idrogeni protesi verso l'alto e verso il basso. Quelli diretti al di sopra del piano sono alternativamente rivolti perpendicolarmente rispetto al piano stesso (assiali) e quasi parallelamente (equatoriali). La stessa cosa vale per quelli diretti al di sotto del piano.
La rappresentazione di Newman mostra come un gruppo in direzione equatoriale si trovi al di sopra del piano costituito dai carboni quando il gruppo in assiale legato al medesimo carbonio sia diretto in basso.
| Conformazioni a sedia del cicloesano | Cicloesano visto con proiezione di Newman |

|

|
Approfondimenti
- Software gratuiti
- Arguslab permette, tra le molte funzioni di cui dispone, di calcolare le energie che caratterizzano le molecole organiche e di disegnare gli orbitali molecolari
