Chimica organica/Sostituzione nucleofila al carbonio saturo: differenze tra le versioni
mNessun oggetto della modifica |
|||
| Riga 96: | Riga 96: | ||
[[Categoria:Chimica organica|Sostituzione nucleofila al carbonio saturo]] |
[[Categoria:Chimica organica|Sostituzione nucleofila al carbonio saturo]] |
||
{{Avanzamento| |
{{Avanzamento|25%|15 dicembre 2008}} |
||
Versione delle 00:21, 16 dic 2008
Informazioni di base
Le reazioni di sostituzione nucleofila al carbonio saturo riguardano gli alogenoalcani che si trovino in presenza di una specie nucleofila[1].
| Elettronegatività di carbonio e alogeni secondo la scala di Pauling | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| C | 2.5 | F | 4.0 | Cl | 3.0 | Br | 2.8 | I | 2.5 |
| Forza del legame tra carbonio ed alcuni nuclei | |||||||||
| C-H | 413 | C-F | 467 | C-Cl | 346 | C-Br | 290 | C-I | 228 |
Il legame carbonio - alogeno degli alogenoalcani caratterizzati da atomo di fluoro, cloro o bromo risulta polarizzato in modo permanente a causa della superiore elettronegatività dell'alogeno rispetto al carbonio, come mostrato a lato. Il legame carbonio - iodio non rappresenta un dipolo elettrico pemanente, data la pari elettronegatività dei due elementi, ma è facilmente polarizzabile da molecole vicine con caratteristiche opportun, per esempio caratterizzate da coppie di elettroni di non legame.
In via qualitativa è possibile affermare che la forza con la quale un carbonio si leghi ad un altro nucleo dipenda da quanto i rispettivi orbitali di legame si sovrappongano. La tabella a destra mostra che la sovrapposizione è tanto migliore quanto più la dimensione degli orbitali è simile: il legame C-F è più forte di quello C-H. Gli altri alogeni, facenti parte di periodi diversi da quello del carbonio si legano in modo via via più debole.
Nucleofilicità
Un nucleofilo è una specie che partecipa alla reazione donando una coppia di elettroni: esso è dunque una base di Lewis. Nucleofilicità e basicità non vanno però confuse: la prima è un fenomeno cinetico, mentre la seconda tipicamente di equilibrio.
I fattori più importanti che regolano la nucleofilicità sono stati riassunti da Pearson[2]:
- basicità
- polarizzabilità
- presenza di coppie solitarie in atomi vicinali (effetto α )
Recentemente Mayr e collaboratori hanno sviluppato due scale assolute [1] di nucleofilicità [3] [4].
Regole di Kornblum
La polarizzabilità menzionata in precedenza è concettualmente legata alla teoria degli acidi e basi soft e hard (teoria HSAB) ed di grande importanza per quei nucleofili che hanno più di un sito reattivo, e possono quindi dare più prodotti a seconda del substrato.
In tali casi le regole di Kornblum' spiegano la reattività dei nucleofili/elettrofili bidentati alla luce delle interazioni hard-hard e soft-soft [5].
Un esempio è la reazione di un β-lattone con due nucleofili: lo ione cianuro, soft, e quello alcossido, hard. Il β-lattone può essere attaccato od al carbonio in β al carbonile, relativamente soft, e quello carbonilico, reso hard dalla ibridazione sp2 e dai due ossigeni elettron-attrattori.
Come previsto, i due reattivi portano a due molecole completamente diverse.

Meccanismi di reazione
Meccanismo SN2

Il nucleofilo ed il nucleofugo si trovano in direzioni opposti dell'atomo di carbonio, il che porta all inversione del stereocentro ( inversione di Walden)
La necessità di inversione della configurazione rende impossibile questo meccanismo in centri dalla configurazione rigida, come ad esempio per l'1-norbornile.
Meccanismo SN1
In alternativa, la partenza del nucleofugo può avvenire prima che il nucleofilo si leghi al carbonio, con la lenta formazione di un carbocatione intermedio che reagisce poi rapidamente per dare un prodotto di sostituzione.
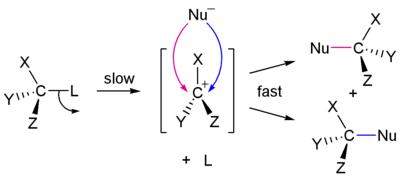
Un carbocatione è ibridato sp2, planare, ed il nucleofilo può attaccare su entrambe le facce, portando a una miscela dei due enantiomeri nel caso di un carbocatione prochirale (racemizzazione). Il meccanismo SN2 è quindi non-stereospecifico.
Dato che lo stadio lento è la formazione del carbocatione intermedio, la concentrazione del nucleofilo non ha effetto sulla velocità di reazione, che mostra un andamento del primo ordine nel substrato.

Questo meccanismo è preferito quando il substrato può generare carbocationi stabili, cioè secondari o terziari. Questo meccanismo non è possibile su carboni primari. Dato che i carbocationi sono formati, sono possibili anche tutti i prodotti derivanti dalla trasposizione dello scheletro, soprattutto quando il carbocatione originario è secondario.
Competizione SN1 ed SN2
Reazioni di eliminazione
Da spostare in pagina apposita Eliminazione bimolecolare E2
Partecipazione del gruppo vicinale

Bibliografia
- ↑ http://goldbook.iupac.org/N04251.html
- ↑ Edwards J.O., Pearson R.G., J. Org. Chem. 1962 84 16-24
- ↑ Lucius R., Loos R., Mayr H., Angew. Chem. Int. Ed. 2002, 41, 91-95
- ↑ Mayr H., Ofial A.R., Pure Appl. Chem. 2005 77 1807-1821
- ↑ Ho Tse-Lok, Hard and Soft Acids and Bases Principle in Organic Chemistry,Academic Press, 1977, ISBN 0123500508
