Chimica per il liceo/I legami: differenze tra le versioni
m fix |
|||
| Riga 34: | Riga 34: | ||
=== Legame dativo === |
=== Legame dativo === |
||
È possibile in alcuni casi la formazione di un legame chimico in cui entrambi gli elettroni di legame sono forniti dallo stesso atomo, questa situazione è detta '''legame dativo'''. |
È possibile in alcuni casi la formazione di un legame chimico in cui entrambi gli elettroni di legame sono forniti dallo stesso atomo, questa situazione è detta '''legame dativo''' (od anche '''di coordinazione'''). Questo legame è recentemente considerato obsoleto, in quanto è una forma di legame dativo. Infatti la sua natura, una volta instauratosi il legame, non è diversa da quella di un qualunque legame covalente. |
||
Perché si possa formare un legame dativo è necessaria la presenza di un atomo A, che fungerà da donatore, dotato di un doppietto elettronico libero (ad esempio un atomo di zolfo, ossigeno, azoto...), e di un atomo B, che fungerà da accettore, con la possibilità di accettare gli elettroni di legame e con elettronegatività maggiore dell'atomo A. |
Perché si possa formare un legame dativo è necessaria la presenza di un atomo A, che fungerà da donatore, dotato di un doppietto elettronico libero (ad esempio un atomo di zolfo, ossigeno, azoto...), e di un atomo B, che fungerà da accettore, con la possibilità di accettare gli elettroni di legame e con elettronegatività maggiore dell'atomo A. |
||
Versione delle 21:15, 10 nov 2011
Una legge valida per tutti i sistemi chimico-fisici è che sono in uno stato ottimale quando hanno il minimo contenuto di energia. Gli atomi tendono ad avere l'ottetto, condizione energicamente stabile in cui ci sono otto elettroni nel livello più esterno. Gli atomi cercano di raggiungere l'ottetto cedendo o acquistando elettroni.
Quando gli atomi si scambiano uno o più elettroni si incontrano e mettono in comune una regione di spazio (nube elettronica di legame), in modo da raggiungere la situazione di ottetto. Il nucleo attrae gli elettroni propri ma anche quelli dell'altro atomo con cui si è legato. La forza con cui un atomo attrae l'altro dipende per lo più dalla grandezza dell'atomo.
La forza di un legame (forza di legame) è quell'energia necessaria per rompere un legame, facendo tornare un composto alla sua situazione precedente.
Quando la differenza di elettronegatività è compresa tra 0 e 0,4 si ha un legame ompolare, se essa è compresa tra 0,5 e 1,7 (a volta anche 1,8) è considerato eteropolare, infine se è superiore a 1,7 (fino a un limite di 4) si ha un legame ionico.
Legame omopolare
Il legame omopolare o covalente puro si forma tra due atomi della stessa specie. C'è una distribuzione simmetrica della carica, infatti, la nube elettronica di legame viene attratta con la stessa forza dagli atomi, e viene condivisa mediamente nel tempo tra i due atomi; non avviene una sperazione di cariche netta.

Legame eteropolare
Nel legame eteropolare o covalente polare, gli elettroni di legame stanno di più su un atomo che su un altro, la dissimetria nella distrubuzione delle cariche non è però esasperata come nel legame ionico. Le cariche sono simboleggiate dalla lettera greca δ che indica una carica parziale che l'atomo acquista a seguito della formazione del legame.
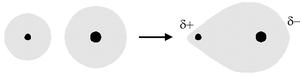
Un esempio di legame eteropolare è il legame che intercorre tra due atomi di litio (Li) e uno di ossigeno (O).

Legame ionico
La maggior parte delle sostanze solide presenta il legame ionico, i loro ioni si dispongono secondo un reticolo cristallino (cella cristallina).
In conseguenza della formazione di un legame ionico, gli atomi diventano degli ioni (ossia atomi carichi, positivi e negativi). Gli elettroni si spostano totalmente dalla parte dell'atomo più elettronegativo, ossia che attrae con più forza gli elettroni di valenza. Gli ioni si dispongono secondo il reticolo cristallino che fa si che per rompere il legame sia necessario superare e l'attrazione elettronica e l'energia reticolare, che è l'energia fisica dovuta alla disposizione cristallina che conferisce ulteriore stabilità. C'è, quindi, una distribuzione delle cariche asimmetrica ed è per questo il legame più forte. La densità di probabilità elettronica in un legame ionico è tutta sull'atomo più elettronegativo.

Legame dativo
È possibile in alcuni casi la formazione di un legame chimico in cui entrambi gli elettroni di legame sono forniti dallo stesso atomo, questa situazione è detta legame dativo (od anche di coordinazione). Questo legame è recentemente considerato obsoleto, in quanto è una forma di legame dativo. Infatti la sua natura, una volta instauratosi il legame, non è diversa da quella di un qualunque legame covalente.
Perché si possa formare un legame dativo è necessaria la presenza di un atomo A, che fungerà da donatore, dotato di un doppietto elettronico libero (ad esempio un atomo di zolfo, ossigeno, azoto...), e di un atomo B, che fungerà da accettore, con la possibilità di accettare gli elettroni di legame e con elettronegatività maggiore dell'atomo A.
Un esempio di questo tipo di legame è lo ione ammonio [NH], in cui l'atomo di azoto della molecola di ammoniaca mette in compartecipazione il suo doppietto elettronico per formare un legame con l'atomo di idrogeno H.
Generalmente gli atomi donatori hanno caratteristiche di base di Lewis mentre gli accettori hanno caratteristiche di acido di Lewis, in questi termini la formazione di un legame dativo può essere vista come una reazione acido-base; se prendiamo l'esempio di sopra si può vedere la reazione di formazione dello ione ammonio come NH + H [NH] in cui l'ammoniaca è la base di Lewis, il protone è l'acido di Lewis e lo ione ammonio è l'addotto.
Una branca della chimica in cui i legami dativi rivestono una grande importanza è la chimica dei composti di coordinazione, oltre che quella organometallica.
I legami dativi consentono inoltre, in molti casi, di ottenere effetti particolari, come ad esempio la catalisi per trasferimento di fase utilizzando eteri corona.




