Utente:Riccardo Rovinetti/Sandbox 30: differenze tra le versioni
Nessun oggetto della modifica |
Nessun oggetto della modifica |
||
| Riga 44: | Riga 44: | ||
[[File:Iidratazione SO3.png|center|1000px]] |
[[File:Iidratazione SO3.png|center|1000px]] |
||
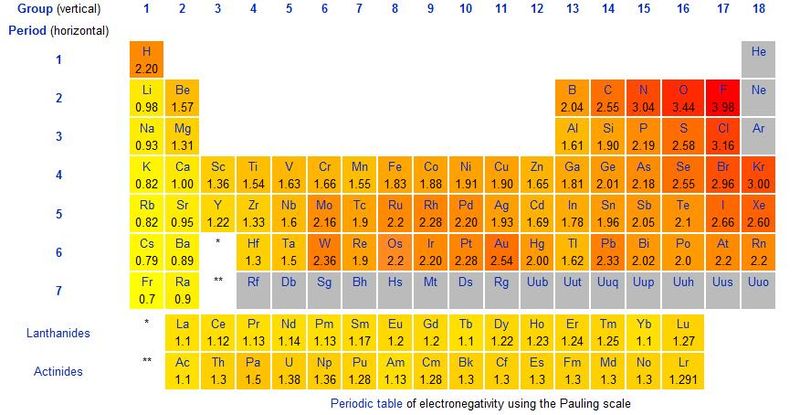
Atomi di elementi diversi attraggono i propri elettroni con forze diverse, misurate da una scala detta dell''''elettronegatività''', riportata su tutte le tavole periodiche. |
|||
| ⚫ | |||
La seconda regola fondamentale dice che <u>ogni atomo tende ad assumere la stessa configurazione elettronica del gas nobile più vicino</u>, cioè ad avere otto elettroni nel suo guscio di valenza. Per fare ciò esso potrà acquistarne da altri atomi, e raggiungere il gas nobile del suo periodo (quello alla fine della sua riga) o a perderli e raggiungere la configurazione del gas nobile del livello precedente (l'ultimo elemento a destra della riga superiore). Essa è chiamata '''regola dell'ottetto''' ed è stata già accennata prima: la maggior parte degli atomi ha la tendenza ad avere otto elettroni nel loro guscio più esterno (da questo deriva ''ottetto''), come hanno tutti i gas nobili (ad eccezione dell'elio). Facciamo degli esempi. |
|||
L'ossigeno appartiene al gruppo A-VI della tavola periodica (lo si può vedere nell'immagine sopra) ed ha la seguente struttura di Lewis: |
|||
[[File:Lewis dot O.svg|center|150px]] |
|||
Avendo solo 6 elettroni di valenza tenderà ad acquistarne due per raggiungere l'ottetto.<br /> |
|||
Possiamo trovare in natura l'ossigeno in due sostanze indispensabili per la vita: l'acqua e l'aria. <br /> |
|||
Queste sono le rispettive strutture di Lewis dei loro componenti ossigenati: l'[[w:Acqua|ossido di idrogeno]] (chiamato semplicemente acqua anche in chimica), l'ossigeno molecolare (che compone il 21% dell'aria) e l'[[w:Anidride carbonica|anidride carbonica]] (emessa dai viventi durante la respirazione). |
|||
{{Tripla immagine|center|Ossigeno lewis.png|200|Acqua Lewis.png|200|Carbon-dioxide-octet-Lewis-2D.png|200|A sinistra la struttura di Lewis dell'ossigeno molecolare, al centro quella dell'acqua e a destra quella dell'anidride carbonica.}} |
|||
Nella prima immagine troviamo due atomi di ossigeno che si scambiano i propri elettroni spaiati. Così facendo i due elementi si ritrovano ad avere tutti gli elettroni appaiati, e ciò permette ad entrambi gli atomi di raggiungere la configurazione del gas nobile.<br /> |
|||
Nella seconda immagine possiamo osservare una molecola composta da due elementi diversi, idrogeno e ossigeno, entrambi aventi i propri livelli "sazi" di elettroni: l'idrogeno ottiene l'elettrone spaiato dell'ossigeno, andando a completare con due elettroni il livello 1 e raggiungendo la configurazione elettronica dell'elio (He, elemento 2) mentre l'ossigeno guadagna due elettroni dagli idrogeni, trovandosi 8 elettroni nel suo guscio di valenza (livello 2), gli stessi del gas nobile del suo periodo, il neon (Ne, elemento 10).<br /> |
|||
Nella terza immagine vediamo due ossigeni legati ad un atomo di carbonio (C, elemento 12). Quest'ultimo è il capostipite del IV gruppo degli elementi rappresentativi, il che significa che la sua valenza è 4. Esso è quindi in grado di prestare due suoi elettroni a due atomi di ossigeno, che completano il loro ottetto, e nel contempo lui si ritrova vicini due elettroni in più per ogni atomo di ossigeno, ottenendo anch'egli i quattro elettroni necessari a raggiungendo l'ottetto.<br /> |
|||
Dall'immagine a sinistra notiamo un'altra cosa molto importante: anche gli elementi allo stato fondamentale, cioè sostanza formate da un solo elemento chimico, hanno una specifica struttura molecolare (in questo caso l'ossigeno molecolare è composto da due atomi di ossigeno legati assieme). Solo i gas nobili, che hanno appunto l'ottetto completo, non necessitano di legarsi con altri elementi e quindi si trovano sempre sotto forma di singoli atomi, ma tutti gli altri si ritrovano legati in molecole.<ref>Gli altri elementi possono trovarsi come atomi solati solo in condizioni estreme. Per esempio, all'interno del sole la temperatura è tale che la materia si ritrova in stato di plasma, e cioè elettroni e nuclei atomici fluttuano liberi senza riuscire a legarsi in maniera stabile. Tuttavia tali condizioni sono molto difficili da riprodurre in un normale laboratorio chimico.</ref> |
|||
La terza regola fondamentale è quella dell''''ottetto espanso'''. Un atomo che non ha completato il proprio ottetto può sottrarre una coppia di elettroni ad un altro atomo che ha già il guscio esterno completo.<br /> |
|||
Facciamo un esempio con fluoro (F, elemento 9) e cloro (Cl, elemento 17). Essi hanno entrambi 7 elettroni nel loro guscio di valenza, e quindi entrambi ne condivideranno uno ciascuno per completare l'ottetto.<ref>Si noti che i legami chimici sono sempre formati da due elettroni, non c'è mai un solo elettrone che tene cinti due atomi insieme, ma vanno sempre a formare doppietti elettronici.</ref> |
|||
[[File:Fluoruro di cloro Lewis.png|center|150px]] |
|||
Tuttavia in alcune condizioni particolari una molecola di fluoro può ulteriormente reagire con il cloro strappandogli una coppia di elettroni, andando a formare il [[w:Trifluoruro di cloro|trifluoruro di cloro]]. |
|||
| ⚫ | |||
Nella molecola precedente il cloro e il fluoro mettevano in compartecipazione i propri elettroni ed entrambi raggiungevano l'ottetto. Ma in questa due atomi di fluoro sottraggono una coppia di elettroni appaiati al cloro, andando a formare quella che si chiama '''molecola ipervalente''' cioè una molecola in cui un atomo mette in compartecipazione un suo doppietto elettronico anche se ha già l'ottetto completo.<br /> |
|||
Nella molecola di trifluoruro di cloro l'atomo centrale possiede ancora due coppie di elettroni, ma può cederne solo una ad un'altra molecola di fluoro, diventando [[w:Pentafluoruro di cloro|pentafluoruro di cloro]].<ref>Si noti che nelle due immagini la struttura di Lewis è leggermente diversa: per questioni di spazio i doppietti elettronici possono essere rappresentati con delle stanghette attorno al simbolo atomico. Gli elettroni appaiati in un legame chimico vengono invece rappresentate con delle linee che collegano i due elementi. Gli elettroni invece ceduti da un atomo diventato ipervalente (in questo caso il cloro) vengono contrassegnati con una freccia, e a volte, per segnalare che sono passati da un atomo ad un altro, la freccia è rivolta verso una '''x''' che simboleggia la vacanza elettronica nell'atomo accettore (il fluoro nelle immagini). Si veda [[w:Struttura di Lewis|Struttura di Lewis]] su Wikipedia e [[commons:Category:Lewis structures|Lewis structures]] su commons.</ref> |
|||
[[File:Pentafluoruro di cloro Lewis.png|center|800px]] |
|||
Quanto un atomo possa essere "generoso" con altri dipende dalle proprietà chimico-fisiche di essi e dalle condizioni in cui vengono fatti combinare, fattori che verranno spiegati in seguito. |
|||
==Note== |
==Note== |
||
Versione delle 22:22, 17 apr 2014

|

|

|
Nell'ambiente in cui viviamo non troviamo quasi mai atomi singoli, ma composti chimici in cui essi sono combinati fra loro.
Ciò che tiene insieme due atomi è chiamato legame chimico. Esso è dovuto all'attrazione tra le cariche di segno opposto dei nuclei atomici e quelle degli elettroni di legame; una specie di tiro alla fune fra atomi, in cui la corda sono due elettroni. Una situazione simile si ha quando si collegano due calamite tramite un chiodo; le due calamite sono i due atomi ed il chiodo in mezzo è il legame chimico che li tiene uniti. Ciò permette di creare un aggregato di atomi, che nel linguaggio chimico è chiamato molecola. L'immagine in alto a destra rappresenta una molecola dell'acqua, composta da due atomi di idrogeno legati ad uno di ossigeno. Tramite altri legami elettrostatici (più deboli) le molecole si attraggono fra loro ed è così che si forma l'aggregato che noi chiamiamo sostanza chimica.
Gli atomi tuttavia non si combinano in maniera casuale come fanno pezzi di ferro e calamite: esistono diversi tipi di legami chimici, ed essi seguono precise regole di combinazione.
La prima per importanza dice che un atomo quando si combina con un altro lo fa solo con gli elettroni presenti nel suo livello più esterno (chiamati elettroni di valenza).
Questo perché, come già detto in precedenza, gli elettroni in uno stesso livello energetico hanno tutti la stessa distanza dal nucleo, e quindi sono attratti tutti con la stessa forza, ed essendo nel livello più esterno sono quelli che risentono di meno di questa attrazione; così possono essere attratti da un atomo vicino per formare un legame chimico, mentre quelli nel livello sottostante sono molto più vicini al nucleo e quindi occorre molta più energia per allontanarli da esso, quasi sempre troppa per creare un legame stabile.
Per questo motivo, quando verranno mostrate alcune combinazioni degli elementi, si potranno rappresentare gli atomi semplicemente disegnando il loro simbolo circondato dagli elettroni di valenza. Questo tipo di rappresentazione atomica è detta struttura di Lewis.

Va tuttavia fatto notare che non sempre gli elettroni di valenza (cioè quelli che può scambiare) sono tutti quelli presenti nel livello più esterno. Per questo motivo la tavola periodica è divisa in tre blocchi in cui i gruppi si ripetono periodicamente.

- Gli elementi rappresentativi sono evidenziati in rosa ed il loro blocco è diviso in gruppi numerati con numeri romani accostati alla lettera A. Essi sono in grado di mettere in compartecipazione tutti i loro elettroni, eccezion fatta per i gas nobili, poco reattivi poiché nel loro guscio di valenza gli elettroni sono già tutti appaiati. Essi sono chiamati rappresentativi perché le loro proprietà chimiche sono abbastanza periodiche, regolari, e perciò sono esempi affidabili, rappresentativi delle leggi chimiche illustrate a breve.
- I metalli di transizione sono evidenziati in verde. Questo è il primo gruppo a non rispettare del tutto le regole di periodicità degli altri gruppi, infatti i primi 5 elementi posseggono da 3 ad 8 elettroni nel loro guscio di valenza, e (a seconda delle condizioni) sono in grado di impiegarli tutti in legami chimici. I metalli del gruppo del cobalto (Co) e del nichel (Ni) tuttavia posseggono rispettivamente 9 e 10 elettroni nel loro guscio di valenza, ma quelli che mettono a disposizione in legami chimici sono al massimo 3 o 4. Lo stesso accade per i metalli dei due gruppi successivi, rame e zinco, chiamati gruppo B-I e B-II proprio perché possono mettere in compartecipazione uno o due elettroni (eccezion fatta per l'oro).[1]
- I metalli di post-transizione, in azzurro, sono l'ultimo blocco e sono molto rari nella vita comune (compresi i laboratori non specializzati). le loro proprietà chimiche non sono periodiche (come accade anche per alcuni metalli di transizione) ma verrà spiegato a breve come superare questo problema.
A seconda delle loro caratteristiche chimiche due elementi possono combinarsi seguendo due modalità di legame.
Essi possono limitarsi ad appaiare gli elettroni che si trovano spaiati nel loro guscio di valenza:
Generalmente gli elementi rappresentativi tendono a mettere in compartecipazione tutti i loro elettroni spaiati, poiché gli orbitali senza elettroni lasciano spazio ad altri elettroni che vi cadono per l'attrazione elettrostatica del nucleo. Il numero di orbitali nel guscio di valenza di un elemento rappresentativo è 4, e di conseguenza essi tenderanno a raggiungere il numero di 8 elettroni in esso; per questo motivo tale consuetudine è chiamata regola dell'ottetto (anche se esistono numerose eccezioni, per esempio l'intero blocco dei metalli di transizione).
La seconda modalità è instaurare un legame dativo: un elemento che ha già raggiunto l'ottetto (quindi già parte di una molecola) può cedere una coppia di elettroni già appaiati nel guscio di valenza (detta coppia solitaria) ad un altro atomo abbastanza "forte" da sottrarglieli.

Questo tipo di legame può avere due sensi: l'atomo al centro della molecola può possedere coppie solitarie da donare ad altri atomi (immagine sopra), ma una volta impoverito della propria nube elettronica la carica del nucleo sarà nuovamente scoperta, e quindi in grado a sua volta di attirare gli elettroni di altre entità molecolari creando una molecola ancora più grande.

Vi è in fine la possibilità che due molecole si leghino riarrangiando i propri legami chimici senza cambiarne la natura (un dativo rimane un dativo, un covalente rimane un covalente) ma semplicemente ricollocando gli elettroni di legame per lasciar spazio ad un'altra molecola.

Atomi di elementi diversi attraggono i propri elettroni con forze diverse, misurate da una scala detta dell'elettronegatività, riportata su tutte le tavole periodiche.
Note
- ↑ Il motivo di ciò sta nel fatto che in realtà non tutti gli orbitali in uno stesso livello energetico sono uguali: quelli in cui orbitano gli elettroni dei primi 5 elementi del gruppo sono di tipo d e contengono solo elettroni spaiati, mentre quelli degli elementi successivi iniziano a riempirsi. Gli elementi successivi a quelli del gruppo dello zinco sono elementi rappresentativi ed anch'essi assumono una valenza diversa perché nello stesso livello utilizzano un altro tipo di orbitali ancora, il tipo p. Questo problema tuttavia può essere tralasciato, poiché verrà spiegato meglio in seguito come capire quanti elettroni può condividere con altri atomi il metallo.



