Chimica generale/Gas ideali: differenze tra le versioni
m Corretto: "un gas" |
|||
| Riga 50: | Riga 50: | ||
Una trasformazione isoterma di un gas è una trasformazione che avviene a temperatura costante. |
Una trasformazione isoterma di un gas è una trasformazione che avviene a temperatura costante. |
||
===Energia di |
===Energia di un gas perfetto, di un gas reale e di un cristallo ionico=== |
||
I gas perfetti, i gas reali e la materia sono dotati di [[energia]], precisamente: |
I gas perfetti, i gas reali e la materia sono dotati di [[energia]], precisamente: |
||
* un gas perfetto di |
* un gas perfetto di |
||
Versione attuale delle 15:46, 23 mag 2021
I gas perfetti[modifica]
Gas reali e gas ideali[modifica]
- Per gas ideale si intende un gas estremamente rarefatto e lontano dal suo punto di condensazione, bassa pressione e alta temperatura.
- Un gas reale è un qualsiasi gas nelle condizioni di pressione e temperatura normali.
Quanto rarefatto? Finché non esistono più interazioni fra le molecole.
Descrizione microscopica del gas perfetto[modifica]
Un gas ideale è costituito da
- sferette di tipo elastico
- con dimensioni piccole confronto a quelle del recipiente
- non esistono interazioni di attrazione o repulsione
- (conseguenza) l'unica forma di energia è quella cinetica
Variabili termodinamiche[modifica]
Le variabili termodinamiche di un qualsiasi gas sono due qualsiasi delle grandezze termodinamiche fondamentali pressione, volume e temperatura. Queste variabili descrivono lo stato termodinamico del sistema. Inverso: lo stato termodinamico di un sistema è definito dalle tre variabili fondamentali.
Equilibrio termodinamico ed equilibrio di stato f(ptv)[modifica]
Si dice che un gas si trova in equilibrio termodinamico quando si trova in modo univoco, cioè si basa su 3 condizioni:
- equilibrio meccanico, pressione
- equilibrio chimico
- il gas non deve essere un sistema chimico ossia non deve esistere nessuna combinazione chimica
- non ci siano diffusioni di molecole
- equilibrio termico ossia non deve esserci nessuna differenza di temperatura fra due parti del gas
Un sistema termodinamico è un numero molto grande di particelle che ci interessano nel loro insieme.
Variazione di un sistema termodinamico è quel passaggio da uno stato di equilibrio detto stato iniziale ad un nuovo stato di equilibrio, detto stato finale che avviene per una variazione delle variabili termodinamiche che definiscono il sistema.
Rappresentazioni grafiche[modifica]

Le rappresentazioni grafiche servono per seguire visivamente l'evoluzione dei fenomeni e capire a colpo d'occhio quel che sta succedendo in un dato momento e per fare delle deduzioni su quello che succede ad una variabile, al variare di una o l'altra variabile.
Le rappresentazioni grafiche dei gas, esprimono lo stato di un gas a determinate condizioni di pressione, volume e temperatura. Dunque la rappresentanzione di un gas può essere di tipo spaziale o tridimensionale. Dato che per determinare lo stato di un gas bastano due variabili solamente in quanto la terza è sempre derivabile, si usa rappresentare lo stato di un gas per mezzo di una rappresentazione bidimensionale. Per comodità di usano diversi piani a seconda dei fenomeni che si vuole rappresentare; si chiama
- piano di Amagat, il piano che ha per coordinate pV e p
- piano di Clapeyron, il piano che ha per coordinate p e V
Trasformazioni termodinamiche reversibili e irreversibili[modifica]
Trasformazione reversibile è quella che avviene attraverso una successione di stati infiniti di equilibrio. Nel passaggio da un equilibrio iniziale P1 ad un equilibrio finale P2, si può avere una trasformazione reversibile o irreversibile; la reversibile è una astrazione (non esiste) perché non vi può essere un equilibrio termodinamico, punto per punto. In pratica le trasformazioni sono irreversibili perché in esse si ha sempre un cambiamento delle variabili,
Equazione di stato dei gas perfetti[modifica]
Pressione (p), volume (V) e temperatura (T) sono collegate fra loro dalle seguenti relazioni:
- pV=nRT valida per i gas perfetti
- f(p,V,T)=0 valida per i gas reali (è quasi impossibile trovare questa funzione per i gas reali)
Termostati e trasformazioni isoterme dei gas[modifica]
Un termostato è un apparecchio per mantenere la temperatura costante, come per esempio il termostato a ghiaccio di Bunsen. Una trasformazione isoterma di un gas è una trasformazione che avviene a temperatura costante.
Energia di un gas perfetto, di un gas reale e di un cristallo ionico[modifica]
I gas perfetti, i gas reali e la materia sono dotati di energia, precisamente:
- un gas perfetto di
- energia cinetica di translazione, rotazione, oscillazione
- interazioni fra nuclei atomici di attrazione e repulsione
- risonanza
- energia di massa
- e altre
- gas reale di
- energia newtoniana ossia ha una massa
- energia coulombiana ossia ha una carica
- cristallo ionico di una energia di vibrazione

Legge di Boyle e definizione di gas ideale[modifica]
- Il volume di una certa quantità di gas è inversamente proporzionale alla pressione
- pv=k
La legge di Boyle è una legge limite che si verificherebbe per un
- gas perfetto o gas ideale è un gas le cui molecole hanno un volume proprio, trascurabile rispetto al volume totale del gas e in cui l'attrazione reciproca delle molecole è infinitamente piccola rispetto alla pressione esterna
Confronto fra gas reali e gas perfetti: legge di Boyle e sua rappresentazione (curve isoterme) nel piano di Amagat e di Clapeyron[modifica]
- OA ideale per gas perfetto pV=k
- OC comportamento di idrogeno, elio e neon
- OB tutti gli altri gas,
- OE dapprima si comprimono più di quanto si calcoli con la legge di Boyle
- EB e poi per forti pressioni si comportano come idrogeno, elio e neon.
In realtà in tutti i gas si fanno sentire entrambe le deviazioni e a seconda delle condizioni prevale l'una o l'altra curva. A temperature molto alte tutti i gas tendono a comportarsi come l'idrogeno, l'elio e il neon. A temperature molto basse, anche questi ultimi si comportano come tutti gli altri gas e queste temperature sono dette temperature di inversione.
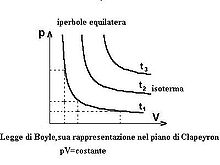
(valida solo per i gas perfetti)
La rappresentazione della legge di Boyle pV=k sul piano di Clapeyron è una iperbole equilatera, dunque sarà:
- simmetrica rispetto alla bisettrice
- asintotica agli assi, ovvero li incontra all'infinito
- i rettangoli formati dalle perpendicolari sugli assi sono tutti uguali

Diminuendo la temperatura di un gas, si giunge ad una temperatura critica in cui l'iperpole equilatera si flette. Diminuendo ulteriormente la temperatura, l'iperbole assume un andamento orizzontale, a causa della pressione che rimane costante per il cambiamento di stato (condensazione), in seguito ad un certo punto il volume è costante perché si ottiene tutto liquido che è poco comprimibile.
Dilatazione termica dei corpi solidi e liquidi[modifica]
- dilatazione lineare
lt=l0(1+α t) dove α =10-5 °C-1
- dilatazione cubica
Vt=V0(1+β t) dove β =3a
Il binomio di dilatazione lineare o cubica varia al variare del materiale usato.
Sostanze termometriche[modifica]
Sono i gas, il mercurio, l' alcool, e altre.
Dilatazione termica dei gas perfetti e prima legge di Gay Lussac[modifica]
1° legge di Volta Gay Lussac (o delle isobariche)
- gli aumenti di volume di un gas a pressione costante
sono direttamente proporzionali al suo volume iniziale ed al binomio di dilatazione Vt=V0(1 + α t)

Abbiamo un gas in un cilindro con pistone mobile (pressione costante). Variando la temperatura, aumentandola da t0 a t1, vediamo che il volume varia secondo la 1° legge di Gay Lussac e precisamente di 1/273,16 del suo volume iniziale

Dilatazione termica dei gas perfetti e seconda legge di Gay Lussac[modifica]
Variazione della pressione con la temperatura a volume costante. Fornendo calore e volendo tenere il volume costante aggiungiamo dei pesi (aumento di pressione). 2° legge di Gay Lussac (o delle isovolumiche) o di Charles
- gli aumenti di pressione di un gas a volume costante
sono direttamente proporzionali agli aumenti di temperatura pt=p0(1 + ß t)
Dimostriamo come α della 1° Legge che chiamiamo per comodità β1, o coefficiente di dilatazione che vale 1/273,16, sia uguale al β della 2° Legge che chiamiamo β2, o coefficiente di tensione, per i gas perfetti.

Per passare dal punto 0 al punto 1 possiamo farlo attraverso molte vie:
- da 0 a 1 in modo diretto, per mezzo di una trasformazione isocora, a volume costante, aumenta la pressione e la temperatura
- da 0 a 2, da 2 a 1 in modo indiretto,
- da 0 a 2 per mezzo di una trasformazione isobara,
a pressione costante, aumenta il volume e la temperatura Vt=V0(1 + β1 t)
- da 2 a 1 per mezzo di una trasformazione isoterma,
a temperatura costante, aumenta la pressione e diminuisce il volume. p0Vt=ptV0
Sostituendo nella p0Vt=ptV0 il Vt=V0(1 + β1 t) si ha p0V0 (1 + β1 t) =ptV0
p0(1 + β1 t) =ptV0/V0
pt=p0(1 + β1 t)
Da cui appare evidente che il coefficiente di dilatazione alfa di un gas è uguale al coefficiente di tensione beta.
