Propulsione aerea/Capitolo III°: differenze tra le versioni
mNessun oggetto della modifica |
m Bot: elimina doppio avanzamento |
||
| Riga 1: | Riga 1: | ||
{{Propulsione aerea}} |
{{Propulsione aerea}} |
||
{{avanzamento|0%}} |
|||
{{Avanzamento|100%|14 dicembre 2012}} |
{{Avanzamento|100%|14 dicembre 2012}} |
||
Versione delle 16:29, 20 nov 2021
Alcune definizioni importanti
termostato - un sistema capace di cedere o assorbire calore senza mutare la propria temperatura.
Termodinamica - è quel ramo delle scienze fisiche che tratta dei rapporti tra calore, lavoro e proprietà dei sistemi materiali interessati. Sistema - è un insieme di materia, in senso generale, racchiuso entro definiti limiti o confini. Pressione - è la forza esercitata da un sistema sulla unità di superficie; quando la pressione varia da punto a punto questa è definita come rapporto tra la forza elementare che si esercita su una supeficie elementare e la superficie elementare stessa. Per simbolo si usa la lettera p.
Peso specifico-densità - è il peso dell'unità di volume; densità è la massa dell'unità di volume. Se si indica con γ il peso specifico e con ρ la densità, si ha
- essendo g l'accelerazione di gravità.
- Le dimensioni di γ sono f l-3; quelle di g, l t-2, ne viene che le dimensioni di ρ sono f l-4 t2.
- Quando la materia non è distribuita uniformemente, peso specifico o densità sono definiti come rapporto tra il peso o la massa del volume elementare considerato e il volume elementare stesso.
Volume specifico - è il volume dell'unità di peso; esso è indicato con v e ha le dimensioni
- .
Il volume specifico è l'inverso dell'unità di peso e si ha sempre γ v=1. Certe volte si considera pure il volume dell'unità di massa.
Il volume dell'unità di massa è g volte quello dell'unità di peso.
Lavoro - in generale, si chiama (per definizione) lavoro L di una forza (di modulo e direzione costanti), il cui punto di applicazione si sposti, il prodotto scalare della forza stessa F per lo spostamento S del suo punto di applicazione.
Energia cinetica - è il semiprodotto della massa di un corpo per il quadrato della velocità.
dimensioni f×l. L'energia cinetica equivale al lavoro.
Potenza - è il lavoro prodotto o assorbito da un sistema nella unità di tempo. Dimensioni f×l×t^{-1}. Unità pratica il cavallo
Temperatura - stato fisico caratteristico di un sistema materiale. Vi sono diversi sistemi di misura: il centesimale in gradi Celsius, il sistema Réamur, il Fahrenheit dei paesi anglosassoni: gradi F. Il sistema assoluto misurato in kelvin K.
Se t è la misura in gradi Celsius e F in gradi Fahrenheit si ha °C=0,555 (F-32). Tra gradi Celsius e kelvin si ha K=273+C.
Si è visto il risultato della teoria cinetica dei gas che accosta il concetto di temperatura assoluta a quello di energia cinetica delle molecole.
Calore - è una delle tante forme dell'energia. Sono occorsi secoli all'umanità per riuscire a distinguere tra calore e temperatura.
Unità di misura è la caloria, quantità di calore necessaria per elevare da 14,5 °C a 15,5 °C un chilogrammo di acqua pura a pressione costante.
Gli anglosassoni usano come unità la B.T.U. uguale a 0,252 calorie.
Una caloria equivale a 427 kgm.
Calore specifico- è il numero di calorie necessarie per elevare di un grado Celsius la temperatura di un chilogrammo di una definita sostanza sotto due condizioni. Il calore specifico varia di regola con la temperatura; in questo caso esso è definito come rapporto tra le calorie per l'aumento infinitesimo di temperatura e l'aumento infinitesimo dello stesso.
Simbolo C, dimensioni
Se viene tolto calore, la quantità di calore, sottratto nell'abbassamento di un grado in 1 kg della sostanza è chiamata frigoria.
La caloria è niente altro che il calore specifico dell'acqua tra 14,4 °C e 15,5 °C.
Stato - stato di un sistema è l'insieme delle condizioni e posizioni di esso definite attraverso la proprietà del sistema stesso; quando esse mutano si ha un cambiamento di stato.
Proprietà - sono definite dalle caratteristiche osservabili di ogni sistema; due stati di un sistema sono uguali, meglio identici, se le proprietà osservabili sono tutte identiche.
Trasformazione Quando un sistema passa da uno stato di equilibrio a un altro, si dice che avviene una trasformazione termodinamica: si distingue tra trasformazioni reversibili, ovvero quelle trasformazioni che consentono di essere ripercorse in senso inverso (si ritorna precisamente al punto di partenza, ripercorrendo all'indietro gli stessi passi dell'andata), e trasformazioni irreversibili, ovvero quelle trasformazioni che, se ripercorse all'indietro, non faranno ritornare al punto iniziale, ma a uno diverso. Perché una trasformazione sia reversibile è necessario che essa avvenga abbastanza lentamente da permettere al sistema di termalizzare (il sistema deve passare attraverso infiniti stati di equilibrio termodinamico). Le trasformazioni termodinamiche possono essere anche dei seguenti tipi: Isobare, se la pressione si mantiene costante; Isocore, se il volume si mantiene costante (e il lavoro scambiato tra sistema ed esterno è dunque nullo); Isoterme, se la temperatura si mantiene costante; Adiabatiche, se il calore totale scambiato è nullo; Isoentropiche, o adiabatiche reversibili, se la variazione di entropia è nulla.
Ciclo - una trasformazione che ha lo stato finale uguale a quello iniziale , si chiama ciclo.
E - modulo di elasticità longitudinale. Rapporto tra lo sforzo unitario a trazione o compressione e relativa deformazione. Per i liquidi e i gas è significativo solo la compressione.
Portata massica
La portata massica si indica con ṁ e indica la massa che scorre attraverso una superficie A nell'unità di tempo e nel Sistema Internazionale si misura in kg/s (l'apostrofo indica una grandezza riferita all'unità di tempo). La portata massica è quindi data da
dove V è una velocità media in direzione normale a una superficie A e ρ una densità.
I due principi della termodinamica
La termodinamica come già detto, è quel ramo delle scienze fisiche che studia i rapporti tra calore, lavoro meccanico e proprietà dei sistemi materiali interessati nei processi relativi.
La termodinamica si erge su due principi fondamentali di natura sperimentale ovviamente.
1° principio- Il primo principio è in sostanza un aspetto particolare del principio generale di conservazione e trasformazione delle varie specie di energie; calore e lavoro meccanico sono equivalenti.
Se come unità di misura del calore si assume la caloria e come unità di misura del lavoro meccanico si assume il kilogrammetro, l'esperienza mostra che una caloria equvale a 427 kilogrammetri.
Se con Q si indica il calore trasformato in lavoro meccanico L, si ha
con J equivalente meccanico del calore = 427 cal/kgm.
Nella dizione lavoro meccanico rientra ovviamente l'aspetto particolare dell'energia cinetica.
Il primo principio venne intuito dal medico tedesco R. Mayer nel 1842 e confermato sperimentalmente dall'inglese Joule, fabbricante di birra, che per primo determinò il valore di J.
Ci vollero quasi 200 anni, da Galileo a Newton, per arrivare alla formulazione del primo principio ed è interessante constatare che questo è dovuto a uomini che non erano fisici di professione.
Altra interessante constatazione è che nel 1842 la macchina termica a vapore era già entrata nell'industria e che la locomotiva era già adulta. Spesso l'esperienza e l'intuizione precedono le formulazioni concettuali nei vari campi delle scienze.
2° principio - Il secondo principio afferma che da un sistema materiale o da più sistemi materiali la cui temperatura sia uguale in ogni punto non si può ricavare alcun lavoro meccanico per via termica.
Si ammette quindi che il sistema non possa fornire lavoro tramite altra trasformazione (chimica, elettrica, ecc.).
Equivalente a questa constatazione sperimentale è il postulato di Clausius: il calore non può passare spontaneamente da un sistema a temperatura inferiore a un sistema a temperatura superiore senza che si manifestino cambiamenti permanenti in altri sistemi sia per riguardo alla natura sia per riguardo alla configurazione; viceversa il calore passa spontaneamente da alta a bassa temperatura.
Il calore per passare da bassa ad alta temperatura necessita di una spesa di lavoro esterno quando non si hanno alterazioni della natura dei sistemi (esempio le macchine frigorifere).
Necessita quindi un salto di temperatura perché possa vereficarsi la trasformazione di calore in lavoro.
Ne segue inoltre che non tutto il calore di un sistema può trasformarsi in lavoro meccanico, dovendo per necessità di cose essere resa non trasformata, a temperatura inferiore, una parte del calore disponibile.
Il rendimento termodinamico di un motore termico quindi non potrà mai essere uguale all'unità; vale la pena sottolineare che questo fatto non è dovuto a imperfezioni della macchina ma a una impossibilità fisica; anche con una macchina idealmente perfetta la trasformazione totale del calore in lavoro non è possibile. Viceversa è sempre possibile trasformare tutto il lavoro in calore.
Trasformazioni dei gas
Quando un sistema, un gas in particolare, varia nei suoi parametri fisici, si dice che percorre una trasformazione.
Per un gas perfetto i parametri fisici sono la pressione, il volume specifico e la temperatura; di questi tre parametri due sono indipendenti, cioè possono essere variati arbitrariamente, il terzo è invece determinato dai primi due tramite l'equazione di stato p v=J R T sempre valida.
Nelle trasformazioni dei gas bisogna porre particolare cura nella definizione del sistema e dei confini di esso, per esempio la trasformazione può avvenire entro un recipiente chiuso ovvero con parete mobile, può avvenire entro un condotto chiuso o aperto a un estremo o a tutti e due e così via; questa definizione delle modalità del sistema è quindi di capitale importanza per evitare dubbi e per non incorrere , come spesso si nota, in equivoci ed errori concettuali.
Si è detto che lo stato del gas perfetto è definito quando sono noti almeno due dei parametri p, v, T, il terzo rimanendo definito dalla legge di stato.
Ora i parametri di stato p, v, T nelle trasformazioni in ambiente chiuso si ammettono uniformi in ogni punto e in ogni direzione in accordo con la concezione dei gas perfetti che sono considerati omogenei, isotropi e in equilibrio entro il sistema.
In queste condizioni nessuna trasformazione potrebbe avvenire perché è necessario che per la trasformazione si manifestino perturbazioni cioè rotture di equilibrio, che poi si propagano all'intera massa interessata sino al raggiungimento del nuovo stato finale del gas.
Le trasformazioni termodinamiche allora sono pensate come composte di una successione di infiniti stati di infinite perturbazioni infinitesime percorse con velocità molto piccola in maniera da ritenere i parametri del fluido uguali sempre in ogni punto.
Queste trasformazioni sono dette limiti, in realtà quindi non esistono, però data la natura speciale del gas, le trasformazioni reali sono abbastanza vicine a quelle limiti: le piccole perturbazioni si propagano con la velocità del suono.
In molti casi è necessario considerare la invertibilità delle trasformazioni; invertibili sono le trasformazioni che esattamente riproducono al contrario una certa trasformazione. In realtà queste trasformazioni non possono esistere. Sono invertibili solamente le trasformazioni limiti.
Ciò premesso la trasformazione può avvenire dentro un ambiente a volume invariabile o variabile. Esempio di ambiente a volume invariabile è il caso di una bombola, di un cilindro con pistone bloccato, ecc.; del secondo un cilindro con pistone mobile, un recipiente chiuso ma deformabile, ecc.
Tutti questi casi sono caratterizzati dal fatto che il gas non possiede energia cinetica apprezzabile rispetto ai confini del sistema così come invece accade per i condotti aperti.
Tra tutte le trasformazioni pensabili alcune presentano particolare importanza concettuale e pratica.
Nelle consideerazioni seguenti ci si riferirà sempre alla unità di peso del gas.
Trasformazione a volume costante
Detta anche isometrica o isocora è definita dalla condizione V = costante o il che è lo stesso da dV=0.
Al gas sia fornito in un modo qualsiasi il calore elementare dQ e il lavoro esterno dL per esempio mediante un dispositivo a palette così come indicato nella fig. 9. Il sistema quindi può assorbire lavoro esterno nel modo anzidetto e non cederne.


Il calore e il lavoro fornito in questo caso servono a incrementare l'energia interna del gas u, cioè ad aumentare l'energia delle molecole. Per la conservazione dell'energia si ha la relazione fondamentale:
Se viene fornito solamente calore, come di regola avviene
Ma per la stessa definizione di calore specifico si ha dQ=Cv dT con Cv calore specifico del gas a volume costante e dT incremento della temperatura del gas; quindi
Si ha il risultato importante che l'incremento di energia interna di un gas è dato da Cv dT.
Normalmente viene fornito solamente calore; allora per una trasformazione finita
con T1 e T2 temperatura iniziale e finale.
La pressione del gas aumenta con la temperatura; tramite l'equazione di stato si ricava:
- .
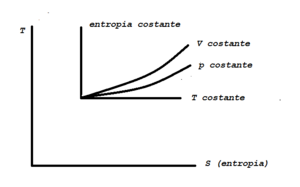
Sul piano p,v, la trasformazione a volume costante è rappresentata da un segmento parallelo all'asse delle pressioni, sul piano temperature assolute T, entropia S, da una certa linea (figg. 10-11) del piano T,S; del piano T,S si dirà in seguito.
L'energia interna è una funzione di stato.
Trasformazione a pressione costante

Detta anche isobarica o isobara.
Definita dalla condizione p = costante, cioè dp=0.
Trascuriamo il caso di lavoro fornito nel modo precedente, facilmente trattabile, ma di scarso valore pratico; la unità di peso del gas è racchiusa per esempio entro un cilindro con pistone sul quale insiste la forza esterna contrastante P=Ω p con Ω area del pistone e p pressione del gas; a mano a mano che il calore viene fornito il gas si riscalda e si espande vincendo la forza P del pistone; viene allora ceduto all'esterno il lavoro dL=P dx, se dx è lo spostamento elementare del pistone; poiché P=Ω p, dL=p Ω dx: ma Ω dx è niente altro che l'incremento del volume specifico dv. per il bilancio dell'energia si ha
cioè il calore fornito serve ad aumentare l'energia interna e a compiere lavoro esterno.
Dall'equazione di stato si ricava p dv=J R dT; poiché Cv dT=du e dato che, per definizione stessa, dQ=Cp dT con Cp calore specifico a pressione costante, si trova
cioè
relazione importantissima che lega i due calori specifici e la costante del gas che quindi viene ad avere, come spesso preannunciato, il significato di un calore specifico. Risulta Cp>Cv come era da attendersi.
Poosto k = Cp÷ Cv ne viene
Il calore fornito vale Q=Cp(T2-T1): il lavoro esterno L=p(v2-v1); poiché p v1=R T1 e p v2=R T2 il lavoro esterno può essere espresso anche dalla
Sul piano p, v la trasformazione è rappresentata da un segmento parallelo all'asse delle v; sul pano T,S da una linea che ha una pendenza meno accentuata di quella a v=costante (figg. 10-11).
Entalpia
Sotto l'ipotesi p costante si ha, come visto, J R dT=p dv. Questa stessa può scriversi J R dT=d(p v) poiché p costante; si ha allora
La quantità fisica Cv dT+d(p v)/J è il differenziale di una grandezza fisica, di stato, chiamata entalpia (enthalpos) o contenuto termico o calore totale. Dalle precedenti risulta:
Nelle trasformazioni a volume costante l'incremento di entalpia è uguale al calore fornito.
L'entalpia è somma dell'energia interna e del lavoro delle pressioni ai confini mobili del sistema. Essa è quindi una funzione di stato al pari dell'energia interna.
Trasformazione isoterma o a energia interna costante
Definita dalla condizione T = costante, dT = 0 ovvero, poiché du = CvdT, du = 0.
Dall'equazione di stato p v=J R T si ricava per l'equazione dell'isoterma (Boyle-Mariotte)
Sul pianop v, questa è una iperbole equilatera, che ha gli assi asintoti; sul piano T,S, la trasformazione è rappresentata da un segmento parallelo alle ascisse.
Poiché la trasformazione è a T costante non vi è variazione dell'energia interna du=Cv dT; tutto il calore fornito serve a compiere il lavoro esterno
Il lavoro prodotto è dato da
- :
conviene calcolarlo in funzione delle variabili p e v
Per realizzare realmente una trasformazione a T costante, necessita mettere il gas a contatto di una sorgente di grande capacità termica (termostato): se la capacità è molto grande la temperatura dell'insieme non viene variata dalla cessione o assorbimento di calore; questa condizione mostra come e quanto sia in realtà difficile, per non dire impossibile, la realizzazione pratica di questa particolare trasformazione che esigerebbe tra l'altro le pareti del recipiente perfettamente permeabili al calore e un tempo molto lungo per poter avere la temperatura uguale in ogni punto.
Trasformazione adiabatica-isoentropica
È definita dalla condizione dQ=0 in ogni punto del sistema; se non vi è scambio di calore con l'esterno, cioè dQ=0 solo ai confini del sistema, la trasformazione è adiabatica; ma la trasformazione che si vuole studiare esige che sia anche dQ=0 per ogni punto del gas; questa condizione più restrittiva definisce la trasformazione cosiddetta isoentropica o a entropia costante, detta anche adiabatica reversibile. Vi è quindi differenza concettuale tra le due trasformazioni che spesso vengono confuse tra loro.
Siccome non vi è apporto alcuno di energia dall'esterno, dQ=0 per ipotesi, deve essere
Ma p dv=dL; si ha quindi
cioè il lavoro ceduto all'esterno per una trasformazione isoentropica è dato dalla diminuzione di energia interna del gas e viceversa
non poteva essere altrimenti.
Nelle trasformazioni con dQ=0 se il gas si espande si raffredda, se viene compresso aumenta di temperature.
Con quale legge variano p, v, T in questa trasformazione? Si ha innanzitutto, come già visto:
cioè una relazione tra T, p, v.
Poiché vige sempre la p v =J R T si ha una seconda relazione tra gli stessi parametri; differenziando e ricordando che
si ottiene
che deve coesistere con la precedente.
Eleminando la temperatura tra queste due equazioni, si ottiene una relazione tra le due rimanenti variabili p e v; posto
si ottiene
- .
Integrando
cioè
quindi tra due stati 1 e 2 passando dai logaritmi ai numeri
equazione dell'adiabatica-isoentropica; dal confronto di essa con l'equazione di stato si ricavano altre forme della stessa equazione:
Queste nuove relazioni permettono di esprimere il lavoro durante la trasformazione adiabatica-isoentropica sotto altra forma:
Sul piano p, v, l'isoentropica-adiabatica è una curva definita dalla (20); sul piano T, S, è un segmento parallelo alle ordinate.
Trasformazione politropiche
Le trasformazioni precedenti sono comode trasformazioni che difficilmente possono riscontrarsi nella realtà: in particolare le adiabatiche e ancor più le isoterme per la loro stessa natura.
Molte trasformazioni che hanno luogo nelle reali macchine possono approssimarsi mediante politropiche, definite dalla
con n esponente della politropica.
È agevole innanzitutto vedere che le trasformazioni già esaminate sono politropiche caratterizzate da un definito esponente di particolare valore.
Infatti per
- n = ∞ si ha v = costante, analoga alla trasformazione a volume costante
- n = 0 si ha p = costante, analoga alla trasformazione a pressione costante
- n = 1 si ha pv = costante, analoga alla trasformazione isotermica
- n = k si ha pvk = costante, analoga alla trasformazione adiabatica-isoentropica.
Attesa l'analogia di struttura tra la formula della politropica e quella dell'adiabatica tutte le formule trovate per questa ultima trattazione sono valide a patto di porre n al posto di k, tranne la L=J Cv(T1-T2) che esprime il lavoro esterno come differenza di energie interne. Infatti per la politropica vi sono scambi di calore; cioè dQ≠0 sia all'interno sia all'esterno.
È facile dimostrare che la politropica è una trasformazione che si svolge a calore specifico costante Cn.
Infatti se dQ=Cn dT è il calore in gioco, per la conservazione dell'energia, deve essere J Cn dT=J Cv dT+p dv; eliminando tra l'equazione di stato p V=J R T e l'equazione della politropica p vn=cost. la variabile p si ottiene la relazione
e, differenziando si trova
moltiplicando ambo i membri per p si ottiene
Eliminando p dv tra quest'ultima e quella dell'energia si trova
per
- n=∞ (trasformazione a volume costante) si ha Cn=Cv
- n=0 (trasformazione a pressione costante) si ha Cn=Cp
- n=1 (trasformazione a temperatura costante) si ha Cn= ∞
- n=k (trasformazione adiabatica-isoentropica) si ha Cn=0.
Si è visto che il lavoro meccanico elementare è p dv; sul piano p,v l'espressione pdv è l'area del rettangolo infinitesimo di altezza p e base dv; il lavoro totale lungo una trasformazione è dato dalla somma di questi rettangolini ed è evidentemente rappresentato dall'area del rettangoloide tra la linea di trasformazione e l'asse delle v.
Trasformazione generica
Nelle considerazioni precedenti sono state esaminate alcune particolari trasformazioni; di regola queste sono sufficienti per la soluzione di quasi tutti i problemi della termodinamica applicata.
Non vi è però difficoltà alcuna, almeno concettuale, per lo studio di una qualsiasi trasformazione definita da una certa relazione che nel caso più generale è funzione delle quattro variabili p, v, T, Q; la relazione può essere data in termini finiti o differenziali. Per i casi particolari studiati avanti, questa relazione era data rispettivamente da v = cost., p = cost., T = cost., J dQ=J Cv dT'+p dv=0, p vn=cost.
Assieme a queste equazioni, che potremo chiamare di condizione, sussistono sempre le altre due
- (conservazione dell'energia)
- (equazione di stato)
- (conservazione dell'energia)
Si hanno in totale quindi tre equazioni tra le quattro variabili p, v, T, Q; l'eliminazione di due variabili porta a una relazione in termini finiti o differenziali tra le rimanenti due permettendo così la risoluzione del problema.
Entropia
Se dQ è il calore scambiato in un modo qualsiasi sappiamo che vige la relazione
dividendo questa espressione per la temperatura T a cui è stato scambiato si ha
la quantità ds=dQ/T è il differenziale dell'entropia s; per una trasformazione reversibile, poiché p dv+v dp=J(Cp-Cv)dT, si ha
- .
Ricavando dall'equazione di stato p v=J R T il rapporto
si ha
- .
Integrando tra gli stati 1 e 2, si trova
- .
Vi è una trasformazione caratterizzata dal fatto di avere l'entropia costante? Cioè dal fatto che s2=s1? La condizione è data ovviamente, ricordando le proprietà dei logaritmi e che R=Cp-Cv, da
e passando ai numeri
poiché
si trova
- .
equazione dell'adiabatica-isoentropica già trovata per altra via.
Appare chiaro ora perché la trasformazione con dQ=0 è stata chiamata isoentropica oltre che adiabatica.
L'entropia è una funzione di stato al pari dell'energia interna e dell'entalpia.
Molto si potrebbe dire sull'entropia.
Ci si limiterà qui a sottolineare che nelle trasformazioni con dQ=0, cioè senza scambi deliberati di calore tra punto e punto, come già detto, l'entropia dovrebbe rimanere costante; questo avverrebbe per gas perfetti con trasformazioni limiti invertibili. In realtà per le azioni di viscosità, vortici, onde di urto, perdite varie, ecc. anche in un sistema isolato termicamente in maniera perfetta (adiabatico) spontaneamente si produrrà del calore all'interno del gas durante le trasformazioni reali; questo calore equivale all'energia meccanica dissipata in maniera irreversibile. Nei sistemi reali isolati le trasformazioni avvengono sempre con aumento di entropia; l'aumento di entropia è quindi una misura della degradazione energetica del sistema.
È evidente che se a un sistema si fornisce o si sottrae calore deliberatamente l'entropia cresce o diminuisce, mentre il gas percorre la relativa trasformazione.
Importa osservare che le dimensioni dell'entropia son quelle di un calore specifico
infatti
- .
Dalla dQ=T ds si vede che il calore scambiato con altri sistemi o generato per degradazione interna è dato dall'area del rettangolo elementare di altezza T e base ds; sul piano T, s è quindi facile il computo del calore in gioco durante una trasformazione.
Calori specifici a pressione costante e volume costante
Si è visto che questi due calori specifici giocano un ruolo importante nei fatti termodinamici: il valore di questi calori specifici varia con la natura della molecola e varia pure con la temperatura.
Si è visto che la molecola è un complesso fisico costituito da atomi uguali o diversi: quando a un gas viene fornito calore, questo rimane nel gas tutto o in parte, a seconda della modalità di trasformazione, come aumento dell'energia cinetica di traslazione e rotazione delle molecole e come aumento dell'energia interna degli atomi costituenti la molecola.
Ne viene che il calore specifico deve essere tanto più alto quanto più complessa è la costituzione della molecola; in una molecola monoatomica sono possibili solo moti di traslazione mentre nelle poliatomiche si verificano pure moti di rotazione attorno al centro di gravità della molecola stessa. Dunque per aumentare la temperatura del gas necessitano più calorie al crescere del numero di atomi costituenti la molecola.
Teoria ed esperienza, infatti, mostrano che realmente è così.
Il rapporto
varia quindi col tipo di molecola; si ha per le molecole monoatomiche k=≅1,66; biatomiche k≅1,4; triatomiche k≅1,33, per la molecola a gran numero di atomi k→1. Tra Cp e Cv sussiste sempre la relazione fondamentale già trovata (14)
La variabilità dei calori specifici con la temperatura viene spiegata dalla teoria dei quanti; il calore specifico cresce con la temperatura ed è funzione non solo del numero di atomi della molecola ma anche della natura degli atomi costituenti. Per salti non eccessivi di temperatura, si possono prendere valori medi; comunque, al variare di T, è sempre rispettata la (14), cioè la differenza tra i calori specici rimane costante.
I calori specifici diminuiscono col diminuire della temperatura qualsiasi lo stato fisico del corpo.
Allo zero assoluto (-273 °C) i calori specifici sono zero.
Alle temperature normali (0 °C ÷ 100 °C) per l'aria si ha
- .
Alle alte temperature possono venire meno alcuni legami intermolecolari (dissociazione); questo comporta la variazione dello stato fisico del gas e quindi variazioni di Cp e Cv. Nelle usuali applicazioni della tecnica della propulsione aerea l'effetto della dissociazione è modesto.



















![{\displaystyle \ (16)\qquad J\ dQ=J\ C_{p}\ dT=J\ C_{v}\ dT+d(pV)=J[C_{v}\ dT+{\frac {d(p\ V)}{J}}]=J\ di.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4253369e5a63616d3472baf69fe1973fdd27633)

















![{\displaystyle \ L=J\ C_{v}(T_{1}-T_{2})=J{\frac {R}{k-1}}(T_{1}-T_{2})={\frac {1}{k-1}}(p_{1}\ v_{1}-p_{2}\ v_{2})={\frac {p_{1}\ V_{1}}{k-1}}[1-({\frac {p_{2}}{p_{1}}})^{\frac {k-1}{k}}]={\frac {p_{1}\ v_{1}}{k-1}}[1-({\frac {v_{1}}{v_{2}}})^{k-1}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57136f38d68282f44dc1c810d2ab13fd6a2455b8)



















