Chimica organica/Alcani (Proprietà): differenze tra le versioni
mNessun oggetto della modifica |
|||
| Riga 1: | Riga 1: | ||
{{stub}} |
|||
===Come verificare la stabilità relativa di due molecole=== |
===Come verificare la stabilità relativa di due molecole=== |
||
Una delle strade piu' percorse per verificare la stabilita' relativa di due molecole organiche consiste nel trasformarle, attraverso reazioni chimiche, nella stessa sostanza, piu' stabile di entrambe, quantificando l'energia liberata nel pasaggio. '''La specie che per trasformarsi ha liberato meno energia e' la piu' stabile'''.<br /> |
Una delle strade piu' percorse per verificare la stabilita' relativa di due molecole organiche consiste nel trasformarle, attraverso reazioni chimiche, nella stessa sostanza, piu' stabile di entrambe, quantificando l'energia liberata nel pasaggio. '''La specie che per trasformarsi ha liberato meno energia e' la piu' stabile'''.<br /> |
||
| Riga 8: | Riga 6: | ||
===Alcani: Stabilità relativa degli isomeri=== |
===Alcani: Stabilità relativa degli isomeri=== |
||
{|{{Tabella_Ch_Org}} |
|||
{| |
|||
|{{Col1_Ch_Org}} | '''Stabilità relativa di due isomeri del pentano''' |
|||
| |
|- |
||
| [[image:Pentane_isomers_stability.jpg|300px|center|Stabilita' relativa di due isomeri del pentano]] |
|||
|} |
|} |
||
| Riga 16: | Riga 15: | ||
Poichè i cicloalcani sono caratterizzati da un numero diverso di atomi di carbonio, un confronto sulla loro stabilità relativa può essere basato sul calore di combustione sviluppato solo dividendo tale quantità per il numeri di carboni. Il calore sviluppato per carbonio decresce da ciclopropano a cicloesano, risale dal cicloesano fino al cicloalcano a 15 carboni (pentadecano), poi si stabilizza. I carboni che compongono un alcano sono ibridati sp<sub>3</sub>, così che i gruppi ad essi legati tendono a formare angoli di 109.5 gradi tra loro. La configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l'eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita '''tensione d'anello'''. |
Poichè i cicloalcani sono caratterizzati da un numero diverso di atomi di carbonio, un confronto sulla loro stabilità relativa può essere basato sul calore di combustione sviluppato solo dividendo tale quantità per il numeri di carboni. Il calore sviluppato per carbonio decresce da ciclopropano a cicloesano, risale dal cicloesano fino al cicloalcano a 15 carboni (pentadecano), poi si stabilizza. I carboni che compongono un alcano sono ibridati sp<sub>3</sub>, così che i gruppi ad essi legati tendono a formare angoli di 109.5 gradi tra loro. La configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l'eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita '''tensione d'anello'''. |
||
'''Caso cicloesano'''</br> |
<span style="font-size:120%">'''Caso cicloesano'''</span></br> |
||
Il |
Il cicloesano, se in conformazione planare, non fa eccezione. Esistono tuttavia due conformazioni perfettamente compatibili con l'ibridazione sp<sub>3</sub> dei carboni: quelle a '''sedia'''. Si parla di conformazioni poichè per passare dall'una all'altra sono necessarie solo rotazioni di legami σ. La figura, coerentemente, le mostra in equilibrio tra loro<br /> |
||
Proiettare il cicloesano secondo Newman evidenzia il fatto che i protoni siano perfettamente sfalsati. <br /> |
Proiettare il cicloesano secondo Newman evidenzia il fatto che i protoni siano perfettamente sfalsati. <br /> |
||
Nelle conformazioni a sedia è possibile identificare il piano identificato dai carboni, idrogeni protesi al di sotto ed altri al di sopra di tale piano. Quelli diretti al di sopra del piano sono alternativamente rivolti perpendicolarmente rispetto al piano stesso ('''assiali''') e quasi parallelamente ('''equatoriali'''). La stessa cosa vale per quelli diretti al di sotto del piano.<br /> La rappresentazione di Newman mostra come un gruppo in direzione equatoriale si trovi al di sopra del piano costituito dai carboni quando il gruppo in assiale legato al medesimo carbonio sia diretto in basso. |
Nelle conformazioni a sedia è possibile identificare il piano identificato dai carboni, idrogeni protesi al di sotto ed altri al di sopra di tale piano. Quelli diretti al di sopra del piano sono alternativamente rivolti perpendicolarmente rispetto al piano stesso ('''assiali''') e quasi parallelamente ('''equatoriali'''). La stessa cosa vale per quelli diretti al di sotto del piano.<br /> La rappresentazione di Newman mostra come un gruppo in direzione equatoriale si trovi al di sopra del piano costituito dai carboni quando il gruppo in assiale legato al medesimo carbonio sia diretto in basso. |
||
{| {{Tabella_Ch_Org}} |
{| {{Tabella_Ch_Org}} |
||
| |
|{{Col2_Ch_Org}}| '''Conformazioni a sedia del cicloesano''' |
||
| |
|{{Col1_Ch_Org}} | '''Cicloesano visto con proiezione di Newman''' |
||
|- |
|||
|[[image:Cyclohexane_conformation.png|200px|Conformazioni a sedia del cicloesano]] |
|||
|[[image:Cyclohexane Newman.jpg|200px|Cicloesano visto con proiezione di Newman]] |
|||
|} |
|} |
||
| Riga 34: | Riga 36: | ||
* Disegna i legami con gli idrogeni: se la punta del ciclo è in basso, l'idrogeno assiale è diretto in basso e quello equatoriale in alto. |
* Disegna i legami con gli idrogeni: se la punta del ciclo è in basso, l'idrogeno assiale è diretto in basso e quello equatoriale in alto. |
||
| ⚫ | |||
|[[image:Cicloesano_howtodraw.jpg|thumb|200px|Cicloesano visto con proiezione di Newman]] |
|[[image:Cicloesano_howtodraw.jpg|thumb|200px|Cicloesano visto con proiezione di Newman]] |
||
|} |
|} |
||
==Approfondimenti== |
|||
; Software gratuiti |
|||
: [http://www.arguslab.com/ Arguslab] permette, tra le molte funzioni di cui dispone, di calcolare le energie che caratterizzano le molecole organiche e di disegnare gli orbitali molecolari |
|||
| ⚫ | |||
Versione delle 16:54, 29 nov 2007
Come verificare la stabilità relativa di due molecole
Una delle strade piu' percorse per verificare la stabilita' relativa di due molecole organiche consiste nel trasformarle, attraverso reazioni chimiche, nella stessa sostanza, piu' stabile di entrambe, quantificando l'energia liberata nel pasaggio. La specie che per trasformarsi ha liberato meno energia e' la piu' stabile.
Gli alcani (CnH2n+2) in presenza di un eccesso di ossigeno ed elevate temperature reagiscono con l'O2 per formare nCO2 e (n+1)H2O con reazione esotermica (combustione), cioè con produzione di calore. Questa razione risponde pienamente allo scopo.
Naturalmente maggiore è la lunghezza della catena dell'alcano, maggiore è il calore che viene prodotto. La stabilità di due alcani a peso molecolare diverso può essere confrontata dividendo il calore totale sprigionato per il numero dei carboni che compongono la catena. É da notare come contemporaneamente al calore sviluppato aumenti anche la temperatura di attivazione della reazione, quindi gli alcani a peso molecolare sopra il C30 sono cattivi combustibili come il bitume.
Alcani: Stabilità relativa degli isomeri
| Stabilità relativa di due isomeri del pentano |
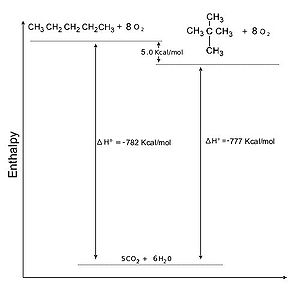 |
La tensione d'anello nei cicloalcani
Poichè i cicloalcani sono caratterizzati da un numero diverso di atomi di carbonio, un confronto sulla loro stabilità relativa può essere basato sul calore di combustione sviluppato solo dividendo tale quantità per il numeri di carboni. Il calore sviluppato per carbonio decresce da ciclopropano a cicloesano, risale dal cicloesano fino al cicloalcano a 15 carboni (pentadecano), poi si stabilizza. I carboni che compongono un alcano sono ibridati sp3, così che i gruppi ad essi legati tendono a formare angoli di 109.5 gradi tra loro. La configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l'eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita tensione d'anello.
Caso cicloesano
Il cicloesano, se in conformazione planare, non fa eccezione. Esistono tuttavia due conformazioni perfettamente compatibili con l'ibridazione sp3 dei carboni: quelle a sedia. Si parla di conformazioni poichè per passare dall'una all'altra sono necessarie solo rotazioni di legami σ. La figura, coerentemente, le mostra in equilibrio tra loro
Proiettare il cicloesano secondo Newman evidenzia il fatto che i protoni siano perfettamente sfalsati.
Nelle conformazioni a sedia è possibile identificare il piano identificato dai carboni, idrogeni protesi al di sotto ed altri al di sopra di tale piano. Quelli diretti al di sopra del piano sono alternativamente rivolti perpendicolarmente rispetto al piano stesso (assiali) e quasi parallelamente (equatoriali). La stessa cosa vale per quelli diretti al di sotto del piano.
La rappresentazione di Newman mostra come un gruppo in direzione equatoriale si trovi al di sopra del piano costituito dai carboni quando il gruppo in assiale legato al medesimo carbonio sia diretto in basso.
| Conformazioni a sedia del cicloesano | Cicloesano visto con proiezione di Newman |

|

|
Disegnare il cicloesano in una delle due conformazioni a sedia
Approfondimenti
- Software gratuiti
- Arguslab permette, tra le molte funzioni di cui dispone, di calcolare le energie che caratterizzano le molecole organiche e di disegnare gli orbitali molecolari

