Laboratorio di chimica in casa/Cloruro rameico
Cloruro rameico

Massa molecolare: 134,45 g/mol
Solubilità in acqua: 757 g/l (25 °C)
Altri solventi: metanolo 680 g/l (15 °C), etanolo 530 g/l (15 °C), acetone.
Temperatura di fusione: 498 °C
Temperatura e prodotti di decomposizione: 993 °C - CuCl + Cl2
Massa molecolare: 166,45 g/mol
Temperatura di deidratazione: 100 °C
Massa molecolare: 198,45 g/mol
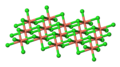
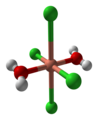
Il cloruro rameico è un sale acido di formula CuCl2. Solido esiste in tre stati di idratazione: tetraidrato, diidrato e anidro. Il primo è di colore verde scuro, il secondo è azzurro ed il terzo è marrone. Anche in soluzione esso può assumere colori diversi, a seconda della temperatura e della presenza di altri ioni.
Può essere utilizzato per ramare il ferro o come precursore di altri composti del rame. Le sue soluzioni esposte all'aria sono in grado di corrodere abbastanza velocemente il rame metallico trasformandolo in Cu(OH)2.
Essendo il sale di un metallo pesante è pericoloso per l'ambiente, oltre ad essere corrosivo e irritante per i tessuti deboli (occhi, pelle danneggiata, bocca).
Colore
[modifica | modifica sorgente]

Le soluzioni di CuCl2 hanno colori diversi, comprendenti varie sfumature di azzurro, verde o giallo, a seconda della temperatura, della concentrazione e della presenza di altri cloruri. Variando uno di questi parametri varia il colore della soluzione perché in essa cambia la concentrazione delle specie ioniche presenti.
Nell'immagine a destra sono mostrati tre calici contenenti soluzioni di CuCl2 alla stessa concentrazione; la prima a 20 °C contiene solo CuCl2 ed è di colore azzurro chiaro, dato dal complesso che il Cu2+ forma con le molecole d'acqua.
CuCl2 + n H2O [Cu(H2O)6]2+(aq) + 2 Cl-(aq)
Aggiungendo degli ioni Cl- in eccesso si tende a spostare la reazione verso la formazione di un altro ione complesso, in cui le molecole d'acqua sono sostituite da quattro ioni cloruro, formando l'anione detto tetraclorocuprato:[1]
CuCl2 + 2 NaCl → CuCl42-(aq) + 2 Na+(aq)
Variando la temperatura l'equilibrio chimico nelle soluzioni di CuCl2 puro fa passare parte degli ioni Cl- appartenenti ad una mole di CuCl2 dissociata su uno ione Cu2+, facendo trovare in soluzione entrambi i complessi visti prima (autocomplessazione).
CuCl2 + n H2O [Cu(H2O)6]2+(aq) + 2 Cl-(aq) ½ CuCl42-(aq) + ½ [Cu(H2O)6]2+(aq)
In quest'ultimo caso la soluzione apparirà di colore verde-azzurrognolo, che tenderà sempre di più al verde scuro man mano che la temperatura aumenta.
Sintesi principale
[modifica | modifica sorgente]Il modo migliore per ottenere cloruro rameico è sciogliere del rame metallico in una miscela di acido cloridrico ed acqua ossigenata.
Il rame, essendo un metallo nobile (elettronegatività 1,9), non viene corroso dall'acido cloridrico al 10% venduto nei supermercati (se non dopo anni); così si sfrutta il potere ossidante del perossido di idrogeno che trasforma il rame in ossido rameico, il quale può venire facilmente sciolto dall'acido cloridrico, producendo CuCl2.
(1) Cu + H2O2 → CuO + H2O
(2) CuO + 2 HCl → CuCl2 + H2O
Le dosi esatte di reagenti da adoperare sono 11 ml di HCl 10% P/P e 33,7 ml di H2O2 12 vol ogni grammo di Cu (per concentrazioni diverse si veda il cassetto in fondo a questa sezione). Si consiglia tuttavia di usare H2O2 in leggero eccesso, poiché gli ioni Cu2+ catalizzano la decomposizione dell'H2O2, che si trasformerebbe in ossigeno prima di intaccare il rame. Eventuale reagente residuo (sia H2O2 che HCl) può essere facilmente rimosso facendo evaporare per bollitura la soluzione. La resa della reazione con reagenti in quantità stechiometriche (quelle riportate prima) è di circa il 95%.
Non si consiglia di usare reagente in difetto poiché, una volta esaurito l'acido, si può formare Cu(OH)2 come sottoprodotto (il rame metallico residuo più ossidarsi con l'ossigeno dell'aria) che andrebbe rimosso per aggiunta di altro HCl o per filtrazione.[2]
Cu + ½ O2 + H2O Cu(OH)2 (s)
La reazione 1 è fortemente esotermica. Utilizzando reagenti a bassa concentrazione (come nell'esempio) questo non crea problemi, ma se se questi sono concentrati l'aumentare della temperatura può far evaporare parte dell'acido cloridrico in soluzione, producendo dei fumi tossici. Si consiglia quindi di utilizzare reagenti diluiti, tenendo eventualmente il contenitore all'aperto in un bagno d'acqua (la reazione comunque non è esplosiva o fulminea, quindi può essere facilmente rallentata nel caso la soluzione iniziasse a surriscaldarsi).
Come fonte di rame si possono usare fili di rame presenti nei cavi o nei motorini elettrici, che andranno spogliati del sottile strato di vernice protettiva di cui sono coperti; oppure si possono usare monete da 1, 2 o 5 centesimi di euro, facendo attenzione che lo strato di rame che le ricopre non si esaurisca del tutto, per non far arrivare l'acido al ferro, che lo corroderebbe al posto del rame.
| m.m. | conc. | ρ | |
| HCl | 36,46 g/mol | 10% m/m | 1048 g/l |
| H2O2 | 34,0147 g/mol | 12 vol | |
| Cu | 65,546 g/mol |
Qui vengono mostrati i calcoli eseguiti per ricavare le quantità di reagenti da combinare stechiometricamente elencate prima, basandosi sui dati elencati nella tabella a fianco ed ai coefficienti stechiometrici della reazione di seguito riportata.
Per prima cosa ricaviamo i millilitri di HCl da aggiungere ogni grammo di rame metallico.
La percentuale elencata sulla confezione (nel caso esempio) è 10% P/P, ossia 100 g ogni Kg di soluzione. Avendo la concentrazione in P/P non è possibile ricavare alcun volume, ed andrà quindi trasformata in P/V (g di soluto/100 ml di soluzione) per poter passare ai millilitri di soluzione.Dire che la densità della soluzione è 1,048 g/ml significa che 1 litro di soluzione pesa 1048 grammi. Così sappiamo che in questo litro di soluzione che pesa 1048 g c'è un 10% in peso di acido cloridrico, che corrisponde a:
Sapendo ora che in un litro di soluzione stanno 104,8 g è possibile ricavare la molarità della soluzione, in modo che i millilitri da prelevare siano in relazione coi coefficienti di reazione.
Ricaviamo la molarità:
Relazioniamola con i coefficienti stechiometrici (2 mol HCl ogni mol di Cu):
Da ciò abbiamo ricavato che ad ogni mole di Cu vanno aggiunti 696 ml di acido cloridrico al 10%. Nel testo tuttavia queste proporzioni sono riferite ad 1 grammo di rame. Per ricavare quei valori basta sapere che 1 mol = 63,55 g di Cu, quindi se per sciogliere quella quantità di rame occorrono 696 ml di HCl, per sciogliere 1 grammo ci vorranno:
Per ogni grammo di rame andranno usati 11 ml di HCl 10%.
Conoscendo la concentrazione P/P dell'acqua ossigenata potremmo fare lo stesso, ma se si usa quella "domestica" è più probabile che la sua concentrazione sia indicata in vol. La cosa però non è di intralcio, anzi, ci permette di trovare la molarità della soluzione con un passaggio molto più semplice: moltiplicare la concentrazione in vol per la costante di conversione dell'acqua ossigenata.
Adesso possiamo rapportare la molarità al coefficiente stechiometrico dell'H2O2 per ottenere i litri di soluzione da prelevare.
Adesso che conosciamo il rapporto "litri di acqua ossigenata su moli di Cu" possiamo convertirlo nel più pratico "millilitri di acqua ossigenata su grammi di Cu" come abbiamo fatto per l'HCl.
Sintesi alternative
[modifica | modifica sorgente]Il cloruro rameico può essere sintetizzato per reazione di scambio fra cloruro di piombo e solfato rameico a caldo[3] in quantità stechiometriche:
CuSO4 (aq) + PbCl2 (aq) → CuCl2 (aq) + PbSO4↓
Oppure facendo reagire ossido, idrossido o carbonato rameico con acido cloridrico.
CuO + 2 HCl → CuCl2 + H2O
Cu(OH)2 + 2 HCl → CuCl2 + 2 H2O
In questo caso si può usare HCl in eccesso.
CuCl2 si può produrre per ossidazione del cloruro rameoso in soluzione di HCl. Questo può avvenire tramite H2O2 o spontaneamente con l'ossigeno dell'aria:
4 H[CuCl2] + O2 → 4 CuCl2 + 2 H2O
2 H[CuCl2] + H2O2 → 2 CuCl2 + 2 H2O
Reazioni (inorganica)
[modifica | modifica sorgente]Ossidoriduzioni
[modifica | modifica sorgente]Con vari metalli
[modifica | modifica sorgente]Con l'alluminio CuCl2 è molto aggressivo, e la reazione genera molto calore.
3 CuCl2 + 2 Al → 3 Cu + 2 AlCl3
Il risultato è rame metallico (che precipita parzialmente ossidato dall'ossigeno presente in soluzione) e cloruro di alluminio.
Con lo zinco la reazione è simile:
CuCl2 + Zn → Cu + ZnCl2
Con il ferro, il cloruro rameico è più "gentile"; si limita a ricoprire il pezzo di metallo sotto forma di patina di rame solido in genere piuttosto sottile.
CuCl2 + Fe → Cu + FeCl2
Questo, a fine reazione, va lasciato asciugare, poi lavato ed infine lucidato con carta vetrata a grana fine se lo si vuol far diventare di un lucente color rame.
Reagisce anche con piombo e stagno senza sprigionare molta energia:
CuCl2 + Sn → Cu + SnCl2
CuCl2 + Pb → Cu + PbCl2
Con il rame
[modifica | modifica sorgente]Le soluzioni di CuCl2 hanno la particolare caratteristica di ossidare il rame metallico a Cu2+ tramite una serie di reazioni:
- Cu + CuCl2 → 2 CuCl
- 2 CuCl + O2 → CuO + CuCl2
- CuO + 2 HCl → CuCl2 + H2O
In ambiente non acido la seconda fase termina con l'idratazione di CuO, catalizzata dallo ione rameico a temperatura ambiente.
CuO + H2O Cu(OH)2
In assenza di aria la reazione si arresta alla prima fase, ma va catalizzata dalla presenza di ioni Cl- che permettono a CuCl di entrare in soluzione invece che passivare il rame metallico (depositandosi su di esso):
Cu + CuCl2 + 2 Cl- → 2 [CuCl2]-
Combustione
[modifica | modifica sorgente]La combustione del cloruro rameico produce ossido rameico e cloro:
2 CuCl2 + O2 2 CuO + 2 Cl2
Questa avviene a temperature molto elevate ed in buona ventilazione, altrimenti si otterrà CuCl come sottoprodotto.
Doppio scambio
[modifica | modifica sorgente]- Acidi
CuCl2 reagisce con l'acido solforico secondo la seguente reazione:
CuCl2 + H2SO4 → CuSO4 + 2 HCl
- Basi
Il sale viene neutralizzato dall'idrossido di sodio, dando un precipitato blu scuro o azzurro di idrossido rameico.[4]
CuCl2 + 2 NaOH → Cu(OH)2↓ + 2 NaCl
Reagisce anche con l'ammoniaca, dando cloruro di ammonio (acido anch'esso) e idrossido rameico, che precipita, o una soluzione blu se l'ammoniaca viene versata in eccesso.[5]
CuCl2 + 2 NH4OH → Cu(OH)2↓ + 2 NH4Cl
CuCl2 + 6 NH4OH → [Cu(NH3)4(H2O)2](OH)2 + 2 NH4Cl
- Sali
Reagisce anche con vari sali.
CuCl2 + 2 NaHCO3 → Cu(OH)2↓ + 2 NaCl + 2 CO2↑
2 CuCl2 + 2 Na2CO3 + H2O → Cu(OH)2↓ + CuCO3↓ + 4 NaCl + CO2↑ [6]
Come visto prima, l'aggiunta di cloruri in soluzione porta alla formazione di tetraclorocuprato.
CuCl2 + 2 NaCl [CuCl4]2-(aq) + 2 Na+(aq)
Fa infine precipitare i cloruri di piombo, argento e mercurio.
Pb(CH3CO2)2 + CuCl2 → PbCl2↓ + Cu(CH3CO2)2
Reazioni (organica)
[modifica | modifica sorgente]Il cloruro rameico è in grado di clorurare aldeidi e chetoni in posizione alfa.

Cristallizzazione e deidratazione
[modifica | modifica sorgente] Il cloruro rameico è un sale deliquescente che in aria secca cristallizza in forma tetraidrata come piccoli cristalli aghiformi stellati o a riccio di mare. |
 Bollendo una sua soluzione a circa 100 °C e lasciando evaporare anche l'acqua di cristallizzazione si ottiene il sale anidro, un composto duro color mattone. |
 Per ottenere cloruro rameico diidrato basterà lasciare il sale anidro a contatto con l'umidità dell'aria. Il risultato è un solido azzurro chiaro. |
Sicurezza
[modifica | modifica sorgente]| Simboli di rischio |
|---|
| NFPA 704 |
| Frasi H 302 - 315 - 319 - 410 |
| Consigli P 260 - 273 - 302+352 - 305+351+338 |
GHS 
|
| CAS 7447-39-4 (anidro) 10125-13-0 (diidrato) |
Si veda anche Copper toxicity su en.Wikipedia.
Il cloruro rameico è una sostanza di media pericolosità. Essa non causa danni cronici se non per ingestione o per contatto con gli occhi e la pelle lesa. Essa presenta la bassa tossicità tipica dei composti del rame (può causare reazioni allergiche e danni da bioaccumulo). Non presenta particolari rischi se maneggiata con attenzione.
| Tabella di pericolosità | |||
|---|---|---|---|
| Via di esposizione | Effetti | Dosi limite | Protezioni |
| Pelle | La sostanza solida è igroscopica e corrosiva e può causare irritazione alla pelle se essa non viene sciacquata in breve tempo. Risulta molto irritante sulla pelle già danneggiata e in persone allergiche può causare dermatiti. |  Guanti di lattice Guanti di lattice
| |
| Occhi | Il sale è estremamente irritante per gli occhi, persino in soluzioni diluite. | soluzione 1% |  Occhiali Occhiali
|
| Naso | Il composto non è volatile e le polveri tendono ad impaccarsi perché igroscopiche, tuttavia risulta estremamente irritante per il tratto respiratorio e l'inalazione delle polveri o degli aerosol può provocare danni. | 1 ppm |  Mascherina ordinaria Mascherina ordinaria
|
| Bocca | Il composto risulta essere molto tossico per ingestione, sia perché provoca irritazione (o persino ustioni) agli organi interni sia perché un eccesso di rame nell'organismo porta all'avvelenamento. | LD50 584 mg/Kg (ratto) |

Non ingerire |
| Ambiente | In quanto sale di un metallo pesante, CuCl2 è pericoloso per l'ambiente. |  273 | |
| Altro | Il sale deidrata a 100 °C ed è stabile fino a circa 300°, temperatura in cui decompone in cloro, cloruro rameoso ed ossido rameico | Non surriscaldare | |
| Corrosione | Il composto è corrosivo per i metalli, compreso il rame, e per il PET quando concentrato. | ||
| MSDS | GESTIS | ||
Video
[modifica | modifica sorgente]Sintesi del cloruro rameico utilizando reagenti concentrati. L'effervescenza che si nota è data dall'acqua che evapora in prossimità della zona di reazione, in cui l'acqua è più calda che nel resto della soluzione.
Video sulla sintesi e la disidratazione del cloruro rameico. Dopo essere stato sintetizzato, il composto viene bollito a 100 °C e lasciato reidratare per una settimana. Il risultato è CuCl2·2H2O.
Un video su come il cloruro rameico corrode la carta di alluminio.
Maggiori informazioni
[modifica | modifica sorgente]- Discussione su Myttex Forum
- Idratazione ed altre informazioni su Amazing Rust
 Wikimedia Commons contiene immagini o altri file su cloruro rameico
Wikimedia Commons contiene immagini o altri file su cloruro rameico
Note
[modifica | modifica sorgente]- ↑ Il Cu2+ può formare anche altri ioni complessi con gli alogenuri, sia inorganici che organici, aventi diversi colori. Lo stesso ione tetraclorocuprato, in alcuni composti in cui la parte positiva è una molecola organica, vira da verde a giallo a seconda della temperatura, cambiando struttura da planare quadrata a tetraedrica.
- ↑ Si veda la sezione Reazioni per il meccanismo.
- ↑ PbCl2 è poco solubile in acqua a freddo (10,8 g/L @ 20 °C) mentre a 100 °C la solubilità cresce a 32 g/L.
- ↑ Il precipitato blu scuro è prodotto in eccesso di NaOH, che genera il complesso [Cu(OH)4]2- poco solubile di colore blu.
- ↑ Si veda la voce Reattivo di Schweizer su Wikipedia.
- ↑ I sali di rame, reagendo in soluzione acquosa coi carbonati, danno un precipitato composto da Cu(OH)2·CuCO3 in rapporto stechiometrico 1:1.



















![{\displaystyle {\xrightarrow[{T\ amb.}]{Cu^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c708cd7d0b0330c1e1f3644b3580bd6ab3186c3b)