Utente:Riccardo Rovinetti/Sandbox 01
La chimica organica è quella branca della chimica che si occupa dello studio dei composti del carbonio.
La chimica di questo elemento è tanto importante da meritare una categoria a sé stante (con relative sottobranche) perché le molecole contenenti questo elemento hanno proprietà molto diverse da quelle della maggior parte dei composti inorganici in fatto di stabilità e versatilità; senza contare che il corpo umano è composto per la quasi totalità da molecole organiche, rendendo questa parte della chimica la base per altre scienze quali la biologia, l'erboristeria, la chimica farmaceutica, la biologia e la neurologia.
Generalità
[modifica | modifica sorgente]Per approfondire si veda Carbonio nel capitolo Elementi
Sicuramente la proprietà che distingue i composti organici da tutti gli altri composti esistenti è la capacità di creare molecole contenenti un qualsiasi numero di legami C-C ai quali se ne aggiungono altri ad un'incredibile varietà di specie chimiche (atomi singoli o molecole) spesso diversissimi, che tuttavia non intaccano particolarmente la stabilità della molecola.
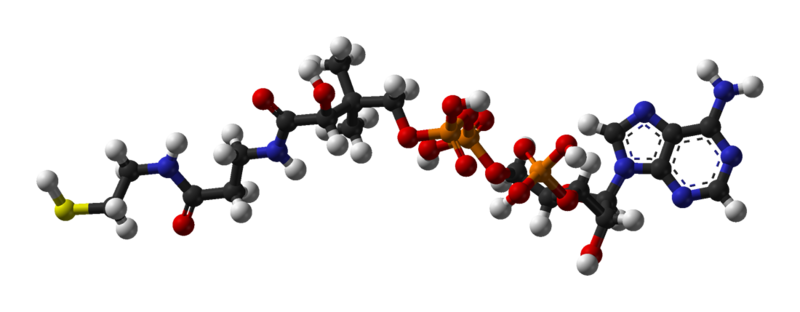
Questa loro capacità di supportare nella propria struttura diverse specie chimiche (dette gruppi funzionali) conferisce alle molecole organiche un incredibile numero di proprietà diverse ed un'inenumerabile quantità di combinazioni diverse.
Le formule chimiche dei composti organici
[modifica | modifica sorgente]Le formule chimiche che descrivono le molecole organiche, essendo queste ultime spesso molto complesse, vengono scritte in molti modi diversi al contrario dei composti inorganici cui bastano le comuni formule brute. Qui viene subito riportato un esempio:
| Esano |
|---|
| Formula molecolare C6H14 |
Struttura scheletrica  |
Struttura con carboni e idrogeni 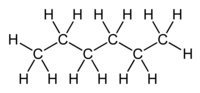 |
Modello a sfere e bastoncini  |
Modello 3D  |
| Si veda anche la voce formula di struttura su Wikipedia. |
La tabella a sinistra mostra vari esempi di formula di struttura della molecola di esano. Sotto al nome del composto è riportata la sua formula bruta, C6H14, da cui deduciamo che il composto è formato da 6 atomi di carbonio e 14 di idrogeno per molecola. Ma come sono disposti questi ultimi?
Le formule di struttura ce ne danno un'idea: la prima riportata si chiama formula semplificata ed è molto utile quando le molecole da rappresentare diventano molto ingombranti (l'acido tannico per esempio). Nel disegno sono omessi gli atomi di idrogeno ed i carboni sono rappresentati dai sei spigoli (4 interni più il capo e la coda della molecola). Sapendo che la valenza del carbonio è 4 e che sono omessi SOLO gli idrogeni ci vorrà poco ad abituarsi a ricostruire le formule delle molecole dalla loro versione semplificata.
Sotto questa è riportata la vera formula di struttura che svelata la posizione degli atomi di idrogeno e carbonio. Questa tuttavia viene poco usata. Sotto ancora è riportato il modello a sfere e bastoncini, che dà un'idea dell'aspetto tridimensionale della molecola. Gli atomi sono disposti in accordo con la teoria VSEPR sulla geometria molecolare e con le misurazioni fatte tramite diffrazione di raggi X, e la distanza tra una pallina e l'altra corrisponde alla distanza fra i nuclei atomici.[1]
L'ultimo modello è quello 3D o space-filling' che tiene conto, oltre che delle distanze, anche dei volumi atomici dando un'idea ancora più precisa del volume della molecola.
Gli idrocarburi
[modifica | modifica sorgente]
Gli idruri di carbonio sono chiamati idrocarburi e per definizione sono quelle molecole composte da carbonio e idrogeno. Queste, a differenza della maggior parte degli altri composti chimici possono formare catene di atomi virtualmente infinite, contenenti legami singoli, doppi e tripli fra carbonio e carbonio e singoli di tipo sigma tra carbonio e idrogeno.
In tutte le molecole il legame C-H è molto debolmente polare (d.e. 0,3) per cui gli idrocarburi sono generalmente considerati composti apolari, anche se vi è un leggerissimo dipolo positivo nella zona degli atomi di idrogeno. Questa caratteristica li rende insolubili in acqua, isolanti ed aventi bassa densità.
Questi composti sono tutti combustibili (alcuni, essendo in forma gassosa, anche esplosivi se incendiati) ma generalmente presentano elevata inerzia chimica.
A seconda dei tipi di legame presenti nella molecola vengono classificati in diverse categorie di composti.
Alcani
[modifica | modifica sorgente]


Sono idrocarburi formati da singoli legami singoli C-C di formula generale CnHn+2. Strutturalmente sono molecole in cui i gli atomi di carbonio sono tutti ibridizzati sp3, cioè sono al centro di un tetraedro ai cui estremi stanno due atomi di idrogeno (tre agli estremi della molecola) e altri due di carbonio il cui angolo di legame è di 109°30'. Il più semplice di questi composti è il metano (CH4) seguito dall'etano (C2H6), butano (C3H8), propano (C4H10), pentano (C5H12), esano (C6H14) e così via.
Questi composti sono gas incolori e inodori a TPS fino al butano (t.e. ~0 °C) e liquidi trasparenti inodori fino all'eptadecano (t.f. ~21 °C). I rimanenti sono solidi bianchi o cristallini dal basso punto di fusione, più leggeri dell'acqua e comburenti.
Generalmente la loro utilità è come solventi, come precursori dei derivati del petrolio, come plastiche (es: polietilene) e come precursori per una serie di composti chiamati alogenuri alchilici spiegati in seguito.
La loro inerzia durante le più comuni reazioni chimiche contrapposta alla loro tendenza a bruciare in presenza di agenti ossidanti li rende difficili da manipolare e partecipano solo ad una piccola varietà di reazioni chimiche:
Bruciano istantaneamente a contatto con il fluoro gassoso e bruciano se incendiati in aria, in atmosfera di ossigeno o di cloro secondo le seguenti reazioni fortemente esotermiche:
CnHn+2 + 2n O2 → n CO2 + n H2O
CnHn+2 + 2n F2 → n CF4 + 2n HF
CnHn+2 + 2n Cl2 → n CCl4 + 2n HCl
Con l'ausilio di opportuni catalizzatori queste reazioni vengono controllate e sfruttate industrialmente, tuttavia la reazione più comune, praticata sia nei comuni laboratori chimici che su scala industriale, è l'alogenazione radicalica, mostrata qui di seguito:


La prima fase di questa sequenza di reazioni è la rottura del legame fra i due atomi di cloro nella molecola Cl2 tramite radiazione ultravioletta, che genera due radicali Cl•, ossia due atomi di cloro separati aventi un elettrone spaiato.
Uno di questi due radicali viene attirato dalla piccola carica positiva presente su uno degli atomi di idrogeno del metano, il quale si stacca dalla molecola e ne esce sotto forma di molecola di HCl. Il metano, ora diventato un radicale metile, ha un elettrone spaiato a cui va a legarsi un atomo di cloro a seguito di un urto efficace con una molecola di Cl2, producendo cloruro di metile ed un altro radicale Cl che andrà a ripetere il ciclo. Man mano che gli idrogeni legati al metano incontrano un radicale Cl• si staccano e vengono rimpiazzati con un secondo atomo di cloro, andando a formare pian piano CH3Cl, CH2Cl2, CHCl3 e CCl4. Le stesse semireazioni avvengono con il resto degli alcani.
Alcheni
[modifica | modifica sorgente]
Sono spesso chiamati olefine e sono quegli idrocarburi aventi formula generale CnH2n contenenti solo un doppio legame C=C.
Il più semplice alchene è l'etilene o etene (C2H4), seguito dal propene, dal butene ecc.
Questi si presentano sotto forma di gas incolori con odori caratteristici fino al butene (t.e -6,5 °C), liquidi incolori profumati fino all'ottadecene (t.f. 14-18 °C) e poi solidi bianchi o cristallini.
In queste molecole due carboni sono ibridizzati sp2, ed il loro angolo di legame è di 180°, mentre l'angolo H-C-H o H-C-C è 120°. Questo tipo di legame conferisce alla molecola particolari proprietà chimiche che gli alcani non hanno. Tra i due atomi di carbonio è presente un'elevata densità di carica elettrica negativa che attira varie specie chimiche quali cationi e radicali liberi:

La reazione sopra schematizzata mostra una reazione di addizione elettrofila tra l'etilene e l'acido cloridrico in cui uno ione positivo attira a sé l'elettrone del legame debole π fra i due atomi di carbonio, andando a creare una specie chimica chiamata carbocatione, cioè una molecola organica avente carica positiva. Questa ha vita breve perché va subito a legarsi con l'anione Cl- associato allo ione positivo che si era precedentemente legato all'alchene.
Questo tipo di reazione viene usata in processi quali la nitrazione, la solfonazione e l'alogenazione.
Gli alcheni presentanti più di un doppio legame nella molecola sono detti dieni, trieni, in generale polieni.
Alchini
[modifica | modifica sorgente]Idrocarburi ramificati e ciclici
[modifica | modifica sorgente]Idrocarburi aromatici
[modifica | modifica sorgente]I gruppi funzionali
[modifica | modifica sorgente]Note
[modifica | modifica sorgente]- ↑ Si noti per esempio come nella struttura a sfere e bastoncini dell'acido diatrizoico, riportata nel paragrafo sopra, lo iodio sia più distante dal carbonio rispetto a quanto on lo siano gli altri atomi, perché questo ha un raggio atomico molto maggiore degli altri, e quindi la lunghezza dell'asta aumenta in proporzione.
