Laboratorio di chimica in casa/Detergenti

Per detergente si intende qualsiasi sostanza utilizzata per pulire.[1]
Ognuno di questi contiene delle sostanze, chiamate principi attivi, che ne determinano le diverse proprietà detergenti, e che sono quelle che possono essere utilizzate per il laboratorio.
Il resto dei componenti sono l'acqua, che funge da solvente, e gli additivi, ossia quelle sostanze aggiuntive che migliorano le qualità del prodotto.[2]
Principi attivi
[modifica | modifica sorgente]
I detergenti utili in laboratorio saranno quelli contenenti un solo principio attivo e il minor numero di eccipienti. Esempi di questi sono l'acqua ossigenata, l'acido muriatico, l'ammoniaca, l'alcol denaturato, la candeggina, il sapone, l'acido solforico, la soda ecc.
I rispettivi principi attivi sono acidi, basi, agenti ossidanti, saponi ecc. e saranno utili precursori di altre sostanze.
Questi sono elencati sull'etichetta del prodotto, talvolta assieme alla loro percentuale P/V, e messi in ordine di concentrazione decrescente.[3]
Esempio:
Contiene: Ipoclorito di sodio (5% max), profumo.
Nel caso l'etichetta desse un'idea vaga del contenuto ("Contiene sbiancanti a base di cloro" o "tensioattivi non ionici") l'elenco dettagliato dei principi attivi si può trovare nella scheda tecnica del prodotto, sul sito internet sempre indicato sull'etichetta (oppure digitando "Nome prodotto - scheda tecnica" in internet).
Si veda anche la sezione Altre informazioni.
Additivi
[modifica | modifica sorgente]Per evitare incidenti, ai detersivi viene aggiunta un'infima quantità di colorante che permette di distinguerli dall'acqua o da altri prodotti alimentari.
Il produttore può anche modificare l'odore del prodotto aggiungendo dei profumi, anche in questo caso in quantità molto piccole.
Certi detersivi contengono inoltre conservanti che svolgono un'azione battericida.
Coloranti, profumi e conservanti, sia per la loro bassa concentrazione che per la loro natura chimica non interferiscono nelle le reazioni.
Qui viene fatto un elenco dei diversi additivi che un detersivo può contenere, in ordine alfabetico con i nomi internazionali. Ognuno di questi, se non è elencato nell'etichetta del prodotto lo è nella sua scheda tecnica.
Questa parte del modulo è incompleta ed i suoi contenuti devono ancora essere inseriti ed aggiornati completamente. Attendi che l'autore la completi oppure ampliala secondo le convenzioni di Wikibooks. |
-
Citral/Geranial
-
2-bromo-2-nitropropane-1,3-diol/Bronopol
-
Dichlorooctylisothiazolinone
-
Octylisothiazolinone
Tensioattivi
[modifica | modifica sorgente]

I tensioattivi sono sostanze che abbassano la tensione superficiale del liquido in cui sono disciolti, permettendogli di penetrare meglio nelle fibre dei tessuti da pulire.
Questi sono molecole organiche chimicamente simili ai saponi, e si dividono in quattro categorie:
- Tensioattivi non ionici: sono alcoli ed eteri idrosolubili che non si dissociano in soluzione.
- Tensioattivi anionici: sono acidi carbossilici, solfonici, solfati o fosfonati a lunga catena, che rilasciano un catione (la molecola a lunga catena è quindi un anione).
- Tensioattivi cationici: sono sali di ammonio quaternario che in soluzione si dissociano in una lunga catena di atomi di carbonio terminante con un atomo di azoto positivo, ed uno ione alogenuro (solitamente Cl- o Br-).
- Tensioattivi anfoteri: sono molecole organiche contenenti sia un gruppo acido che uno basico, i quali si comportano da zwitterioni.
Questi costituiscono principalmente i detersivi per la biancheria, e talvolta anche quelli per la casa e per le stoviglie. Tra di essi ce ne sono alcuni come il cloruro di benzalconio che hanno anche proprietà battericide. Le loro proprietà verranno sfruttate nella parte del libro dedicata alla chimica organica, anche se i tensioattivi che compongono i detersivi sono miscele di vari principi attivi difficilmente separabili.
Meccanismo detergente dei saponi
[modifica | modifica sorgente]

I saponi hanno la caratteristica di possedere una parte della molecola polare ed un'altra parte di molecola elettricamente neutra. La parte polare (la "testa" della molecola) permette loro di essere solubili in acqua, poiché sono attirati in soluzione dalla carica elettrica delle molecole del solvente (anch'esse polari). La parte apolare invece non risente di questa carica elettrica, e deve a ciò le sue caratteristiche idrofobe.
Mentre sono in soluzione, le molecole di sapone sono solitamente aggregate sotto forma di micelle: esse tengono le teste rivolte dalla parte del solvente, mentre le code sono tutte allineate, le une vicine alle altre, formando delle sfere. All'interno di queste sfere cave possono rimanere intrappolate altre molecole di sostanze idrofobe, come oli e grassi, per essere così disciolte e portate in soluzione (altrimenti sarebbero respinte dalle molecole d'acqua e non si scioglierebbero).
Elenco a immagini
[modifica | modifica sorgente]Questa parte del modulo è incompleta ed i suoi contenuti devono ancora essere inseriti ed aggiornati completamente. Attendi che l'autore la completi oppure ampliala secondo le convenzioni di Wikibooks. |
Qui di seguito viene fatto un elenco dei diversi tensioattivi presenti nei detersivi.
-
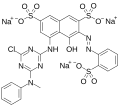
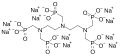
Sodium Diethylenetriamine Pentamethylene Phosphonate
-
Disodium Distyrylbiphenyl Disulphonate
Non mischiare i detersivi
[modifica | modifica sorgente]
Questo è un elenco di varie possibili reazioni chimiche che avvengono mischiando assieme vari detergenti:
- Mischiando candeggina ed acido muriatico si ottiene cloruro di sodio e gas cloro secondo la seguente reazione:
- 3 NaClO(aq) + HCl → NaCl(aq) + Cl2↑ + 2 H2O
- Il cloro è un gas altamente tossico, per questo si dice sempre di non mischiare mai le due sostanze.
- Mischiando ammoniaca ed acido muriatico si ottiene cloruro di ammonio secondo la seguente reazione:
- HCl + NH4OH → NH4Cl + H2O
- Si possono osservare microscopici cristalli di cloruro di ammonio mentre si mischiano i due composti, prodotti dai loro vapori fuoriusciti dalle soluzioni. Essi sono fortemente irritanti per l'apparato respiratorio.
- Mischiando candeggina ed ammoniaca si ottengono clorammine ed idrazina, secondo le seguenti possibili reazioni:
- NaClO(aq) + NH4OH(aq) → NH2Cl(aq) + NaOH(aq) + H2O
- NH2Cl(aq) + NaOH(aq) → N2H4 (aq) + NaCl(aq) + H2O
- NH2Cl + NaClO(aq) → NHCl2 (aq) + NaOH(aq)
- NHCl2 (aq) + NaClO(aq) → NCl3 + NaOH(aq)
- Queste sostanze sono volatili, esplosive se concentrate e liberano gas cloro. L'idrazina è altamente tossica.
Altre informazioni
[modifica | modifica sorgente]- Approfondimenti
- Nomenclatura INCI su it.Wikipedia
- Laundry detergent su en.Wikipedia
- Normativa CE 648/2004
- Siti utili
- detergentinfo.com - ingredienti dei detersivi.
- rubeuro.com - schede tecniche di molti detersivi.
- Chemical Book - formule di struttura di vari tensioattivi.
- Sigma-Aldrich - catalogo dei detergenti disponibili sul sito.
- GESTIS database - informazioni su varie sostanze chimiche.
- Altri progetti
 Wikipedia contiene una voce su detergente
Wikipedia contiene una voce su detergente Wikimedia Commons contiene immagini o altri file su detergente
Wikimedia Commons contiene immagini o altri file su detergente
- Altri libri