Sistemi sensoriali/Impianti neurosensoriali
Introduzione
Sistema visivo
Sistema uditivo
Sistema somatosensoriale
Sistema gustativo
Sistema vestibolare
Impianti Retinici
[modifica | modifica sorgente]Dalla fine del 20esimo secolo, ristabilire la vista in persone cieche attraverso protesi oculari è stato l’obiettivo di numerosi gruppi di ricerca e qualche azienda privata nel mondo. Simile agli impianti cocleari, il concetto chiave è stimolare il sistema nervoso relativo alla vista con impulsi elettrici, evitando i fotorecettori danneggiati o degenerati nella retina umana. In questo capitolo saranno descritte le funzionalità di base di un impianto retinale, e i diversi approcci che sono attualmente investigati e sviluppati. I due approcci più comuni usati in impianti retinali sono chiamati “epiretinali” e “subretinali”, corrispondenti a protesi oculari posizionate rispettivamente sopra o dietro la retina. Altri approcci per rispristinare la vista che non includono la retina non saranno trattati, come il BrainPort Vision System, che punta a stimolare la lingua da un input visivo, elettrodi elicoidali intorno al nervo ottico, o impianti che stimolano la corteccia visiva primaria.
Struttura e Funzione della Retina
[modifica | modifica sorgente]
Figura 1 mostra una schematica della struttura nervosa della retina umana. Possiamo distinguere tre strati di cellule. Il primo, posizionato il più lontano dal cristallino, è costituito da fotorecettori (coni e bastoncelli) il cui obiettivo è trasformare la luce entrante in segnale elettrici che sono propagati allo strato intermedio, costituito principalmente da cellule bipolari. Le cellule bipolari, che sono connesse sia a fotorecettori sia ad altri tipi di cellule come le cellule orizzontali e le cellule amacrine, trasmettono il segnale alle cellule gangliari retiniche (CGR). Per una descrizione dettagliata sulla funzionalità delle cellule bipolari, in particolare rispetto alla loro divisione in cellule bipolari ON e OFF, si può riferire al capitolo Sistema Visivo. Lo strato più esterno, che consiste di CGR, raccoglie gli impulsi elettrici dalle cellule orizzontali e li trasmette al talamo attraverso il nervo ottico. Da quest’ultimo, i segnali sono trasmessi alla corteccia visiva primaria. Ci sono alcuni aspetti chiave che vale la pena menzionare riguardo all'elaborazione del segnale all'interno della retina umana. In primo luogo, mentre le cellule bipolari, così come quelle orizzontali e amacrine, generano potenziali graduati, le CGR generano invece potenziali d'azione. Inoltre, la densità di ogni tipo di cellula non è uniforme in tutta la retina. Mentre da un lato troviamo una densità estremamente alta di bastoncelli e coni nell'area della fovea, con in più solo pochi fotorecettori collegati alle CGR attraverso lo strato intermedio, dall'altro troviamo una densità molto più bassa di fotorecettori nelle aree periferiche della retina, con molti fotorecettori collegati a una singola CGR. Lo strato intermedio ha anche implicazioni dirette sul campo recettivo di un CGR, poiché tende ad aumentare rapidamente verso le regioni esterne della retina, semplicemente a causa della minore densità di fotorecettori e del maggior numero di fotorecettori collegati allo stesso CGR.
Malattie Degenerative della Retina
[modifica | modifica sorgente]Come menzionato in precedenza in questa wiki, la retina è un tessuto sensibile alla luce situato nella parte posteriore dell'occhio, costituito da diversi strati che contengono una varietà di cellule di tipi diversi. La retina è principalmente coinvolta nell'elaborazione visiva neurale con segnali che hanno origine nei fotorecettori e che viaggiano fino al cervello attraverso gli assoni delle cellule gangliari. Quando questo tessuto stratificato degenera, può verificarsi una perdita permanente della vista [1]. Questo è spesso causato da malattie degenerative della retina come la degenerazione maculare senile (DMS) e la retinite pigmentosa (RP), che sono le due condizioni più diffuse che portano progressivamente a danni e perdite permanenti della vista. Attualmente, non ci sono cure per queste due malattie retiniche e con le terapie moderne che hanno solo la capacità di rallentare la progressione della malattia, sono necessarie strategie per ripristinare la visione dei pazienti. Uno degli strumenti attualmente allo studio è la tecnologia delle protesi retiniche che stimola il tessuto vivo della retina per ripristinare la visione, che sarà descritta in una sezione successiva[2]. .
Degenerazione Maculare Senile (DMS)
[modifica | modifica sorgente]Template:Multiple image Come suggerito dal suo nome, la degenerazione maculare è una malattia degenerativa della retina con un esordio che si verifica principalmente negli individui anziani. La DMS ruota intorno alla progressiva degenerazione dei fotorecettori a cono nella macula, che porta alla visione sfocata nel centro del campo visivo. Questo può progredire fino al punto in cui l'individuo ha una perdita completa della vista al centro del campo visivo, nota come punti ciechi. Anche se AMD può colpire uno o entrambi gli occhi, raramente porta alla cecità completa, poiché la visione periferica del paziente rimane intatta. Ci sono due tipi principali di DMS: secca e umida. La DMS secca rappresenta la maggior parte dei casi della malattia ed è caratterizzata da piccoli depositi gialli, noti come drusen, che si verificano nella macula tra l'epitelio pigmentato retinico e la coroide. La progressione in questo tipo di DMS è inizialmente lenta con pochi sintomi e si intensifica solo quando si verifica l'atrofia retinica. La DMS umida è caratterizzata dalla neovascolarizzazione della coroide, ovvero la crescita anormale di vasi sanguigni che sono inclini a rompersi e provocare una perdita di sangue e proteine e la formazione di cicatrici, portando infine al danno permanente dei coni e quindi alla perdita della vista. La progressione della DMS umida e l'associata perdita della vista sono molto più rapide che nella DMS secca [3].
Retinite Pigmentosa (RP)
[modifica | modifica sorgente]
La retinite pigmentosa è una malattia ereditaria degenerativa dell'occhio che coinvolge le cellule fotorecettrici dei bastoncelli e che ha un esordio precoce negli individui più giovani. In questa malattia, i bastoncelli si deteriorano progressivamente e alla fine portano alla perdita della vista nel campo visivo periferico e nella visione notturna. Questa perdita si verifica prima esternamente e poi progredisce verso l'interno, creando un effetto di "visione a tunnel" nel paziente. La perdita della vista si verifica simmetricamente, con entrambi gli occhi colpiti in tempi simili. A differenza della DMS, questa malattia oculare può estendersi oltre la periferia e iniziare a colpire il campo visivo centrale attraverso la degenerazione delle cellule fotorecettrici a cono. Questo lascia l'individuo con una continua perdita della vista che può alla fine portare alla cecità completa, anche se abbastanza rara. La retinite pigmentosa è geneticamente ereditata e ha una varietà di mutazioni genetiche che possono portare ad un fenotipo RP, portando ad una varietà di modelli di ereditarietà. Tuttavia, quando il modello di eredità è autosomico dominante, la maggior parte dei casi sono legati a mutazioni nel gene della rodopsina. Questa mutazione interrompe la funzione della rodopsina, che è una proteina essenziale nel processo di fototrasduzione. Attualmente non esiste una cura per la retinite pigmentosa [2]. Tuttavia, nel 2008 Shigeru Sato e i suoi colleghi hanno scoperto una proteina retinica simile alla matrice extracellulare chiamata Pikachurin, che potrebbe portare a una potenziale terapia della malattia grazie al suo coinvolgimento nelle interazioni tra cellule fotorecettoriali e cellule bipolari [4].
Array di Microelettrodi per Stimolazione Retinica
[modifica | modifica sorgente]
Come menzionato sopra, non ci sono cure per i progressivi problemi visivi causati dalla degenerazione maculare e dalla retinite pigmentosa. Tuttavia, in entrambe le malattie, anche se si verifica una sostanziale perdita di cellule fotorecettrici, una quantità significativa di neuroni retinici interni sopravvive anni dopo l'inizio della malattia. Questo fornisce un'opportunità per la stimolazione artificiale delle cellule della retina rimanenti, ancora correttamente funzionanti, attraverso elettrodi, per ripristinare le informazioni visive per il paziente umano. Gli array di microelettrodi utilizzano elettrodi per stimolare la retina a livello extracellulare attraverso un posizionamento molto vicino che permette di formare un'interfaccia elettrochimica tra la matrice e la soluzione salina che si trova intorno alla retina. La corrente viene iniettata attraverso l'interfaccia array-retina e eventualmente guida la depolarizzazione delle membrane dei neuroni che porta a potenziali d'azione. Questa stimolazione può essere catodica o anodica. Nella stimolazione catodica, le cariche negative aumentano al di fuori della membrana guidando così le cariche positive intracellulari, con un conseguente gradiente di depolarizzazione che è più forte in prossimità dell'elettrodo. Nella stimolazione anodica, l'iperpolarizzazione avviene nelle aree più vicine agli elettrodi e la depolarizzazione avviene a distanze maggiori. Pertanto, la stimolazione catodica è generalmente considerata più efficiente per la stimolazione poiché richiede un'iniezione di corrente molto più bassa. La fase della stimolazione non è l'unico fattore che influenza l'efficacia della stimolazione. La forma d'onda, che può assumere una varietà di forme come monofasica e bifasica, gioca un ruolo importante per quanto riguarda la sicurezza della stimolazione dei neuroni della retina. Per esempio, nelle scimmie, è stato scoperto che una corrente monofasica con solo una fase anodica potrebbe danneggiare le cellule precedentemente vive. Pertanto, gli impianti che utilizzano la stimolazione della retina fanno adesso uso di una forma d'onda bifasica a carica bilanciata. Questa forma d'onda utilizza una fase catodica per la stimolazione e una fase anodica per la scarica, bilanciando così le cariche sulla membrana. Con questa capacità di stimolazione, una protesi retinica può essere impiantata sia dietro la retina, che quindi assume il nome di impianto subretinico. Questo porta gli elettrodi il più vicino possibile ai fotorecettori danneggiati e alle cellule bipolari ancora correttamente funzionanti, che sono il vero obiettivo della stimolazione in questo caso. Se gli elettrodi di stimolazione penetrano nella coroide, che contiene il rifornimento di sangue della retina, gli impianti sono talvolta chiamati impianti "sovra-coroidali". Oppure l'impianto può essere messo sopra la retina, più vicino allo strato delle cellule gangliari, mirando invece alla stimolazione delle CGR. Questi impianti vengono così chiamati impianti epiretinali. Entrambi gli approcci sono attualmente studiati da diversi gruppi di ricerca. Entrambi hanno vantaggi notevoli, così come gli svantaggi. Prima di essere trattati separatamente in modo più dettagliato, verranno descritti alcuni problemi chiave da considerare in entrambi i casi [2].
Difficoltà
[modifica | modifica sorgente]Difficoltà dell'Attuale Tecnologia degli Elettrodi
[modifica | modifica sorgente]Una delle grandi difficoltà nell'ambito degli impianti retinici viene dalla densità spaziale estremamente elevata di cellule nervose nella retina umana. Ci sono circa 125 milioni di fotorecettori (bastoncelli e coni) e 1,5 milioni di cellule gangliari nella retina umana, contro circa 15000 cellule ciliate nella coclea umana [5] [6]. Nella fovea, dove si raggiunge la massima acuità visiva, si trovano ben 150000 coni in un millimetro quadrato. Mentre ci sono molto meno CGR in totale rispetto ai fotorecettori, la loro densità nell'area foveale è vicina alla densità dei coni, rendendo difficile bersagliare le cellule nervose con una risoluzione spaziale sufficiente con elettrodi artificiali. Praticamente tutti gli attuali esperimenti scientifici con impianti retinici utilizzano array di microelettrodi (MEA) per stimolare le cellule della retina. MEAs ad alta risoluzione hanno uno spazio di circa 50μm tra elettrodi, con conseguente densità di elettrodi di 400 elettrodi per millimetro quadrato. Pertanto, un'associazione uno-a-uno tra elettrodi e fotorecettori o CGR rispettivamente è attualmente impossibile nella zona foveale con le correnti tecnologie in campo di elettrodi. Tuttavia, la densità spaziale sia dei fotorecettori che delle CGR diminuisce rapidamente verso le regioni esterne della retina, rendendo più fattibile una stimolazione uno-a-uno tra gli elettrodi e le cellule nervose periferiche [7]. Altre difficoltà riguardano il funzionamento degli elettrodi entro limiti di sicurezza. Imporre densità di carica superiori a 0.1 mC/cm2 può danneggiare il tessuto nervoso [7]. In generale, più una cellula è lontana dall'elettrodo stimolante, maggiore è l'ampiezza della corrente richiesta per la stimolazione della cellula. Inoltre, più bassa è la soglia di stimolazione, più piccolo l'elettrodo può essere progettato e più ravvicinati gli elettrodi possono essere collocati sul MEA, migliorando così la risoluzione spaziale di stimolazione. La soglia di stimolazione è definita come l'intensità di stimolazione minima necessaria per innescare una risposta nervosa in almeno il 50% degli impulsi di stimolazione. Per queste ragioni, uno degli obiettivi primari nella progettazione di impianti retinici è quello di utilizzare una corrente di stimolazione il più bassa possibile, pur garantendo una stimolazione affidabile (cioè la generazione di un potenziale d'azione nel caso delle CGR) della cellula bersaglio. Questo può essere ottenuto posizionando l'elettrodo il più vicino possibile all'area della cellula bersaglio che è più sensibile all'impulso di campo elettrico applicato o facendo crescere le proiezioni cellulari, cioè i dendriti e/o gli assoni, sopra l'elettrodo, permettendo una stimolazione della cellula con correnti molto basse anche se il corpo cellulare si trova lontano. Inoltre, un impianto fissato alla retina segue automaticamente i movimenti del bulbo oculare. Mentre questo comporta alcuni vantaggi notevoli, significa anche che qualsiasi connessione all'impianto - per regolare i parametri, leggere i dati o fornire energia esterna per la stimolazione - richiede un cavo che si muove con l'impianto. Poiché muoviamo i nostri occhi circa tre volte al secondo, questo espone il cavo e le connessioni coinvolte a un forte stress meccanico. Per un dispositivo che dovrebbe rimanere funzionante per tutta la vita senza interventi esterni, questo impone difficoltà importante in termini di materiali e di tecnologia di per sé.
Difficoltà di Biocompatibilità
[modifica | modifica sorgente]Oltre alle difficoltà elettriche, una delle difficoltà chiave in un impianto retinico è il contatto con il tessuto biologico. Quando una sostanza estranea, come un impianto, entra in contatto con sostanze fisiologiche, si scatena una risposta immunitaria. Questa risposta è tipicamente sotto forma di infiammazione o isolamento della sostanza, che spesso porta alla cicatrizzazione dei tessuti coinvolti. Questo è un problema soprattutto con gli impianti retinici perché la protesi deve essere inserita, attraverso i tessuti, nella posizione appropriata. Se il materiale usato è troppo appuntito o non è posizionato attentamente, si può verificare una lesione del tessuto, che intensifica ulteriormente una risposta immunitaria. Inoltre, queste risposte possono portare a una perdita di segnale elettrico nel tempo, poiché il sistema immunitario può progressivamente "incapsulare" l'area stimolata, il che sarebbe deleterio per un impianto a lunga durata. Finora, un impianto epi-retinico, Argus II, è stato in grado di aggirare i problemi di biocompatibilità e rimanendo ancora funzionante dopo 3 anni in un paziente. Questo impianto fa uso di silicone, che è un materiale che ha una buona biocompatibilità a lungo termine, ma è un substrato rigido che non permette di modificare facilmente la configurazione del dispositivo. Altri materiali come poliimmide e oro sono stati studiati per quanto riguarda la funzionalità e la biocompatibilità di impianti retinici. Il poliimmide è un polimero promettente per impianti futuri, poiché impianti fatti di questo materiale hanno funzionato su occhi umani in studi a breve termine. Tale materiale è vantaggioso per la sua alta biocompatibilità, flessibilità e bassi costi. L'ottimizzazione di materiali adatti ad impianti retinici è in corso mentre i progressi tecnologici producono array di microelettrodi più complessi che hanno bisogno di substrati diversi per la massima funzionalità [8] [9].
Impianti Subretinali
[modifica | modifica sorgente]Come già suggerisce il nome, gli impianti subretinali sono protesi visive situate dietro la retina. Pertanto, l'impianto si trova più vicino ai fotorecettori danneggiati, con l'obiettivo di bypassare i bastoncelli e i coni e stimolando le cellule bipolari nello strato nervoso successivo nella retina. Il vantaggio principale di questo approccio risiede nella relativamente scarsa elaborazione del segnale visivo che avviene tra i fotorecettori e le cellule bipolari che devono essere imitate dall'impianto. Cioè, le informazioni visive grezze, ad esempio catturate da una videocamera, possono essere inoltrate direttamente, o con un'elaborazione del segnale relativamente rudimentale, al MEA che stimola le cellule bipolari, rendendo la procedura piuttosto semplice dal punto di vista dell'elaborazione del segnale. Tuttavia, questo approccio ha severi svantaggi. L'alta risoluzione spaziale dei fotorecettori nella retina umana impone grandi difficoltà nello sviluppo e nella progettazione di un MEA con una risoluzione di stimolazione sufficientemente alta e quindi poco spazio tra elettrodi. Inoltre, la stratificazione di strati nervosi in direzione z (con il piano x-y tangenziale alla curvatura della retina) pone un'altra difficoltà quando si tratta di posizionare gli elettrodi vicino alle cellule bipolari. Con il MAE situato dietro la retina, c'è un gap spaziale significativo che deve essere superato tra gli elettrodi e le cellule bersaglio. Come accennato in precedenza, una maggiore distanza tra l'elettrodo e le cellule bersaglio costringe il MAE ad operare con correnti più elevate, aumentando le dimensioni dell'elettrodo, il numero di cellule all'interno della gamma di stimolazione di un singolo elettrodo e la separazione spaziale tra elettrodi adiacenti. Tutto questo si traduce in una diminuzione della risoluzione di stimolazione, oltre ad opporre la retina al rischio di danni ai tessuti causati da densità di carica troppo elevate. Come mostrato di seguito, un modo per superare le grandi distanze tra gli elettrodi e le cellule bersaglio è quello di far crescere le cellule le loro proiezioni su distanze più lunghe direttamente sopra l'elettrodo.
Alla fine del 2010, un gruppo di ricerca tedesco in collaborazione con la società privata tedesca "Retina Implant AG", ha pubblicato i risultati di studi che prevedevano test con impianti subretinali in soggetti umani [10]. Un array di microfotodiodi (MPDA) di tre millimetri per tre, contenente 1500 pixel, con ogni pixel composto da un singolo fotodiodo sensibile alla luce e da un elettrodo, è stato impiantato dietro la retina di tre pazienti affetti da cecità dovuta a degenerazione maculare. I pixel erano situati a circa 70μm l'uno dall'altro, ottenendo una risoluzione spaziale di circa 160 elettrodi per millimetro quadrato - o, come indicato dagli autori dell'articolo, un angolo di cono visivo di 15 arcmin per ogni elettrodo. Va notato che, in contrasto con impianti che utilizzano videocamere esterne per generare input visivi, ogni pixel del MPDA stesso contiene un fotodiodo sensibile alla luce, generando autonomamente la corrente elettrica dalla luce ricevuta attraverso il bulbo oculare per il proprio elettrodo associato. Così ogni pixel della MPDA corrisponde funzionalmente a una cellula fotorecettrice a tutti gli effetti. Questo ha un grande vantaggio: poiché l'MPDA è fissato dietro la retina umana, è trascinato automaticamente quando il bulbo oculare viene mosso. E poiché la MPDA stesso riceve l'input visivo per generare le correnti elettriche per gli elettrodi di stimolazione, i movimenti della testa o del bulbo oculare sono gestiti naturalmente e non hanno bisogno di un'elaborazione artificiale. In uno dei pazienti, il MPDA è stato posizionato direttamente sotto la macula, portando a risultati superiori nei test sperimentali rispetto agli altri due pazienti, il cui MPDA è stato impiantato più lontano dal centro della retina. I risultati ottenuti dal paziente con l'impianto dietro la macula erano alquanto straordinari. Il paziente era in grado di riconoscere lettere (grandi 5-8 cm) e leggere parole, nonché di distinguere modelli bianco-neri con orientamenti diversi [10].
I risultati sperimentali con gli impianti MPDA hanno anche attirato l'attenzione su un altro fenomeno visivo, rivelando un ulteriore vantaggio dell'approccio MPDA rispetto agli impianti che utilizzano dispositivi di imaging esterni: la continua stimolazione delle cellule retiniche porta rapidamente a una diminuzione di risposte di ritorno, suggerendo che i neuroni retinici vengono inibiti dopo essere stati stimolati ripetutamente in un breve periodo di tempo. Questo implica che un input visivo proiettato su un MEA fissato sulla retina o dietro di essa si tradurrà in un'immagine percepita che svanisce rapidamente, anche se la stimolazione elettrica degli elettrodi rimane costante. Ciò è dovuto agli elettrodi fissi sulla retina che stimolano sempre le stesse cellule, rendendole sempre meno sensibili a uno stimolo costante nel tempo. Tuttavia, il processo è reversibile, e le cellule riacquistano la loro sensibilità iniziale una volta che lo stimolo è nuovamente assente. Quindi, come fa un sistema visivo intatto a gestire questo effetto? Perché soggetti sani sono in grado di fissare un oggetto nel tempo senza che questo svanisca? Come menzionato in [11], l'occhio umano in realtà si regola continuamente in piccoli e impercettibili movimenti oculari, con il risultato che lo stesso stimolo visivo viene proiettato su punti retinici leggermente diversi nel tempo, anche se tendiamo a focalizzare e fissare l'occhio su qualche oggetto target. Questo aggira con successo il fenomeno della risposta cellulare in dissolvenza. Nel caso del MPDA, visto che l'impianto serve sia come fotorecettore che come stimolatore di elettrodi, i piccoli aggiustamenti naturali dell'occhio possono essere facilmente utilizzati per gestire questo effetto in modo diretto. Altri approcci d'impianto che usano input visivi esterni (per esempio da videocamere) soffrirebbero del fatto che immagini proiettate svanirebbero se stimolate continuamente. Il jittering veloce e artificiale delle immagini della videocamera potrebbe non risolvere il problema perché questo movimento esterno potrebbe non essere in accordo con il movimento dell'occhio e potrebbe essere interpretato dalla corteccia visiva semplicemente come una scena tremolante o sfocata, invece che come la desiderata proiezione dell'immagine fissa e costante a lungo termine. Un ulteriore vantaggio degli impianti subretinali è la precisa correlazione tra le aree stimolate sulla retina e la posizione percepita dello stimolo nel campo visivo nel soggetto umano. In contrasto con le CGR, la cui posizione sulla retina può non corrispondere direttamente alla posizione dei loro campi recettivi individuali, la stimolazione di una cellula bipolare è percepita esattamente in quel punto del campo visivo che corrisponde alla posizione geometrica sulla retina dove risiede quella cellula bipolare. Un chiaro svantaggio degli impianti subretinali è la procedura chirurgica invasiva che comporta.
Impianti Epiretinali
[modifica | modifica sorgente]Gli impianti epiretinali sono situati sulla parte superiore della retina e quindi più vicini alle cellule gangliari della retina (CGR). Per questo motivo, gli impianti epiretinali mirano a stimolare direttamente le CGR, bypassando non solo i fotorecettori danneggiati, ma anche qualsiasi elaborazione neurale visiva intermedia da parte delle cellule bipolari, orizzontali e amacrine. Questo ha alcuni vantaggi: prima di tutto, la procedura chirurgica per un impianto epiretinico è molto meno critica che per un impianto subretinico, poiché la protesi non deve essere impiantata da dietro l'occhio. Inoltre, ci sono molte meno CGR rispetto ai fotorecettori o alle cellule bipolari, permettendo una stimolazione più grossolana con una maggiore distanza tra gli elettrodi (almeno nelle regioni periferiche della retina), e una densità di elettrodi addirittura superiore a quella della densità reale delle CGR, permettendo una maggiore flessibilità e precisione nella stimolazione delle cellule. Uno studio sulla stimolazione epiretinica delle cellule parasol periferiche condotto sulla retina di macaco ha fornito dettagli quantitativi [7]. Le cellule parasol sono un tipo di CGR che formano la seconda via visiva più densa nella retina. Il loro scopo principale è quello di codificare il movimento degli oggetti nel campo visivo, rilevando così il movimento. Gli esperimenti sono stati eseguiti in-vitro collocando il tessuto della retina di macaco su un MEA di 61 elettrodi 60μm di distanza tra gli elettrodi). Venticinque (25) singole cellule parasol sono stati identificati e stimolati elettronicamente, mentre proprietà come la soglia di stimolazione e la posizione di migliore stimolazione sono stati analizzati. La corrente di soglia è stata definita come la corrente più bassa che ha innescato un picco sulla cellula bersaglio nel 50% degli impulsi di stimolo (durata dell'impulso: 50ms ed è stato determinato aumentando gradualmente l'intensità di stimolazione fino a quando un picco di risposta sufficiente fosse registrato. È importante notare due aspetti: in primo luogo, le cellule parasol come CGR generano potenziali d'azione, mentre le cellule bipolari generano potenziali graduati. In secondo luogo, gli elettrodi del MEA sono stati utilizzati sia per impulsi di stimolazione che per registrare il picco di risposta dalle cellule bersaglio. Sul MEA da 61 elettrodi erano posizionate 25 cellule parasol, con una densità di elettrodi significativamente superiore alla densità delle cellule parasol, ottenendo effettivamente più elettrodi all'interno dei campi recettivi di una singola cellula parasol. Oltre a misurare le soglie di stimolazione necessarie per innescare una risposta cellulare affidabile, è stata determinata anche la migliore posizione di stimolazione. La migliore posizione di stimolazione si riferisce alla posizione dell'elettrodo rispetto alla cellula bersaglio per la quale è necessaria la minore soglia di stimolazione. Sorprendentemente, lo studio ha rivelato che questa non si trova sul soma della cellula, come ci si aspetterebbe, ma circa 13μm più in basso lungo l'assone. Da quel punto in poi, gli esperimenti hanno mostrato il previsto aumento quadratico delle correnti di soglia di stimolazione con all'aumento della distanza elettrodo-soma. I risultati dello studio hanno anche mostrato che tutte le soglie di stimolazione erano ben al di sotto dei limiti di sicurezza (circa 0.05mC/cm2}, al contrario di 0.1mC/cm2} che è un basso limite di sicurezza) e che la risposta cellulare a un impulso di stimolazione era veloce (0.2ms di latenza in media) e precisa (con piccola varianza sulla latenza). Inoltre, avere una densità di elettrodi maggiore rispetto alla densità di cellule parasol ha permesso una stimolazione affidabile delle singole cellule quando l'elettrodo appropriato veniva utilizzato, evitando che anche le cellule vicine evocassero un picco di risposta.
Panoramica di Approcci Tecnici Alternativi
[modifica | modifica sorgente]In questa sezione, viene data una breve panoramica su alcuni approcci alternativi e tecnologie attualmente in fase di ricerca.
Elettrodi di Nanotubi
[modifica | modifica sorgente]I MEA classici contengono elettrodi fatti di nitruro di titanio o di ossido di indio e stagno che portano l'impianto ad avere gravi problemi di biocompatibilità a lungo termine [12]. Una promettente alternativa agli elettrodi metallici consiste in nanotubi di carbonio (NTC) che combinano una serie di proprietà molto vantaggiose. In primo luogo, sono completamente biocompatibili poiché sono composti di carbonio puro. In secondo luogo, la loro robustezza li rende adatti a rimanere impiantati a lungo termine, una proprietà chiave per le protesi visive. Inoltre, la buona conducibilità elettrica permette loro di funzionare come elettrodi. E infine, la loro natura molto porosa li rende superfici di contatto estremamente ampie, stimolando i neuroni a crescere sopra i NTC, migliorando così il contatto neurone-elettrodo e abbassando le correnti di stimolazione necessarie per suscitare una risposta cellulare. Tuttavia, gli elettrodi NTC sono emersi solo di recente e al momento sono disponibili solo pochi risultati scientifici.
Approcci con Impianti Wireless
[modifica | modifica sorgente]Una delle principali sfide tecniche degli impianti retinici riguarda il cablaggio che collega il MEA con gli stimoli esterni, l'alimentazione e i segnali di controllo. Lo stress meccanico sul cablaggio influisce sulla sua stabilità e durata a lungo termine, imponendo grandi difficoltà su quali materiali vengono utilizzati. Tecnologie wireless potrebbero essere un modo per aggirare qualsiasi cablaggio tra l'impianto retinico attuale e i dispositivi esterni, però l'energia della luce in entrata attraverso l'occhio non è sufficiente per innescare risposte neurali. Pertanto, per far funzionare un impianto wireless, è necessario fornire ulteriore potenza all'impianto. Un approccio presentato dalla Stanford School of Medicine utilizza un display LCD a infrarossi per proiettare la scena catturata da una videocamera sugli occhiali, riflettendo gli impulsi infrarossi sul chip situato sulla retina. Il chip utilizza anche una batteria ricaricabile fotovoltaica per fornire la potenza necessaria per trasformare la luce IR in impulsi di stimolazione sufficientemente forti. Simile all'approccio subretinico, questo permette anche all'occhio di fissare e mettere a fuoco naturalmente gli oggetti nella scena, dato che l'occhio è libero di muoversi, permettendo a diverse parti dell'immagine IR sugli occhiali di essere proiettate su diverse aree del chip situato sulla retina. Invece di usare la luce infrarossa, le bobine induttive possono anche essere usate per trasmettere energia elettrica e segnali di dati da dispositivi esterni all'impianto sulla retina. Questa tecnologia è stata implementata e testata con successo nell'impianto retinico EPIRET3 [13]. Tuttavia, tali test erano principalmente una prova di concetto, poiché è stata testata solo la capacità del paziente di percepire un segnale visivo dopo aver applicato uno stimolo sugli elettrodi.
Crescita Neurale Direzionata
[modifica | modifica sorgente]Un modo per permettere una stimolazione neurale molto precisa con correnti estremamente basse e anche su distanze più lunghe è quello di far crescere le proiezioni dei neuroni sull'elettrodo. Applicando la giusta soluzione chimica sul tessuto retinico, la crescita neurale può essere stimolata. Questo può essere ottenuto applicando uno strato di laminina sulla superficie del MEA. Al fine di controllare i percorsi neurali, la laminina non viene applicata uniformemente su tutta la superficie del MEA, ma in percorsi ristretti che formano un modello corrispondente alle connessioni i neuroni formerebbero naturalmente. Questo processo di applicazione della laminina in modo preciso e schematico è chiamato "stampa a microcontatto". Un'immagine di come appaiono questi percorsi di laminina è mostrata in Figura 5. Il successo della crescita neurale indirizzata ottenuta con questo metodo ha permesso di applicare correnti di stimolazione significativamente più basse rispetto alla classica stimolazione con elettrodi, pur essendo in grado di innescare una risposta neurale in modo affidabile [14]. Inoltre, la soglia di stimolazione non aumenta più in modo quadratico con la distanza elettrodo-soma, ma rimane costante con un livello sempre basso anche per distanze maggiori (200μm).
Array di Microelettrodi per Caratterizzare la Funzione della Retina: una Tecnologia Basata sui CMOS
[modifica | modifica sorgente]Come spiegato in precedenza nella sezione sfide di impianti retinici, molti MEA hanno un basso numero di elettrodi a distanza elevata, il che influisce sulla loro specificità e sul targeting dei neuroni nelle reti neurali. Questo è un fattore limitante nel poter vedere le dinamiche di rete e le funzionalità delle popolazioni neurali. In particolare, molti dettagli cellulari come le velocità di propagazione assonale e l'elaborazione delle informazioni assonali sono persi in array di densità inferiore. Recentemente, i ricercatori hanno approfittato della tecnologia CMOS (complimentary-oxide-semiconductor) per creare MEA ad alta densità con un'alta risoluzione spaziale che permettono la rilevazione di informazioni cellulari e offrono un alto rapporto segnale-rumore attraverso la deposizione di platino nero. Tali array possono avere 26400 microelettrodi su un array di 3,85 x 2,10 mm². Con una distanza di di 17.5μm tra di loro, la densità degli elettrodi è di 3265 elettrodi per μm² per 1024 canali di lettura [15]. Con molti interruttori sotto gli elettrodi, possono essere utilizzate varie configurazioni di elettrodi per valutare la popolazione neurale sul chip. Con un chip di microelettrodi così sensibile e denso, è possibile identificare singole cellule, analizzare la rete neuronale e registare informazioni assonali dalle cellule neurali. Questa tecnologia apre la porta a "biomarcatori" elettrofisiologici che una volta determinati possono essere usati per creare modelli di malattie e per la funzionalizzare tessuti, poiché la retina può essere sezionata, placcata e misurata in termini di segnali su un MEA [16].
Registrazioni dalla Retina
[modifica | modifica sorgente]
I segnali luminosi sono interpretati nella retina e queste informazioni sono immagazzinate nei neuroni dello strato gangliare, conosciuti come cellule gangliare retiniche (CGR). Queste cellule inviano poi queste informazioni tramite potenziali d'azione che possono essere registrati dai MEA per capire i circuiti retinici, lo sviluppo e la codifica relativi a una scena visiva. Questi esperimenti in-vitro sono tipicamente eseguiti isolando prima la retina dal suo tessuto nativo, ricoprendo il tessuto con cellule gangliari retiniche rivolte verso il basso sull'array, e facendo misurazioni stimolando con la luce. In seguito i dati vengono analizzati ordinando i picchi di segnale (una tecnica chiamata "spike sorting", che verrà spiegata più avanti. Farmaci bloccanti e diversi tipi di stimoli luminosi possono essere utilizzati per determinare la risposta dei fotorecettori e valutare la loro funzionalità. Inoltre, i ricercatori possono valutare come mutazioni retiniche affliggono i picchi di segnale nelle CGR o anche come queste determinano biomarcatori elettrofisiologici. In un esperimento, i ricercatori hanno usato un array di microelettrodi per retine di topi wild type e topi con un knockout di FRMD7. FMRD7 è una mutazione associata a movimenti oculari rapidi orizzontali e dipendenti dallo sguardo. I dati delle sessioni di registrazione sull'array di microelettrodi hanno indicato un'avvenuta perdita di risposta da cellule retiniche dedicate a rilevare direzioni orizzontali. I topi wild type non hanno rilevato una perdita di risposta né in cellule selettive a direzioni orizzontali né verticali. Tale scoperta indica la capacità di utilizzare la tecnologia MEA in studi futuri per determinare biomarcatori elettrofisiologici in malattie della retina [17].
Spike Sorting
[modifica | modifica sorgente]

Con le ultime tecnologie di microelettrodi che permettono registrazioni neurali da migliaia di elettrodi, possono essere analizzati grandi quantità di dati elettrofisiologici provenienti simultaneamente da tessuti e reti neurali con l'obiettivo di rivelare informazioni elettriche pertinenti sul sistema nervoso. Quando si utilizza un array di microelettrodi per le neuroscienze, i segnali elettrici dai neuroni (potenziali d'azione) vengono registrati a livello extracellulare. Ciò significa che il segnale acquisito in queste registrazioni è l'opposto del patch clamp; ovvero, l'ampiezza del potenziale d'azione è negativa rispetto al patch clamp. Queste segni distintivi a livello extracellulare contengono informazioni non solo sui potenziali d'azione, ma anche sui meccanismi sinaptici (potenziali locali), che possono essere identificati attraverso filtri e analisi. Il processo per analizzare e assegnare queste informazioni elettrofisiologiche a un singolo neurone è noto come spike sorting. L'aspetto principale di una registrazione che viene analizzato in una registrazione microelettrodica è il cosiddetto spike-train. Un neurone può essere identificato dalla sua attività di spike poiché la tempistica di ogni evento dipende dalla dimensione, dalla forma e dalla posizione del neurone rispetto all'elettrodo. Quando si registrano migliaia di neuroni, lo spike sorting diventa difficoltoso a causa del fenomeno del cocktail party. Se più neuroni sono in prossimità l'uno dell'altro, succede facilmente che un elettrodo registri segnali da diversi neuroni. Pertanto, lo scopo del spike sorting è quello di identificare un singolo neurone dal suo tipo di "conversazione" elettrica quando c'è molta "confusione" di fondo. Lo spike sorting è un processo a più fasi che prende dati grezzi dalla popolazione neurale e assegna i picchi a un singolo neurone nonostante ci sia "rumore" di fondo. La panoramica del processo di spike sorting può avere le seguenti fasi: Pre-elaborazione dei dati grezzi → rilevamento dei picchi → estrazione dei picchi e allineamento → estrazione delle caratteristiche → clustering → classificazione. In questo flusso di lavoro generale, un algoritmo di spike sorting prende i dati grezzi dalla popolazione neurale e prima li pre-processa filtrando le basse frequenze del potenziale d'azione (ovvero il rumore). I picchi vengono poi rilevati impostando una soglia di voltaggio. In seguito, le forme d'onda dei picchi che sono state estratte devono essere allineate nel tempo rispetto a una caratteristica generale del potenziale d'azione, come la sua posizione. Poi, le caratteristiche sono estratte da ogni singola forma d'onda utilizzando l'analisi delle componenti principali o le wavelets, necessario per ridurre i dati alle dimensioni necessarie che contengono le informazioni di interesse. I picchi sono poi raggruppati in modo da creare un modello per un singolo neurone. Questo viene fatto per i singoli neuroni nei dati. Non esiste un algoritmo di smistamento dei picchi che vado bene in generale, poiché le registrazioni da più elettrodi possono differire tra i diversi tipi di cellule, diverse specie e il tipo di registrazione effettuata. Pertanto, gli algoritmi devono essere regolati e ottimizzati per produrre risultati che possano rappresentare accuratamente i dati grezzi. Tuttavia, una volta che i dati sono ordinati per picco, tante informazioni possono essere acquisite dai dati come intervalli tra picchi, periodi refrattari, e la capacità di tracciare i dati dei singoli neuroni a confronto l'uno con l'altro per rilevarne le differenze [18].
Altri Impianti Visivi
[modifica | modifica sorgente]Oltre alla stimolazione della retina, anche altri elementi del sistema visivo possono essere stimolati.
Stimolazione del Nervo Ottico
[modifica | modifica sorgente]Con nervi elici, tipicamente solo alcuni segmenti.
Vantaggi:
- Minimo danno all'occhio.
Problemi:
- Non molto specifici.
Impianti Corticali
[modifica | modifica sorgente]
Dr. Mohamad Sawan, professore e ricercatore presso il Polystim neurotechnologies Laboratory dell'Ecole Polytechnique de Montreal, ha lavorato su una protesi visiva da impiantare nella corteccia umana. Il principio alla base della tecnologia del Dr. Sawan consiste nello stimolare la corteccia visiva impiantando un microchip di silicio su una rete di elettrodi fatti di materiali biocompatibili e in cui ogni elettrodo libera una corrente elettrica per provocare l'apparizione di una serie di punti luminosi (una matrice di pixel) nel campo visivo dell'utente ipovedente. Questo sistema è composto da due parti distinte: l'impianto e un controller esterno. L'impianto alloggiato nella corteccia visiva riceve i dati e l'energia dedicati dal controller esterno in modo wireless. Questa componente impiantabile contiene tutti i circuiti necessari per generare gli stimoli elettrici e per sorvegliare cambiamenti all'interfaccia tra microelettrodo e tessuto biologico. Inoltre, il controllo esterno a batteria comprende una microcamera che cattura l'immagine, nonché un processore e un generatore di comandi che elaborano i dati con l'obiettivo di selezionare e analizzare le immagini catturate e per generare e gestire il processo di stimolazione elettrica e supervisionare l'impianto. Il controller esterno e l'impianto scambiano dati in entrambe le direzioni tramite un potente collegamento transcutaneo a radiofrequenza (RF). L'impianto è alimentato in questo stesso modo (Wikipedia [1]).
Vantaggi:
- Area per la stimolazione molto più grande: 2° di raggio del campo visivo centrale della retina corrisponde a 1mm2 sulla retina, e 2100mm2 nella corteccia visiva.
Problemi:
- La procedura d'impianto è più invasiva.
- Parti del campo visivo risiedono in un solco e sono difficili da raggiungere.
- La stimolazione può provocare convulsioni.
Impianti Cocleari
[modifica | modifica sorgente]
Un impianto cocleare (CI) è un dispositivo elettronico impiantato chirurgicamente che sostituisce le parti meccaniche del sistema uditivo stimolando direttamente le fibre nervose uditive attraverso elettrodi all'interno della coclea. I candidati per gli impianti cocleari sono persone con perdita uditiva neurosensoriale da grave a profonda in entrambe le orecchie e un sistema nervoso uditivo funzionante. Questi impianti sono utilizzati sia da persone con sordità post-linguale per riacquistare una certa comprensione del discorso e di altri suoni, sia da bambini con sordità pre-linguale per consentire loro di acquisire competenze nel linguaggio parlato. (La diagnosi della perdita dell'udito nei neonati e nei bambini viene fatta usando le emissioni otoacustiche e/o la registrazione dei potenziali evocati uditivi). Un'evoluzione abbastanza recente è l'uso di impianti bilaterali che permettono agli utenti la localizzazione di suoni basilari.
Componenti di un Impianto Cocleare
[modifica | modifica sorgente]
L'impianto viene posizionato chirurgicamente sotto la pelle dietro l'orecchio. Le parti fondamentali del dispositivo includono:
Esterno:
- Un microfono che capta il suono dall'ambiente.
- Un processore vocale che filtra selettivamente il suono per dare priorità al discorso udibile e invia i segnali sonori elettrici attraverso un cavo sottile al trasmettitore.
- Un trasmettitore, che è una bobina tenuta in posizione da un magnete posto dietro l'orecchio esterno, il quale trasmette i segnali sonori elaborati al dispositivo interno per induzione elettromagnetica.
Interno:
- L'impianto cocleare (a sinistra), il microfono e il processore di segnale (al centro), e l'accessorio per il controllo remoto (a destra).
- Un ricevitore e uno stimolatore fissato nell'osso sotto la pelle, che converte i segnali in impulsi elettrici e li invia attraverso un cavo interno agli elettrodi.
- Un array con massimo 24 elettrodi avvolti attorno alla coclea che inviano gli impulsi ai nervi nella scala timpanica e poi direttamente al cervello attraverso il sistema nervoso uditivo.
Teoria dei Segnali per Impianti Cocleari
[modifica | modifica sorgente]In soggetti con udito normale, la parte del segnale vocale che è portatore primario di informazioni è l'involucro del segnale, mentre per la musica è la sua fine struttura. Questo è rilevante anche per le lingue tonali, come il mandarino, dove il significato delle parole dipende dalla loro intonazione. Si è anche scoperto che i ritardi temporali interaurali codificati nella struttura fine del segnale, e non nell'involucro, determinano da dove si sente un suono, nonostante il segnale codificato nell'involucro sia quello ad essere percepito.
Il processore vocale in un impianto cocleare trasforma il segnale d'ingresso del microfono in una serie parallela di segnali destinati alla coclea. Gli algoritmi per la funzione di trasferimento ottimale tra questi segnali sono ancora un'area attiva di ricerca. I primi impianti cocleari erano dispositivi a canale singolo. Il suono grezzo era filtrato in banda per includere solo la gamma di frequenza del discorso, poi modulato su un'onda di 16 kHz per permettere al segnale elettrico di accoppiarsi elettricamente ai nervi. Questo approccio era in grado di fornire un udito molto elementare, ma era estremamente limitato in quanto non era assolutamente in grado di sfruttare la mappa di localizzazione delle frequenze della coclea.
L'avvento degli impianti multicanale ha aperto la porta a una serie di strategie di elaborazione dei discorsi per facilitare l'ascolto. Queste strategie possono essere approssimativamente divise Forma d'Onda e Estrazione delle Caratteristiche.
Strategie per la Forma d'Onda
[modifica | modifica sorgente]
Queste strategie comportano generalmente l'applicazione di un guadagno non lineare sul suono (poiché un segnale audio in ingresso con una gamma dinamica di ~30dB deve essere compresso in un segnale elettrico con una gamma dinamica di soli ~5dB), e il passaggio attraverso filtri paralleli. La prima strategia di forma d'onda da provare è il cosiddetto approccio analogico compresso. In questo sistema, l'audio grezzo è inizialmente filtrato con un amplificatore controllato dal guadagno (il controllo del guadagno riduce la gamma dinamica del segnale). Il segnale viene poi passato attraverso filtri passa-banda paralleli, e l'uscita di questi filtri va a stimolare gli elettrodi nelle posizioni appropriate.
Un problema con l'approccio analogico compresso riguarda una forte interazione tra elettrodi adiacenti. Se gli elettrodi pilotati da due filtri vengono stimolati allo stesso tempo, la stimolazione sovrapposta può causare distorsioni indesiderate nei segnali provenienti dalle cellule ciliate che si trovavano nel raggio d'azione di entrambi gli elettrodi. La soluzione a questo problema è l'approccio di campionamento continuo interlacciato (o interleaved) (CIS) - in cui gli elettrodi guidati da filtri adiacenti stimolano in tempi leggermente diversi. Questo elimina l'effetto di interferenza tra elettrodi vicini, ma, a causa dell'interleaving, introduce il problema che la risoluzione temporale soffre.
Strategie per l'Estrazione di Caratteristiche
[modifica | modifica sorgente]
Queste strategie si concentrano meno sulla trasmissione di versioni filtrate del segnale audio e più sull'estrazione di caratteristiche più astratte del segnale e sulla loro trasmissione agli elettrodi. Le prime strategie di estrazione delle caratteristiche cercavano le formanti (frequenze con energia massima) nel discorso. Per fare questo, venivano applicate filtri a banda larga (ad esempio 270 Hz passa-basso per F0 - la formante base, 300 Hz-1 kHz per F1, e 1 kHz-4 kHz per F2), poi veniva calcolata la frequenza delle formanti, usando gli incroci dello zero di ciascuna di queste uscite dei filtri, e l'ampiezza delle formanti guardando l'involucro dei segnali da ciascun filtro. Solo gli elettrodi corrispondenti a queste frequenze di formanti sarebbero stati attivati. La principale limitazione di questo approccio era che le formanti identificano principalmente le vocali, mentre le informazioni sulle consonanti, che risiedono principalmente nelle frequenze più alte, erano scarsamente trasmesse. Il sistema MPEAK in seguito migliorò questo progetto incorporando filtri ad alta frequenza che potevano simulare meglio i suoni non vocali (consonanti) stimolando elettrodi ad alta frequenza ed elettrodi di frequenza delle formanti a intervalli casuali [19][20][21].
Sviluppi Attuali
[modifica | modifica sorgente]Attualmente, la strategia leader è il sistema SPEAK, che combina le caratteristiche delle strategie Waveform e Feature-Detection. In questo sistema, il segnale passa attraverso una serie parallela di 20 filtri passa-banda. L'involucro viene estratto da ognuno di questi e vengono selezionate alcune delle frequenze più potenti (la quantità dipende dalle caratteristiche dello spettro), e il resto viene scartato. Questa è conosciuta come una strategia "n-di-m". Le ampiezze di queste frequenze vengono poi compresse logaritmicamente per adattare la gamma del segnale meccanico del suono alla gamma molto più ristretta del segnale elettrico delle cellule ciliate.
Microfoni Multipli
[modifica | modifica sorgente]Sui suoi ultimi impianti, la società Cochlear usa 3 microfoni invece di uno. L'informazione aggiuntiva è usata per il beam-forming, cioè per estrarre più informazioni dal suono proveniente da davanti. Questo può migliorare il rapporto segnale-rumore quando si parla con altre persone fino a 15dB, migliorando così significativamente la percezione del parlato in ambienti rumorosi.
IC Integrati - Apparecchi Acustici
[modifica | modifica sorgente]La preservazione dell'udito a bassa frequenza dopo l'impianto cocleare è possibile con un'attenta tecnica chirurgica e con un'accurata attenzione al design degli elettrodi. Per i pazienti aventi rimanente udito a bassa frequenza, l'azienda MedEl offre una combinazione di un impianto cocleare per le frequenze più alte, e un apparecchio acustico classico per le frequenze più basse. Questo sistema, chiamato EAS per la stimolazione elettrico-acustica, utilizza un cavo di 18 mm, rispetto ai 31,5 mm per l'IC completo. (La lunghezza della coclea è di circa 36 mm.) Questo si traduce in un miglioramento significativo della percezione della musica e in un migliore riconoscimento del parlato per le lingue tonali.
Strutture Fini
[modifica | modifica sorgente]
Per le alte frequenze, il sistema uditivo umano utilizza solo la codifica tonotopica delle informazioni. Per le basse frequenze, tuttavia, viene utilizzata anche l'informazione temporale: il nervo uditivo si attiva sincronicamente con la fase del segnale. Al contrario, gli IC originali utilizzavano solo lo spettro di potenza del segnale in entrata. Nei suoi nuovi modelli, la MedEl incorpora le informazioni temporali per le basse frequenze, che chiama struttura fine, nel determinare la tempistica degli impulsi di stimolazione. Questo migliora la percezione della musica e la percezione del parlato per le lingue tonali come il mandarino.
Matematicamente, l'involucro e la struttura fine di un segnale possono essere elegantemente ottenuti con la trasformata di Hilbert (vedi figura sotto). Il codice Python corrispondente è disponibile sotto [22].
Elettrodi Virtuali
[modifica | modifica sorgente]Il numero di elettrodi disponibili è limitato dalle dimensioni dell'elettrodo (e dalle risultanti densità di carica e di corrente), e dalla diffusione della corrente lungo l'endolinfa. Per aumentare la specificità della frequenza, si possono stimolare due elettrodi adiacenti. I soggetti riferiscono di percepire questo come un singolo tono ad una frequenza intermedia tra i due elettrodi.
Simulazione di un Impianto Cocleare
[modifica | modifica sorgente]
L'elaborazione del suono nell'impianto cocleare è ancora oggetto di molte ricerche ed è una delle principali differenziazioni di prodotto tra i produttori. Tuttavia, l'elaborazione di suoni basilari è piuttosto semplice e può essere implementata per ottenere un miglioramento della qualità del suono percepito dai pazienti che utilizzano un impianto cocleare. Il primo passo in questo processo è quello di campionare un suono e analizzare la sua frequenza. Poi viene selezionata una finestra temporale, durante la quale vogliamo trovare le intensità di stimolazione degli elettrodi. Ci sono due modi per raggiungere questo obiettivo:
- attraverso l'uso di filtri lineari ( vedi Gammatone filters);
- o attraverso il calcolo del powerspectrum (vedi Spectral Analysis).
Impianti Cocleari e Imaging a Risonanza Magnetica
[modifica | modifica sorgente]Con più di 150.000 impianti in tutto il mondo, gli impianti cocleari (IC) sono diventati un metodo standard per il trattamento delle perdite uditive da gravi a profonde. Da quando i benefici degli IC sono diventati più evidenti, i finanziatori sono diventati più disposti a sostenere gli IC e a causa dei programmi di screening dei neonati nella maggior parte delle nazioni industrializzate, molti pazienti ricevono gli IC nell'infanzia e la maggior parte continua ad averli per tutta la vita. Alcuni di loro possono richiedere una scansione diagnostica durante la loro vita che può essere assistita da studi di imaging con risonanza magnetica (MRI). Per ampi segmenti della popolazione, compresi i pazienti che soffrono di ictus, mal di schiena o mal di testa, la risonanza magnetica è diventata un metodo standard per la diagnosi. La risonanza magnetica utilizza impulsi di campi magnetici per generare immagini e le attuali macchine per la risonanza magnetica lavorano con campi magnetici di 1,5 Tesla. I dispositivi da 0,2 a 4,0 Tesla sono comuni e la potenza di radiofrequenza può raggiungere un picco di 6 kW in una macchina da 1,5 Tesla.
Gli impianti cocleari sono stati storicamente ritenuti incompatibili con MRI con campi magnetici superiori a 0,2 T, richiedendo di rimuovere sempre le parti esterne del dispositivo. Per le parti interne del dispositivo invece ci sono regolamenti diversi. Le attuali linee guida della Food and Drug Administration (FDA) statunitense consentono un uso limitato della MRI dopo l'impianto di un IC. I dispositivi Pulsar e Sonata (MED-EL Corp, Innsbruck, Austria) sono approvati per la risonanza magnetica a 0,2 T con il magnete del dispositivo in posizione. L'Hi-res 90K (Advanced Bionics Corp, Sylmar, CA, USA) e il Nucleus Freedom (Cochlear Americas, Englewood, CO, USA) sono approvati per un MRI fino a 1,5 T dopo la rimozione chirurgica del magnete interno. Ogni rimozione e sostituzione del magnete può essere fatta utilizzando una piccola incisione in anestesia locale, ma la procedura rischia di indebolire il compartimento del magnete e di provocare un'infezione del paziente.
Studi su cadaveri hanno dimostrato che c'è rischio che l'impianto possa spostarsi dal dispositivo interno in uno scanner MRI da 1,5 T. Tuttavia, il rischio potrebbe essere eliminato se viene applicata una medicazione di compressione. Tuttavia, l'IC produce un artefatto che potrebbe potenzialmente ridurre il valore diagnostico della scansione. La dimensione dell'artefatto aumenta con le dimensioni della testa del paziente e questo potrebbe essere particolarmente problematico per le scansioni MRI con i bambini. Un recente studio di Crane et al., 2010 ha scoperto che l'artefatto intorno all'area dell'IC ha una dimensione media anteriore-posteriore di 6,6 +/- 1,5 cm (media +/- deviazione standard) e una dimensione sinistra-destra media di 4,8 +/- 1,0 cm (media +/- deviazione standard) (Crane et al., 2010) [23].
Impianti Vestibolari
[modifica | modifica sorgente]Introduzione
[modifica | modifica sorgente]

Le persone con sistemi vestibolari danneggiati sono affette da una combinazione di sintomi che possono includere disturbi dell'udito e della vista, vertigini, capogiri e disorientamento spaziale. Attualmente, non ci sono trattamenti efficaci per i pazienti con sistemi vestibolari deboli o danneggiati. Nell'ultimo decennio, gli scienziati hanno sviluppato un dispositivo di stimolazione elettrica, simile agli impianti cocleari, che ripristinerebbe la funzione del canale semicircolare. Gli impianti vestibolari sono destinati a ripristinare l'equilibrio nei pazienti con sistema vestibolare danneggiato. La figura[24] mostra un prototipo di impianto vestibolare, che è un impianto cocleare modificato progettato da MED-EL (Innsbruck, Austria). Questo prototipo di neuroprotesi vestibolare contiene quattro componenti principali: uno stimolatore elettrico, tre elettrodi extracocleari che sono posti nelle ampolle di ogni canale semicircolare, e un array intracocleare. Quando l'impianto vestibolare è acceso, treni di stimolazione elettrica sotto forma di impulsi bifasici con carica bilanciata sono mandati lungo ogni elettrodo extracocleare verso rispettivi nervi vestibolari [24]. In definitiva, la stimolazione elettrica ripristina l'equilibrio del paziente stabilizzando lo sguardo attraverso il riflesso vestibolo-oculare (RVO). I progressi fatti in vista di una protesi impiantabile hanno mostrato risultati promettenti per ripristinare efficacemente la normale trasduzione sensoriale vestibolare delle rotazioni della testa. Tuttavia, il raggiungimento di un accurato paradigma di stimolazione per codificare cronicamente i movimenti tridimensionali della testa senza causare attività neuronale indesiderata rimane una delle numerose sfide chiave.
Evoluzione delle Protesi Vestibolari (1963-2014)
[modifica | modifica sorgente]Nel 1963, Cohen e Suzuki [25] introdussero la nozione di protesi vestibolare dimostrando che i movimenti oculari possono essere indotti attraverso la stimolazione elettrica del ramo ampollare di un nervo vestibolare. Gli studi che seguirono spinsero a progettare un modello di stimolazione continua e accurata per riabilitare pazienti con diversi tipi di disturbi vestibolari, come la perdita bilaterale della funzione vestibolare e la malattia di Ménière [24] [26]. Quattro decenni dopo il lavoro pionieristico di Cohen e Sukui, Merfeld e colleghi svilupparono il primo dispositivo vestibolare per generare movimenti oculari regolari stimolando elettricamente il nervo vestibolare [27] [28]. La fattibilità dei dispositivi vestibolari neuroelettronici ispirò ulteriormente i ricercatori a integrare un sistema di rilevazione del movimento per misurare i movimenti della testa. Santina e colleghi [29] [30] [31] [32] hanno utilizzato sensori giroscopici per misurare i movimenti nello spazio tridimensionale e hanno codificato queste informazioni per generare segnali che controllano i muscoli di ciascun occhio attraverso il nervo vestibolare. Alla fine del 2012, solo due gruppi al mondo avevano condotto studi con impianto vestibolare sugli esseri umani: un team guidato da Jay Rubinstein presso l'Università di Washington e un lavoro congiunto tra un team guidato da Herman Kingma presso la Maastrict University of Medical Center nei Paesi Bassi e un secondo gruppo guidato da Jean-Phillippe Guyot presso Hopitaux Universitaries de Geneve, Svizzera [24]. Jay Rubinstein ha condotto il primo studio clinico vestibolare nel 2010. Rubinstein e colleghi avevano installato con successo un pacemaker vestibolare per ridurre o cessare gli attacchi di vertigine involontaria in pazienti con diagnosi di malattia di Ménière [26]. Questo dispositivo era combinato con un controller portatile per avviare e fermare una serie di stimoli elettrici che possono essere diretti a qualsiasi o a tutti gli elettrodi, ma senza codifica del movimento [26]. Sfortunatamente, nei pazienti dove è stato impiantato, il pacemaker vestibolare aveva portato a un notevole deterioramento della funzione uditiva e vestibolare [33] [26] [24]. Il gruppo ha intrapreso quindi una nuova strada per esplorare un diverso paradigma di stimolazione elettrica incorporando informazioni sul movimento [33]. Il secondo tentativo di studi clinici sull'uomo è stato effettuato da Kingma, Guyot e colleghi nel 2012. Gli impianti vestibolari utilizzati in questo studio sono stati prototipati da MED-EL. Perez-Fornos e colleghi [24] hanno dimostrato che i pazienti hanno raggiunto un livello di recupero funzionale soddisfacente che permette loro di esercitare attività quotidiane come camminare. I progressi attuali vengono fatti attraverso collaborazioni attuali tra università e industria. Ci sono quattro importanti collaborazioni universitarie e/o industriali che stanno lavorando a una protesi vestibolare per applicazioni cliniche. Queste includono: Rubinstein all'Università di Washington e Cochlear Ltd (Lane Cove, Australia), il team di Della Santina al Vestibular NeuroEngineering Laboratory [Johns Hopkins School of Medicine, Baltimora, MD, USA], il team di Daniel Merfeld al Jenks Vestibular Physiology Laboratory di Harvard [Massachusetts Eye and Ear Infirmary, Boston, MA, USA], e una collaborazione tra Herman Kingma, Jean-Philippe Guyot, e MED-EL.
Direzioni Future in Ricerca
[modifica | modifica sorgente]La tecnologia più all'avanguardia negli impianti vestibolari è un sistema a due fasi che produce stimolazioni elettriche a tre nervi ampollari in risposta a rotazioni intorno a un rispettivo asse (canali anteriori, posteriori o orizzontali). Tuttavia, la biofisica della stimolazione nervosa dalla protesi pone ancora un limite per imitare la normale trasduzione sensoriale. Anche se si sa già molto su come le afferenze del nervo vestibolare codificano i movimenti della testa, non si è ancora capito come progettare una strategia di codifica dello stimolo non invasiva per una protesi multicanale. La ricerca si attualmente muovendo verso il superamento dei limiti del design e della trasduzione del segnale.
Le attuali protesi neurali sono destinate ad eccitare i tessuti neurali in cui sono impiantate, ma l'effetto delle stimolazioni eccitatorie continue può ancora causare deficit neurologici [26]. In definitiva, sarebbe ideale avere un dispositivo che può sia eccitare il movimento della testa in una direzione che inibire il movimento nella direzione opposta. L'ultimo prototipo di un sistema del genere sviluppato da Santina e colleghi, chiamato SCSD1, ha dimostrato che le stimolazioni di corrente continua possono evocare risposte eccitatorie e inibitorie del RVO [34]. I loro risultati dimostrano che affiancare il sistema vestibolare a una baseline artificiale può eventualmente alterare le gamme dinamiche delle soglie eccitatorie e inibitorie in modi imprevisti. D'altra parte, gli studi clinici mostrano che è possibile per gli esseri umani adattarsi in un tempo ragionevolmente breve (pochi minuti) all'assenza e alla presenza di attività neurale artificiale [35]. Una volta raggiunto l'adattamento, allora si può sintonizzare l'ampiezza e le modulazioni di frequenza della stimolazione per suscitare movimenti oculari fluidi di diverse velocità e direzioni [35].
Un altro tipo di limitazione nel design delle protesi elettriche riguarda la corrente che si diffonde lontano dal tessuto nervoso bersagliato e che causa stimolazioni nel canale sbagliato [36] [37]. Di conseguenza, questa diffusione di corrente induce un disallineamento tra l'asse dell'occhio e la rotazione della testa [38]. Pertanto, i meccanismi alla base della plasticità neurale direzionale possono fornire risposte di segnale ben calibrate per gli esseri umani. Altri studi suggeriscono che la stimolazione nervosa a infrarossi è vantaggiosa per bersagliare neuroni specifici e meno invasiva per le popolazioni di neuroni vicini [36] [38]. L'ottica permetterebbe una maggiore selettività spaziale e un migliore accesso chirurgico [36].
Inoltre, una delle difficoltà fondamentali alla base dello sviluppo di protesi vestibolari è tenere di conto dei modi in cui le informazioni provenienti dagli organi terminali vestibolari possono suscitare movimenti particolari. È stato dimostrato che le risposte riflesse e percettive dipendono da quali input afferenti vestibolari sono stimolati [33]. Le pratiche chirurgiche controllano il posizionamento accurato dell'elettrodo rispetto alle afferenze, il che è noto poter influenzare notevolmente la capacità di stimolare una risposta desiderata.
Poiché le aree uditive e vestibolari dell'orecchio interno sono collegate, la diffusione della corrente oltre i nervi ampollari di destinazione e/o i rischi della chirurgia potrebbero interferire con l'attività dei nervi cocleari. È probabile che pazienti con impianti potrebbero avere un rischio di perdita dell'udito, come osservato nelle scimmie rhesus [39]. Santina e colleghi [39] hanno scoperto che l'impianto di elettrodi ha causato fino a 14 dB di perdita dell'udito e che la stimolazione elettrica ha ulteriormente ridotto l'udito di 0,4-7,8 dB. Questo studio suggerisce che la diffusione della corrente alle cellule ciliate cocleari può causare attività casuali nelle regioni cocleari vicine.
Impianti Olfattivi
[modifica | modifica sorgente]
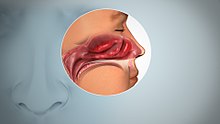
L'anosmia (perdita dell'olfatto) appare in circa il 5% della popolazione generale. Un sistema olfattivo intatto è una parte fondamentale della percezione del sapore nel bere e nel mangiare. La maggior parte dei problemi che presentano una perdita di gusto derivano da un disturbo olfattivo. Inoltre, la ricezione dell'odore è fondamentale per la qualità della nostra vita. Molte esperienze, come una doccia primaverile, fiori freschi o il profumo di casa contribuiscono alla percezione di qualsiasi evento, anche se sono difficili da descrivere. Mentre le cause infiammatorie della perdita dell'olfatto possono essere risolte con l'uso di steroidi topici e sistemici, molti trattamenti per altre cause comuni di anosmia, tra cui l'infezione respiratoria superiore (URI), il trauma cranico e l'invecchiamento non si sono dimostrati efficaci.
Prova di Praticità
[modifica | modifica sorgente]Uno studio di Eric H. Holbrook, Sidharth V. Puram e altri è stato fatto per determinare la possibilità di indurre il senso dell'odore attraverso la stimolazione elettrica artificiale dei bulbi olfattivi negli esseri umani. Sono stati registrati cinque soggetti (età, 43-72 anni). Tre soggetti hanno riportato di aver percepito odori con la stimolazione elettrica. Tutti i soggetti hanno tollerato lo studio con un disagio minimo. I soggetti del test erano tutti in grado di percepire l'odore, il che è stato confermato con un test di identificazione scratch-and-sniff, disponibile in commercio, composto da 40 elementi. Sotto guida endoscopica e senza anestetico topico, un elettrodo monopolare o bipolare è stato posizionato in 3 aree lungo la lamella laterale della piastra cribrosa alla giunzione con la base del cranio: (1) l'etmoide anteriore posteriore all'apertura del seno frontale; (2) l'etmoide posteriore anteriore alla faccia sfenoidale; e (3) l'etmoide medio approssimato dalla metà della distanza tra i punti anteriore e posteriore[40]. Durante 0,2-0,3ms, gli impianti sono stati stimolati con una gamma di intensità da 1 a 20 mA. Tre (3) dei 5 soggetti hanno riferito di sentire dell'odore, ma non potevano affermare chiaramente a cosa assomigliasse questo odore e ci sono state differenze tra soggetti. La percezione dell'odore non è cambiata in modo significativo in fatto di diverse intensità o posizione degli elettrodi, ma sono state riportate piccole deviazioni descritte come "dolce", "aspro" o "cattivo". Non ci sono state differenze tra elettrodi monopolari o bipolari. L'odore percepito è stato descritto come "simile alla cipolla", "antisettico" o "acido", e "fruttato" o "cattivo". Quando è stato chiesto di classificare l'intensità dell'odore percepita su una scala da 1 a 10, il risultato è variato da 2 a 4. Tutti i soggetti hanno anche sperimentato un certo disagio con i dispositivi, descritto come una sensazione di pulsazione, formicolio, o pulsazione situato all'elettrodo di riferimento, al canthus interno dell'occhio o al ponte del naso, alla punta del naso, o in un caso anche locato in profondità dietro l'occhio. Gli elettrodi posizionati nella fessura olfattiva hanno causato starnuti o disagio in quattro dei soggetti e nell'unico che lo ha tollerato non si è avuta alcuna percezione dell'odore. In conclusione, lo studio ha ottenuto per la prima volta la percezione dell'odore con la stimolazione elettrica del bulbo olfattivo. Gli autori hanno intenzione di esplorare ulteriormente l'uso di tali impianti, affermando: "Il lavoro futuro estenderà le sperimentazioni ad includere soggetti senza senso dell'olfatto e a sviluppare misure oggettive più coerenti della percezione olfattiva". Questo studio è stato inteso solo come una prova di concetto per la ricerca futura sulla possibilità di ripristinare l'olfatto post perdita olfattiva con la tecnologia di stimolazione elettrica[41].
Rilevamento Elettronico degli Odori
[modifica | modifica sorgente]Al giorno d'oggi gli odori possono essere misurati elettronicamente in una quantità enorme di modi diversi, alcuni esempi sono: spettrografia di massa, gascromatografia, spettri raman e più recentemente nasi elettronici. In generale si suppone che diversi recettori olfattivi abbiano diverse affinità con specifiche proprietà fisico-chimiche molecolari, e che la diversa attivazione di questi recettori dia origine a un modello spazio-temporale di attività che riflette gli odori.
Naso Elettronico
[modifica | modifica sorgente]
Gli e-nasi sono dispositivi artificiali di rilevamento degli odori basati su una matrice di chemosensori e sul riconoscimento di modelli. Sono usati per identificare e quantificare le sostanze disciolte nell'aria (o altre sostanze portanti). Un naso elettronico consiste in un dispositivo di campionamento (analogo al naso), un array di sensori (analogo ai neuroni del recettore olfattivo) e un'unità di calcolo (analogo al cervello).
Array di Sensori
[modifica | modifica sorgente]Come nei nasi animali, è solito usare sensori aspecifici. Questo non è solo dovuto al fatto che è molto difficile trovare sensori molto specifici, ma si vuole anche coprire una vasta gamma di possibili composti senza avere necessariamente un sensore per ognuno di essi. Inoltre avere più di un sensore risulta in un'elaborazione di informazioni più robusta, precisa ed efficiente. Tali sensori sono caratterizzati da un cambiamento nelle loro proprietà elettriche (ad esempio una maggiore resistenza) quando entrano in contatto con un composto. Questa alterazione porta a un cambiamento di tensione che viene digitalizzato (convertitore AD).
I tipi di sensori più frequentemente usati includono i semiconduttori ad ossido di metallo (MOS), le microbilance a cristallo di quarzo (QCM), i polimeri conduttori (PC) e i sensori ad onda acustica superficiale (SAW). Un'altra tecnologia promettente è quella dei nasi bioelettronici che usano le proteine come sensori. È anche possibile utilizzare una combinazione di diversi sensori per ottenere un risultato più preciso e per combinare i vantaggi di diversi tipi di sensori, ad esempio una migliore reattività temporale contro una migliore sensibilità.
Esempio: Principio di Funzionamento di un Sensore Polimerico Conduttivo
[modifica | modifica sorgente]Un sensore a polimeri conduttori consiste in una serie di circa 2-40 diversi polimeri conduttori (lunghe catene di molecole organiche). Alcune molecole odorose permeano nel film polimerico e causano l'espansione del film aumentando così la sua resistenza. Questo aumento della resistenza in molti tipi di polimeri può essere spiegato attraverso la teoria della percolazione.[42]. A causa delle proprietà chimiche dei materiali, polimeri diversi reagiscono in modo diverso allo stesso odore.
Computazione
[modifica | modifica sorgente]Il segnale del sensore deve essere abbinato a una miscela odorante con un algoritmo di riconoscimento dei modelli. È possibile creare un database di potenziali combinazioni e trovare la migliore corrispondenza con metodi statistici multivariati quando viene presentato un odore; alternativamente, una rete neurale può essere allenata a riconoscere i modelli. Spesso si usa anche l'analisi delle componenti principali per ridurre la dimensionalità dei dati del sensore.
Applicazioni
[modifica | modifica sorgente]Ci sono molte applicazioni per i nasi elettronici. Sono usati nel settore aerospaziale e in altre industrie per rilevare e monitorare sostanze pericolose o nocive e per il controllo della qualità. Possibili applicazioni nella sicurezza sono il rilevamento di droghe o esplosivi. Gli e-nasi potrebbero un giorno essere in grado di sostituire i cani della polizia. Un'applicazione molto potente potrebbe essere la diagnosi di malattie che alterano la composizione chimica del respiro o l'odore delle escrezioni o del sangue, sostituendo così potenzialmente le tecniche diagnostiche invasive. Può anche essere impiegato per diagnosticare il cancro, poiché alcune cellule cancerose possono essere identificate dal loro profilo di composti organici volatili. La diagnosi del cancro tramite l'olfatto è già stata trovata funzionante studi con cani e mosche ,[43] ma metodi pratici adatti dotati di alta sensibilità e specificità sono ancora in fase di sviluppo. Un'altra applicazione medica è il trattamento dell'anosmia (incapacità di percepire gli odori) tramite un impianto olfattivo sulla base di un naso elettronico. Anche questo è ancora in fase di sviluppo. Allo stesso tempo, gli e-nasi sono già in uso per il monitoraggio e la protezione dell'ambiente. Nella robotica, gli e-nasi potrebbero essere usati per seguire gli odori trasportati dall'aria o gli odori sul terreno. Specialmente per la robotica sarebbe molto interessante avere una migliore comprensione del sistema olfattivo dell'insetto, dal momento che, al fine di utilizzare l'odore per navigare o per localizzare le fonti di odore, si dovrebbero usare informazioni di stimolo temporale, spesso trascurate.
Gli insetti possono seguire gli odori in quanto possono reagire ai cambiamenti entro circa 150 millisecondi, e alcuni dei loro recettori sono in grado di raffigurare rapidi cambiamenti di concentrazione dell'odore che si verificano in frequenze superiori ad almeno 10 Hz. Al contrario, i polimeri conduttori così come gli e-nasi di ossido di metallo hanno tempi di risposta nell'intervallo da secondi a minuti [42] con solo poche eccezioni riportate nell'intervallo di decine di millisecondi.
Fotostimolazione di Neuroni
[modifica | modifica sorgente]La fotostimolazione dei neuroni è un campo di ricerca emergente. La stimolazione di neuroni si ottiene facendo brillare una fonte di luce focalizzata sulla cellula nervosa, provocandone la depolarizzazione. Ci sono due modi principali per raggiungere questo obiettivo: irradiare i neuroni con un laser, inducendo un gradiente di temperatura locale; e introdurre canali o recettori sensibili alla luce nella cellula nervosa rendendola sensibile alla luce, simile ai bastoncelli e ai coni nella retina umana. I vantaggi rispetto alla stimolazione elettrica tradizionalmente usata sono una maggiore precisione e un minore o nessun trauma dei tessuti [44].
Stimolazione Elettrica vs. Ottica
[modifica | modifica sorgente]La stimolazione elettrica ha delle limitazioni intrinseche rispetto alla stimolazione ottica. Per provocare una stimolazione affidabile, gli elettrodi devono essere in contatto fisico o in prossimità del tessuto interessato. L'introduzione di elettrodi nel tessuto nervoso danneggia il tessuto stesso e quello circostante. In molti casi l'array di elettrodi viene introdotto nel tessuto elettricamente conduttivo permettendo la diffusione della corrente, diminuendo ulteriormente la risoluzione spaziale che può essere raggiunta. La misurazione dell'attività neurale evocata è spesso contaminata da artefatti di stimolazione molto più grandi dell'attività neurale misurata. Questo è soprattutto il caso nelle misurazioni vicino al sito di eccitazione. Al contrario, la stimolazione ottica può raggiungere in modo affidabile l'eccitazione di singole cellule o piccole popolazioni di cellule. Non richiede il contatto diretto con il tessuto bersaglio, riducendo i danni ai tessuti. Infine le registrazioni elettriche della risposta neurale nelle immediate vicinanze non sono contaminate dallo stimolo di eccitazione [44] [45] [46]. Anche se la stimolazione elettrica soffre degli svantaggi descritti sopra, rimane comunque il metodo più consolidato e affidabile per la stimolazione nervosa nei pazienti.
Stimolazione a Infrarossi
[modifica | modifica sorgente]La stimolazione a infrarossi (IR) si basa su un laser a infrarossi che induce un gradiente di temperatura locale all'interno del neurone. Non richiede alcuna modifica delle cellule prima della stimolazione. Il laser a bassa energia non causa danni al tessuto e provoca una stimolazione senza artefatti. I meccanismi esatti che portano alla scarica neuronale non sono noti. Tuttavia gli studi hanno dimostrato che questo fenomeno è molto probabilmente dovuto a processi fototermici locali. L'irradiazione IR crea un gradiente di temperatura confinato in un piccolo spazio che svanisce rapidamente dopo la cessazione dell'irradiazione. Si pensa che l'aumento locale della temperatura fino a 9°C causi dei cambiamenti conformazionali nelle molecole che portano alla stimolazione dei neuroni. Ad alte frequenze di irradiazione il calore diventa additivo, causando il riscaldamento graduale del tessuto irradiato e danneggiando infine la cellula [45][46].
Optogenetica
[modifica | modifica sorgente]L'optogenetica consiste nella sensibilizzazione delle cellule alla luce attraverso l'introduzione di geni estranei, permettendo un'alterazione ad alta risoluzione temporale e spaziale dei modelli di sparo neurali. I geni possono essere espressi nella modifica genetica degli animali o essere introdotti da vettori come i virus. La maggior parte dei geni sensibili alla luce usati oggi sono stati scoperti per la prima volta in organismi unicellulari come alghe o archei. Questi geni possono codificare canali ionici sensibili alla luce o recettori che producono varie risposte alla stimolazione ottica. Per l'attivazione neuronale sono comunemente usate le Channelrhodopsins (ChR) naturali o varianti genetiche ingegnerizzate. Le ChR sono canali cationici non specifici sensibili alla luce, che si aprono quando vengono eccitati dalla luce blu (480nm). Nelle cellule nervose l'apertura dei ChR porta all'afflusso di sodio e alla depolarizzazione della membrana [47] [48]. Il componente sensibile alla luce è un retinale tutto-trans che si trova anche nella retina umana. La luce induce un cambiamento conformazionale del retinale a una forma 13-cis permettendo ai cationi di fluire attraverso il canale [47][48][49][50]. L'introduzione di specifiche mutazioni puntiformi vicino al sito di legame del retinale può alterare le proprietà cinetiche e la specificità del canale [51]. Il collegamento di ChR ad altre proteine permette di ottenere strumenti con funzionalità diverse come il monitoraggio in vivo dei costrutti introdotti [52].
Le alorodopsine (HR) sono pompe ioniche di cloruro controllate dalla luce utilizzate per l'inibizione neuronale attivata dalla luce. L'eccitazione ottica con luce gialla (570nm) nei neuroni sensibilizzati porta all'entrata di ioni cloruro e all'iperpolarizzazione [53][54]. Come nel ChR, anche la molecola sensibile alla luce è tutta retinale di tipo tutto-tran. A causa delle diverse differenze di stabilizzazione e quindi di sensibilità alla lunghezza d'onda del retinale in HR e ChR, può essere utilizzato nelle stesse cellule e mirato separatamente. Questo permette un controllo molto preciso dell'attività nei circuiti neurali [54][55].
Per il controllo ottico delle vie cellulari sono state sviluppate le proteine Opto-XR, [56] dove la X sta per la via di segnalazione mirata. Le Opto-XR consistono in una rodopsina animale (bovina, di ratto ecc.), con i suoi domini intracellulari scambiati con sequenze di segnalazione della cellula [57]. Questo permette la regolazione ottica del percorso di segnalazione delle cellule. Le sequenze di segnalazione possono essere attivate o disattivate dai cambiamenti conformazionali indotti dalla luce che cade sulla rodopsina. Questo permette l'attivazione specifica di certe vie recettoriali come la segnalazione di serotonina o di adrenergici [56][58].
Stimolazione Ottica in Neuroprotesi
[modifica | modifica sorgente]La stimolazione elettrica è stata a lungo utilizzata per evocare la stimolazione di nervi nelle protesi neuronali. Tuttavia, la diffusione della corrente elettrica e la generazione di campi elettrici limitano la risoluzione spaziale che si può ottenere. Questo limita la fedeltà del segnale trasmesso [59]. Nel caso di protesi uditive, è possibile usare un massimo di una ventina di elettrodi, incidendo molto nella qualità del suono ottenuta. Un passaggio a tecnologie basate sull'ottica potrebbe fornire la stimolazione di aree più piccole, aumentando la quantità di toni potenzialmente percepiti. Recenti sviluppi nelle tecniche di stimolazione ottica rassicurano di poter ottenere modi per superare questi ostacoli e migliorare i dispositivi protesici e la qualità della vita dei pazienti.
Impianti Cocleari
[modifica | modifica sorgente]La stimolazione a infrarossi della coclea e del nervo uditivo sono stati testati in vari modelli animali come roditori e gatti. La variante ottica mostra una notevole precisione per quanto riguarda l'area stimolata dal laser, che è approssimativamente della stessa dimensione di quella attivata da un tono di media intensità. È stato inoltre dimostrato che utilizzando l'irradiazione IR a bassa energia, è possibile ottenere una stimolazione costante senza un graduale riscaldamento e danneggiamento del tessuto. Questo permette l'utilizzo dell'impianto per tutto il giorno senza danneggiare il sistema cocleare. Uno dei principali svantaggi della stimolazione IR è un consumo di energia molto più elevato rispetto alla stimolazione elettrica [45].
Per superare il problema energetico descritto, i ricercatori hanno iniziato a testare un approccio optogenetico nei roditori. Topi sono stati ingegnerizzati geneticamente per esprimere ChR nei neuroni del ganglio spinale. La sensibilizzazione delle cellule nervose ha ridotto l'energia necessaria per indurre la stimolazione rispetto all'irradiazione IR di sette volte (IR: 15 μJ, Optogen.: 2 μJ, Electric: 0.2 μJ). La stimolazione è stata quindi possibile utilizzando micro-LEDs invece di laser. Nonostante questi progressi, l'implementazione di questa tecnologia negli esseri umani nel prossimo futuro è discutibile. Ciò è dovuto principalmente ai possibili pericoli dell'introduzione di materiale genetico virale. Finora solo poche terapie geniche sono state approvate. Bisognerebbe implementare e approvare un modo sicuro ma comunque efficace di infettare specificamente gli organi cocleari [60].
Sono stati registrati i primi brevetti che descrivono potenziali impianti cocleari ottici per gli esseri umani. Questi impianti funzionano in modo simile ai tradizionali impianti elettrici, ma al posto degli elettrodi hanno dei VCSEL (vertical-cavity surface-emitting laser) che sono pilotati dal dispositivo di comando dell'impianto. I VCSEL sono diodi che emettono laser che possono essere inseriti nei piccoli tubi dell'impianto. I laser sono diretti all'organo di Corti e possono essere molto più distanziati degli elettrodi, più che raddoppiando la quantità di canali di uscita dell'impianto. I diodi laser sono usati per segnalazioni di maggiore ampiezza, mentre gli elettrodi stimolano cellule nervose di minore ampiezza [61].
Protesi Vestibolari
[modifica | modifica sorgente]Le protesi vestibolari mirano a ripristinare i problemi di squilibrio derivanti dalla disfunzione del sistema vestibolare. Poiché i canali semicircolari sono interconnessi, la diffusione della corrente è un problema importante nella propagazione dello stimolo elettrico. La diffusione della corrente può portare alla stimolazione dei canali semicircolari indesiderati, con conseguenti segnali di equilibrio errati inviati al cervello. È stata studiata la possibilità di utilizzare l'irradiazione IR, dove però è stato visto che l'irradiazione delle ampolle non ha evocato potenziali d'azione. La ragione del fallimento della stimolazione potrebbe risiedere in un'insensibilità delle cellule ciliate all'irradiazione IR. Tuttavia, la stimolazione ottica del nervo vestibolare potrebbe essere una possibilità. Non è ancora chiaro se la stimolazione separata dei nervi da diverse ampolle potrebbe essere possibile in questo modo [45][62].
Bibliografia
[modifica | modifica sorgente]- ↑ Larry Squire, et al, Fundamental Neuroscience 4th edition, 2012.
- ↑ 2,0 2,1 2,2 Lan Yue, James D. Weiland, Botond Roska, Mark S. Humayun, Retinal stimulation strategies to restore vision: Fundamentals and Systems, 2016.
- ↑ Jackson, G.R., Owsley, C., Curcio, C.A, Photoreceptor degeneration and dysfunction in aging and age-related maculopathy., 2002.
- ↑ Shigeru Sato, Yoshihiro Omori, et al, Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation, 2008.
- ↑ Jost B. Jonas, UlrikeSchneider, Gottfried O.H. Naumann, Count and density of human retinal photoreceptors, 1992.
- ↑ Ashmore Jonathan, Cochlear Outer Hair Cell Motility, 2008.
- ↑ 7,0 7,1 7,2 Chris Sekirnjak, PawelHottowy, Alexander Sher, Wladyslaw Dabrowski, Alan M. Litke, E.J. Chichilnisky, High-Resolution Electrical Stimulation of Primate Retina for Epiretinal Implant Design, 2008.
- ↑ Jong-Mo Seo, et al, Biocompatibility of polyimide microelectrode array for retinal stimulation, 2004.
- ↑ Eui Tae Kim, et al, Feasibility of Microelectrode Array (MEA) Based on Silicone-Polyimide hybrid for retina prosthesis, 2009.
- ↑ 10,0 10,1 Eui Ta Eberhart Zrenner, KarlUlrich Bartz-Schmidt, Heval Benav, Dorothea Besch, Anna Bruckmann, Veit-Peter Gabel, Florian Gekeler, Udo Greppmaier, Alex Harscher, Steffen Kibbel, Johannes Koch, Akos Kusnyerik, tobias Peters, Katarina Stingl, Helmut Sachs et al.e Kim, et al, Subretinal electronic chips allow blind patients to read letters and combine them to words, 2010.
- ↑ Pritchard Roy, Stabilized Images on the Retina.
- ↑ Asaf Shoval, ChrisopherAdams, Moshe David-Pur, Mark Shein, Yael Hanein, Evelyne Sernagor, Carbon nanotube electrodes for effective interfacing with retinal tissue, 2009.
- ↑ Susanne Klauke, Michael Goertz, Stefan Rein, Dirk Hoehl, Uwe Thomas, Reinhard Eckhorn, Frank Bremmer, Thomas Wachtler, Stimulation with a Wireless Intraocular Epiretinal Implant Elicits Visual Percepts in Blind Humans, 2011.
- ↑ Neville Z. Mehenti, GrehS. Tsien, Theodore Leng, Harvey A. Fishman, Stacey F. Bent, A model retinal interface based on directed neuronal growth for single cell stimulation, 2006.
- ↑ Jan Muller, et al, High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels, 2015.
- ↑ Fiscella M, et al, Recording from defined populations of retinal ganglion cells using a high-density cmos-integrated microelectrode array with real-time switchable electrode selection, 2012.
- ↑ Fiscella M, Yonehara K, Drinnenberg A, Franke F, Müller J, Roska B and Hierlemann A, Screening Transgenic Mouse Models of Human Eye Diseases with CMOS High-Density Microelectrode Arrays, 2016.
- ↑ Gaute T Einevoll, Felix Franke, Espen Hagen, Christophe Pouzat, and Kenneth D Harris, Towards reliable spike-train recordings from thousands of neurons with multielectrodes, 2012.
- ↑ http://www.utdallas.edu/~loizou/cimplants/tutorial/tutorial.htm
- ↑ www.ohsu.edu/nod/documents/week3/Rubenstein.pdf
- ↑ www.acoustics.bseeber.de/implant/ieee_talk.pdf
- ↑ T. Haslwanter, Hilbert Transformation [Python], su work.thaslwanter.at, 2012.
- ↑ Crane BT, Gottschalk B, Kraut M, Aygun N, Niparko JK (2010) Magnetic resonance imaging at 1.5 T after cochlear implantation. Otol Neurotol 31:1215-1220
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 Perez Fornos, A.; Guinand, N.; Van De Berg, R.; Stokroos, R.; Micera, S.; Kingma, H.; Pelizzone, M.; and Guyot, J., Artificial balance: restoration of the vestibulo-ocular reflex in humans with a prototype vestibular neuroprosthesis., in Frontiers in Neurology, vol. 5, 2014.
- ↑ Cohen, B. and Suzuki, J., Eye movements induced by ampullary nerve stimulation., in The American rivista of physiology, vol. 204, 1963, pp. 347-351.
- ↑ 26,0 26,1 26,2 26,3 26,4 Golub, J. S.; Ling, L.; Nie, K.; Nowack, A.; Shepherd, S. J.; Bierer, S. M.; Jameyson, E.; Kaneko, C. R.; Phillips, J. O.; and Rubinstein, J. T., Prosthetic Implantation of the Human Vestibular System., in Otology & Neurotology, vol. 1, 2014, pp. 136–147.
- ↑ Gong, W. and Merfeld, D. M., Prototype neural semicircular canal prosthesis using patterned electrical stimulation., in Annals of Biomedical Engineering, vol. 28, 2000, pp. 572-581.
- ↑ Lewis, R. F.; Haburcakova, C.; Gong, W.; Makary, C.; and Merfeld, D. M., Vestibuloocular Reflex Adaptation Investigated With Chronic Motion-Modulated Electrical Stimulation of Semicircular Canal Afferents., in Rivista of Neurophysiology, vol. 103, 2010, pp. 1066-1079.
- ↑ Dai, C.; Fridman, G. Y.; Chiang, B.; Davidovics, N.; Melvin, T.; Cullen, K. E. and Della Santina, Charles C., Cross-axis adaptation improves 3D vestibulo-ocular reflex alignment during chronic stimulation via a head-mounted multichannel vestibular prosthesis., in Experimental Brain Research, vol. 210, 2011, pp. 595-606.
- ↑ Dai, C.; Fridman, G. Y.; Davidovics, N.; Chiang, B.; Ahn, J. and Della Santina, C. C., Restoration of 3D Vestibular Sensation in Rhesus Monkeys Using a Multichannel Vestibular Prosthesis., in Hearing Research, vol. 281, 2011, pp. 74-83.
- ↑ Dai, Chenkai and Fridman, Gene Y. and Chiang, Bryce and Rahman, Mehdi A. and Ahn, Joong Ho and Davidovics, Natan S. and Della Santina, Charles C., Directional Plasticity Rapidly Improves 3D Vestibulo-Ocular Reflex Alignment in Monkeys Using a Multichannel Vestibular Prosthesis., in Rivista of the Association for Research in Otolaryngology, vol. 14, 2013, pp. 863-877.
- ↑ Davidovics, Natan S. and Rahman, Mehdi A. and Dai, Chenkai and Ahn, JoongHo and Fridman, Gene Y. and Della Santina, Charles C., Multichannel Vestibular Prosthesis Employing Modulation of Pulse Rate and Current with Alignment Precompensation Elicits Improved VOR Performance in Monkeys., in Rivista of the Association for Research in Otolaryngology, vol. 14, 2013, pp. 233-248.
- ↑ 33,0 33,1 33,2 Phillips, Christopher and DeFrancisci, Christina and Ling, Leo and Nie, Kaibao and Nowack, Amy and Phillips, James O. and Rubinstein, Jay T., Postural responses to electrical stimulation of the vestibular end organs in human subjects., in Experimental Brain Research, vol. 229, 2013, pp. 181-195.
- ↑ Fridman, Gene Y. and Della Santina, Charles C., Safe Direct Current Stimulation to Expand Capabilities of Neural Prostheses., in IEEE Trans Neural Syst Rehabil Eng., vol. 21, 2013, pp. 319-328.
- ↑ 35,0 35,1 Guyot, Jean-Philippe and Sigrist, Alain and Pelizzone, Marco and Kos, Maria I., Adaptation to steady-state electrical stimulation of the vestibular system in humans., in Annals of Otology, Rhinology & Laryngology, vol. 120, 2011, pp. 143-149.
- ↑ 36,0 36,1 36,2 Harris, David M. and Bierer, Steven M. and Wells, Jonathon D. and Phillips, James O., Optical nerve stimulation for a vestibular prosthesis., in Processing of SPIE, vol. 5, 2009.
- ↑ Della Santina, Charles C. and Migliaccio, Americo A. and Patel, Amit H., A multichannel semicircular canal neural prosthesis using electrical stimulation to restore 3-D vestibular sensation., in IEEE transactions on bio-medical engineering, vol. 54, 2007, pp. 1016-1030.
- ↑ 38,0 38,1 Lumbreras, Vicente and Bas, Esperanza and Gupta, Chhavi and Rajguru, Suhrud M., Pulsed Infrared Radiation Excites Cultured Neonatal Spiral and Vestibular Ganglion Neurons by Modulating Mitochondrial Calcium Cycling., in Rivista of Neurophysiology, 2014.
- ↑ 39,0 39,1 Dai, Chenkai and Fridman, Gene Y. and Della Santina, Charles C., Effects of vestibular prosthesis electrode implantation and stimulation on hearing in rhesus monkeys., in Hearing Research, vol. 277, 2011, pp. 204-210.
- ↑ Holbrook EH, Puram SV, See RB, Tripp AG, Nair DG., Induction of smell through transethmoid electrical stimulation of the olfactory bulb., in Int Forum Allergy Rhinol., 2019;9, 2019, pp. 158-164.
- ↑ Holbrook EH, Puram SV, See RB, Tripp AG, Nair DG., Induction of smell through transethmoid electrical stimulation of the olfactory bulb., in Int Forum Allergy Rhinol., 2019;9, 2019, pp. 158-164.
- ↑ 42,0 42,1 K. Arshak, E. Moore, G.M. Lyons, J. Harris e Clifford, A review of gas sensors employed in electronic nose applications, in Sensor Review, vol. 24, n. 2, June 2004, pp. 181–198, DOI:10.1108/02602280410525977.
- ↑ Martin Strauch e Alja Lüdke, More than apples and oranges - Detecting cancer with a fruit fly's antenna, in Scientific Reports, vol. 4, 6 January 2014, DOI:10.1038/srep03576.
- ↑ 44,0 44,1 Stephanie Szobota e Ehud Y Isacoff, Optical control of neuronal activity., in Annual review of biophysics, vol. 39, 2010, pp. 329-348.
- ↑ 45,0 45,1 45,2 45,3 Claus-Peter Richter, Agnella Izzo Matic, Jonathon D Wells, E Duco Jansen e Joseph T Walsh, Neural stimulation with optical radiation., in Laser & photonics reviews, vol. 5, n. 1, 2011, pp. 68-80.
- ↑ 46,0 46,1 Jonathon D Wells, Jonathan M Cayce, Anita Mahadevan-jansen, Peter E Konrad e E Duco Jansen, Optical-Thermal Response of Laser-Irradiated Tissue, 2011, pp. 915-939.
- ↑ 47,0 47,1 Peter Berthold, Satoshi P Tsunoda, Oliver P Ernst, Wolfgang Mages, Dietrich Gradmann e Peter Hegemann, Channelrhodopsin-1 initiates phototaxis and photophobic responses in chlamydomonas by immediate light-induced depolarization., in The Plant cell, vol. 20, n. 6, 2008, pp. 1665-1677.
- ↑ 48,0 48,1 Georg Nagel, Tanjef Szellas, Wolfram Huhn, Suneel Kateriya, Nona Adeishvili, Peter Berthold, Doris Ollig, Peter Hegemann e Ernst Bamberg, Channelrhodopsin-2, a directly light-gated cation-selective membrane channel, in Proceedings of the National Academy of Sciences, vol. 100, n. 24, 2003, pp. 13940-13945.
- ↑ Christian Bamann, Taryn Kirsch, Georg Nagel e Ernst Bamberg, Spectral characteristics of the photocycle of channelrhodopsin-2 and its implication for channel function., in Rivista of Molecular Biology, vol. 375, n. 3, 2008, pp. 686-694.
- ↑ Oliver P Ernst, Pedro a Sánchez Murcia, Peter Daldrop, Satoshi P Tsunoda, Suneel Kateriya e Peter Hegemann, Photoactivation of channelrhodopsin., in The Rivista of Biological Chemistry, vol. 283, n. 3, 2008, pp. 1637-1643.
- ↑ Lisa Gunaydin, Ofer Yizhar, André Berndt, Vikaas S Sohal, Karl Deisseroth e Peter Hegemann, Ultrafast optogenetic control., in Nature neuroscience, vol. 13, n. 3, 2010, pp. 387-392.
- ↑ John Y Lin, Michael Z Lin, Paul Steinbach e Roger Y Tsien, Characterization of engineered channelrhodopsin variants with improved properties and kinetics., in Biophysical rivista, vol. 96, n. 5, 2009, pp. 1803-1814.
- ↑ A Duschl, JK Lanyi e L Zimanyi, Properties and photochemistry of a halorhodopsin from the haloalkalophile, Natronobacterium pharaonis., in Rivista of Biological Chemistry, vol. 265, 1990, pp. 1261-1267.
- ↑ 54,0 54,1 Zhang, Feng, Wang, Li-Ping, Brauner, Martin, Liewald, Jana F, Kay, Kenneth, Watzke, Natalie, Wood, Phillip G, Bamberg, Ernst, Nagel, Georg, Gottschalk, Alexander e Deisseroth, Karl, Multimodal fast optical interrogation of neural circuitry., in Nature, vol. 446, n. 7136, 2007, pp. 633-639.
- ↑ Xue Han e Edward S Boyden, Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution., in Plos one, vol. 2, n. 3, 2007, pp. e299.
- ↑ 56,0 56,1 Jong-myoung Kim, John Hwa, Pere Garriga, Philip J Reeves, Uttam L Rajbhandary e H Gobind Khorana, Light-Driven Activation of 2 -Adrenergic Receptor Signaling by a Chimeric Rhodopsin Containing the 2 -Adrenergic Receptor Cytoplasmic Loops, in Biochemistry, vol. 44, n. 7, 2005, pp. 2284-2292.
- ↑ Raag D Airan, Kimberly R Thompson, Lief E Fenno, Hannah Bernstein e Karl Deisseroth, Temporally precise in vivo control of intracellular signalling., in Nature, vol. 458, n. 7241, 2009, pp. 1025-1029.
- ↑ Eugene Oh, Takashi Maejima, Chen Liu, Evan Deneris e Stefan Herlitze, Substitution of 5-HT 1A Receptor Signaling by a Light-activated G Protein-coupled Receptor, in The Rivista of Biological Chemistry, vol. 285, n. 40, 2010, pp. 30825-30836.
- ↑ K C McGill, K L Cummins, L J Dorfman, B B Berlizot, K Leutkemeyer, D G Nishimura e B Widrow, On the nature and elimination of stimulus artifact in nerve signals evoked and recorded using surface electrodes., in IEEE transactions on bio-medical engineering, vol. 29, n. 2, 1982, pp. 129-137.
- ↑ VH Hernandez, Anna Gehrt, Kirsten Reuter, Zhizi Jing, Marcus Jeschke, Alejandro Mendoza Schulz, Gerhard Hoch, Matthias Bartels, Gerhard Vogt, Carolyn W. Garnham, Yawo e Fukazawa, Optogenetic stimulation of the auditory pathway, in The Rivista of Clinical Investigation, vol. 124, n. 3, 2014, pp. 1114-1129.
- ↑ James W. Stafford e Ryan C. Stafford, OPTICAL-STIMULATION COCHLEAR IMPLANT WITH ELECTRODE(S) AT THE APICAL END FOR ELECTRICAL STIMULATION OF APICAL SPIRAL GANGLION CELLS OF THE COCHLEA, A1 US patent 0023967 A1, 2013.
- ↑ DM Harris e SM Bierer, Optical nerve stimulation for a vestibular prosthesis, in Proceedings of SPIE, vol. 5, 2009, pp. 71800R.
