Impianti chimici/Operazioni adiabatiche
Le operazioni chimiche e le loro espressioni matematiche mostrate fino ad adesso erano operazioni isoterme, ove si assume che la temperatura sia uniforme e costante nel tempo. Per ottenere tale condizione è che il sistema abbia uno scambio termico infinito, che riesca a smaltire tutto il calore generato dalla reazione. Nella pratica, le condizioni isoterme sono di difficile ottenimento, nonché anti-economiche.
Si preferisce, soprattutto nelle reazioni esotermiche, di limitare lo scambio termico. Questo ha come conseguenza che:
- il calore di reazione riscalda la miscela reagente e si ha un aumento della velocità di reazione soprattutto alle alte conversioni, ove normalmente questa è molto bassa. Il volume del reattore sarà inferiore;
- permette di partire da temperature iniziali di reazioni inferiori, con risparmio di energia per il preriscaldamento dei reagenti.
Il bilancio di calore intorno ad un reattore con scambio termico
Il primo termine è l'entalpia dei reagenti all'entrata, il secondo l'entalpia dei prodotti all'uscita e l'ultimo rappresenta il calore scambiato con un fludo termico alla temperature Te. Se il termine di scambio termico è nullo, ovvero se non ci sono scambi di calore con l'esterno, un reattore si dice adiabatico; se lo scambio è solo parziale, esso si dice poitropo.
Bilancio di materia e di energia
[modifica | modifica sorgente]Nel caso di un reattore adiabatico, i bilanci di energia e materia devono essere risolti contemporaneamente
Reattore autotermico: accensione e spegnimento
[modifica | modifica sorgente]Reattori adiabatici in serie
[modifica | modifica sorgente]Nelle reazioni reversibili la temperatura gioca sia sulla cinetica
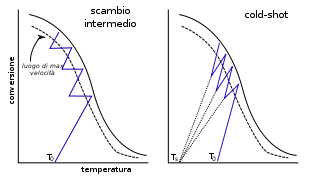 , come ad esempio la conversione SO2 + 0.5 O2 ⇔ SO3
, come ad esempio la conversione SO2 + 0.5 O2 ⇔ SO3
Reattore politropo
[modifica | modifica sorgente]Coefficiente di scambio tra il fluido e l'impaccamento
Coefficiente di scambio tra il fluido e le pareti interne in un reattore impaccato
Stabilità di un reattore politropo
[modifica | modifica sorgente]run-out



