Laboratorio di chimica in casa/Costanti di dissociazione
In questa pagina sono tabulate le costanti di dissociazione acida e basica, ed i prodotti di solubilità.
Costanti di dissociazione acida
[modifica | modifica sorgente]I nomi sono in ordine alfabetico. Le righe evidenziate sono acidi forti.
Gli ioni positivi che subiscono idrolisi sono elencati in una tabella a parte.
- Sinonimi
I seguenti acidi sono riportati in tabella con il nome a destra della freccia (per gli acidi carbossilici si è preferito usare il nome tradizionale al posto del nome IUPAC):
Cianico → Isocianico
Cianuro → Cianidrico
Dodecanoico → Laurico
Esanoico → Caproico
Eptanoico → Enantico
Fenico → Fenolo
Idrazoico → Azotidrico
Metanoico → Formico
Muriatico → Cloridrico
Ottanoico → Caprilico
Ottadecanoico → Stearico
Pentanoico → Valerico
Propanoico → Butirrico
Solfocianico → Tiocianico
Acidi deboli inorganici
[modifica | modifica sorgente]| Acido | Formula | Immagine | Ka1 | Ka2 | Ka3 | pKa1 | pKa2 | pKa3 | °C |
|---|---|---|---|---|---|---|---|---|---|
| Alluminico | HAl(OH)4 |  |
6,3·10-12 | 11,2 | 25 | ||||
| Antimonico | HSb(OH)6 |  |
2,81·10-3 | 2,55 | 25 | ||||
| Arsenico | H3AsO4 |  |
5,8·10-3 | 1.1·10-7 | 2,223 | 6,760 | 25 | ||
| Arsenioso | H3AsO3 |  |
5,1·10-10 | 9,28 | 25 | ||||
| Aurico | H3AuO3 |  |
<2·10-12 | 4,37·10-14 | <11,7 | 13,36 | 25 | ||
| Azotidrico | HN3 |  |
2,4·10-5 | 4,62 | 25 | ||||
| Borico | H3BO3 |  |
5,808·10-10 | 9,236 | 25 | ||||
| Carbonico | H2CO3 |  |
4,73·10-7 | 4,688·10-11 | 6,325 | 10,329 | 25 | ||
| Cianidrico | HCN | 6,2·10-10 | 9,21 | 25 | |||||
| Cloroso | HClO2 |  |
1,15·10-2 | 1,94 | 25 | ||||
| Cromico | H2CrO4 | 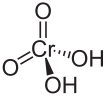 |
1,82·10-1 | 3,25·10-7 | 0,74 | 6,488 | 25 | ||
| Ditionoso | H2S2O4 |  |
4,47·10-1 | 3,54·10-3 | 0,35 | 2,45 | 25 | ||
| Fluoridrico | HF |  |
6,7·10-4 | 3,2 | 25 | ||||
| Fosforico | H3PO4 |  |
7,11·10-3 | 6,3·10-8 | 4,5·10-13 | 2,148 | 7,198 | 12,32 | 25 |
| Fosforoso | H3PO3 |  |
3,71·10-2 | 2,08·10-7 | 1,43 | 6,68 | 25 | ||
| Formico | HCHO2 |  |
1,77·10-4 | 3,751 | 25 | ||||
| Germanico | H2GeO3 |  |
9,77·10-10 | 9,01 | 25 | ||||
| Idrogenomanganato[1] | HMnO4- |  |
7,08·10-11 | 10,15 | 35 | ||||
| Idrogenosolfato[2] | HSO4- |  |
1,02·10-2 | 1,99 | 25 | ||||
| Iodico | HIO3 |  |
1,57·10-1 | 0,804 | 25 | ||||
| Ipobromoso | HBrO |  |
2,0·10-9 | 8,55 | 25 | ||||
| Ipocloroso | HClO |  |
2,9·10-8 | 7,537 | 25 | ||||
| Ipofluoroso | HOF |  |
n.d. | n.d | |||||
| Ipofosforoso | HPH2O2 |  |
5,89·10-2 | 1,23 | 25 | ||||
| Ipoiodoso | HIO |  |
3,2·10-11 | 10,5 | 25 | ||||
| Iponitroso | H2N2O2 |  |
6,1·10-8 | 3,55·10-12 | 7,21 | 11,45 | 25 | ||
| Isocianico | HNCO | 3,47·10-4 | 3,46 | 25 | |||||
| Metavanadico[3] | (HVO3)n |  |
1,6·10-4 | 3,8 | 25 | ||||
| Nitroso | HNO2 |  |
7,24·10-4 | 3,14 | 25 | ||||
| Periodico[4] | HIO4 |  |
2,29·10-2 | 1,64 | 25 | ||||
| Perossido di idrogeno | H2O2 |  |
5,62·10-12 | 11,64 | 25 | ||||
| Perossifosforico | H3PO5 |  |
7,9·10-2 | 3,2·10-6 | 1,6·10-13 | 1,1 | 5,5 | 12,8 | 25 |
| Pertecnetico | HTcO4 |  |
0,5 | 0,3 | 25 | ||||
| Pertiocarbonico | H2CS4 |  |
1,78·10-12 | n.d. | 11,75 | n.d. | 25 | ||
| Selenidrico | H2Se |  |
1,29·10-4 | 1,0·10-11 | 3,89 | 11,0 | 25 | ||
| Selenioso | H2SeO3 |  |
2,4·10-3 | 4,0·10-9 | 2,62 | 8,32 | 25 | ||
| Silicico | H4SiO4 |  |
2,5·10-10 | 1,6·10-12 | 9,6 | 11,8 | 25 | ||
| Solfidrico | H2S |  |
1,07·10-7 | 1,26·10-13 | 6,97 | 12,90 | 25 | ||
| Solforoso | H2SO3 |  |
1,2·10-2 | 6,2·10-8 | 1,89 | 7,205 | 25 | ||
| Solfammico[5] | HSO3NH2 |  |
0,1 | 0,99 | 25 | ||||
| Tellurico | H6TeO6 | 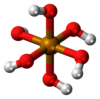 |
2,5·10-8 | 10-11 | 7,6 | 11 | 25 | ||
| Telluridrico | H2Te |  |
2,29·10-3 | 10-11/10-12 | 2,64 | 11/12 | 18 | ||
| Telluroso | H2TeO3 |  |
5,37·10-7 | 3,0·10-9 | 6,27 | 8,43 | 20 | ||
| Tetraborico | H2B4O7 |  |
~10-4 | ~10-9 | 4 | 9 | 25 | ||
| Tiocianico | HSCN |  |
1,6·10-2 | 1,8 | 25 | ||||
| Tiofosforico | H3PO3S |  |
1,629·10-2 | 3,741·10-6 | 8,32·10-11 | 1,788 | 5,427 | 10,08 | 25 |
| Tiosolforico | H2S2O3 |  |
2,5·10-1 | 2,29·10-2 | 0,6 | 1,64 | 25 | ||
| Trifluorometano | CHF3 |  |
10-25/10-28 | 25/28 | 25 | ||||
| Trimetafosforico[6] | H3P3O7 |  |
~0,1 | 2,0·10-2 | 10-2 | ~1 | 1,7 | 2,0 | 25 |
| Triselenocarbonico | H2CSe3 |  |
6,91·10-2 | 1,9·10-8 | 1,16 | 7,70 | 25 | ||
| Tritiocarbonico | H2CS3 |  |
2,09·10-3 | 6,0·10-9 | 2,68 | 8,18 | 20 | ||
| Tungstico | H2WO4 | 6,3·10-3 | 2,0·10-4 | 2,2 | 3,7 | 25 | |||
| Vanadico | H3VO5 | 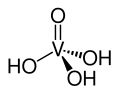 |
1,66·10-4 | 1,6·10-8 | 1,41·10-12 | 3,78 | 7,78 | 11,85 | 25 |
| Fonte: Lagrange's Handbook of Chemistry 1999 (pag ~860) | |||||||||
Versione stampabile
[modifica | modifica sorgente]Scaricare le immagini dai link proposti in didascalia (risoluzione ottimale). Le immagini sono in ordine, da sinistra a destra. Formato: Per fogli A4.
Acidi organici
[modifica | modifica sorgente]Questa parte del modulo è incompleta ed i suoi contenuti devono ancora essere inseriti ed aggiornati completamente. Attendi che l'autore la completi oppure ampliala secondo le convenzioni di Wikibooks. |
| Acido | Formula | Immagine | Ka1 | Ka2 | Ka3 | pKa | pH (1M) | ||
|---|---|---|---|---|---|---|---|---|---|
| Acetico | HC2H3O2 |  |
1,74·10-5 | 4,76 | |||||
| Acetilene | C2H2 | 25 | |||||||
| Benzoico | HC7H5O2 |  |
6,28·10-5 | 9,20 | |||||
| Butirrico | HC4H7O2 |  |
1,52·10-5 | 4,82 | |||||
| Citrico | H3C6H5O7 |  |
7,45·10-4 | 1,73·10-5 | 4,02·10-7 | 3,12 | |||
| Cloroacetico | CH2ClCOOH |  |
1,36·10-3 | ||||||
| Dicloroacetico | CHCl2COOH |  |
5,01·10-2 | ||||||
| Fenolo | C6H5OH |  |
1,00·10-10 | ||||||
| Ftalico | C6H4(COOH)2 |  |
Testo della cella | ||||||
| Fumarico | HOOCCH=CHCOOH |  |
Testo della cella | ||||||
| Glicolico | HOCH2COOH |  |
Testo della cella | ||||||
| Lattico | CH3CHOHCOOH |  |
Testo della cella | ||||||
| Maleico | HOOCCH=CHCOOH |  |
Testo della cella | ||||||
| Malico | HOOCCHOHCH2COOH |  |
Testo della cella | ||||||
| Malonico | HOOCCH2COOH |  |
Testo della cella | ||||||
| Mandelico | C6H5CHOHCOOH |  |
Testo della cella | ||||||
| Ossalico | HOOCCOOH |  |
Testo della cella | ||||||
| Picrico | (NO2)3C6H2OH |  |
Testo della cella | ||||||
| Salicilico | C6H4(OH)COOH |  |
Testo della cella | ||||||
| Succinico | HOOCCH2CH2COOH |  |
Testo della cella | ||||||
| Tartarico | HOOC(CHOH)2COOH |  |
Testo della cella | ||||||
| Tricloroacetico | Cl3CCOOH |  |
Testo della cella | ||||||
| Fonte: Handbook of chemistry ad physics 2012-13 | |||||||||
Versione stampabile
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Cationi acidi
[modifica | modifica sorgente]Questa parte del modulo è incompleta ed i suoi contenuti devono ancora essere inseriti ed aggiornati completamente. Attendi che l'autore la completi oppure ampliala secondo le convenzioni di Wikibooks. |
| Ione | Formula | Immagine | Ka | pKa |
|---|---|---|---|---|
| Ammonio | NH4+ | 5,70·10-1 | 9,25 | |
| Anilinio | C6H5NH3+ |  |
2,50·10-5 | Testo della cella |
| idrazinio | H2NNH3+ | Testo della cella | Testo della cella | Testo della cella |
| Testo della cella | Testo della cella | Testo della cella | Testo della cella | Testo della cella |
| Testo della cella | Testo della cella | Testo della cella | Testo della cella | Testo della cella |
| Testo della cella | Testo della cella | Testo della cella | Testo della cella | Testo della cella |
| Testo della cella | Testo della cella | Testo della cella | Testo della cella | Testo della cella |
| Testo della cella | Testo della cella | Testo della cella | Testo della cella | Testo della cella |
Versione stampabile
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Acidi forti
[modifica | modifica sorgente]Le seguenti costanti di dissociazione acida non si riferiscono agli acidi in soluzione acquosa, ma in specifici solventi organici.
| Acido | Formula | Immagine | Ka1 | Ka2 | pKa1 | pKa2 | °C |
|---|---|---|---|---|---|---|---|
| Bromico | HBrO3 |  |
~102 | -2 | |||
| Bromidrico | HBr |  |
~109 | -9 | |||
| Clorico | HClO3 |  |
~10 | -1 | 0 | ||
| Cloridrico | HCl | 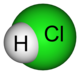 |
~107 | -7 | 0 | ||
| Iodidrico | HI |  |
~1010 | -10 | |||
| Nitrico | HNO3 |  |
25,1 | -1,4 | |||
| Perclorico[7] | HClO4 |  |
~108 | -8 | |||
| Selenico | H2SeO4 |  |
~106 | n.d. | -6 | ||
| Solforico | H2SO4 |  |
2,4·106 | 9,77·10-2 | -5,7 | 1,99 | |
| Teflico | HTeOF5 |  |
|||||
| Triflico | HCF3SO3 |  |
8,0·1014 | -13,1 | |||
| Perrenico[8] | HReO4 |  |
-1,25 | 25 |
Versione stampabile
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Acidi deuterati
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Versione stampabile
[modifica | modifica sorgente]Costanti di dissociazione basica
[modifica | modifica sorgente]Basi inorganiche deboli
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Versione stampabile
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Basi organiche deboli
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Versione stampabile
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Basi forti
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Versione stampabile
[modifica | modifica sorgente]Questa sezione è ancora vuota; aiutaci a scriverla! |
Prodotti di solubilità
[modifica | modifica sorgente]Risorse in rete
[modifica | modifica sorgente]Note
[modifica | modifica sorgente]- ↑ L'acido manganico è troppo instabile per essere studiato, ma la sua seconda costante di dissociazione acida è stata misurata tramite radiolisi
- ↑ Il primo protone dell'acido solforico è molto forte, mentre il secondo non è sempre dissociato in soluzione. Per conoscere la Ka1 dell'acido solforico si veda la tabella degli acidi forti.
- ↑ L'acido metavanadico polimerizza in lunghe catene. Non esiste in forma di monomero. Lo stesso vale per i suoi sali (si veda Sodium metavanadate su en.Wikipedia.
- ↑ L'acido periodico esiste in forma orto- e meta-. La prima, che non è riportata, ha formula H5IO6.
 Questa può essere deprotonata due volte (si veda Periodate e Sodium Periodate), per questo talvolta sono riportate due Ka per l'acido periodico.
Questa può essere deprotonata due volte (si veda Periodate e Sodium Periodate), per questo talvolta sono riportate due Ka per l'acido periodico.
- ↑ L'acido esiste in forma zwitterionica:

- ↑ L'acido metafosforico esiste solo in catene polimetriche cicliche, composte da unità [HO-P(=O)-O-]n. Si vedano come esempi Phosphoric acids and phosphates e Sodium hexametaphosphate su en.Wikipedia.
- ↑ Sono note differenti costanti di dissociazione dell'acido perclorico, tutte comprese tra 107 e 1010. Qui viene riportata quella intermedia.
- ↑ In soluzione acquosa l'acido esiste in forma di dimero diidrato dell'anidride perrenica, come mostrato in figura. HReO4 esiste in questa forma solo in fase gassosa. I suoi sali contengono l'anione ReO4-(Ammonium perrhenate).








