Laboratorio di chimica in casa/L'elettronegatività
Nel capitolo precedente abbiamo paragonato il legame chimico a il prof fumagalli ed infatti gli atomi tendono ad attirare verso di sé gli elettroni. Ma come spesso accade anche nel tiro alla fune, ci sono atomi che esercitano un'attrazione maggiore di altri sugli elettroni di legame.
Tale forza di attrazione si chiama elettronegatività ed è uno dei valori generalmente riportati sulle tavole periodiche:[1]
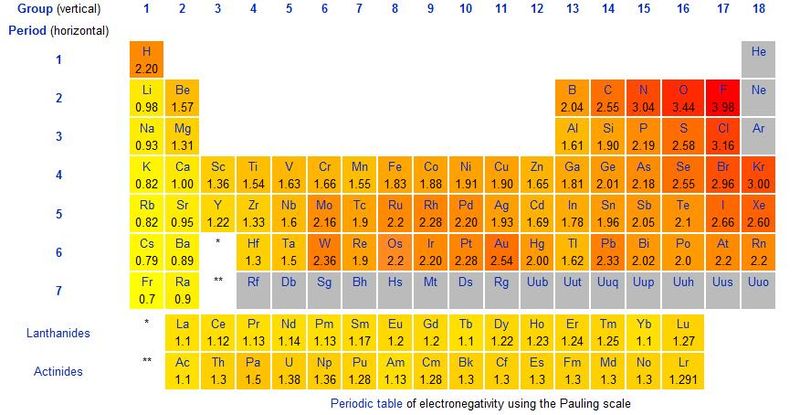
La differenza di elettronegatività conferisce ai due elementi legati una caratteristica fondamentale: lo stato di ossidazione.
Tale valore indica il numero di cariche elettriche che l'atomo ha acquistato o ceduto nel legame (anche se i due elementi li stanno comunque mettendo in compartecipazione). L'elemento più elettronegativo li acquista, l'altro li cede.
Si ricorda che il + e il - davanti allo stato di ossidazione non indicano il numero di elettroni acquistati o persi ma la carica dello ione, quindi un atomo con stato di ossidazione positivo ha perso gli elettroni (carica positiva del nucleo scoperta) mentre uno con stato di ossidazione negativo ha vinto degli elettroni (cariche negative degli elettroni in più).
Tale numero dipende dagli atomi leganti e, come visto in precedenza, esso può aumentare all'aumentare del numero di atomi che gli sottraggono o cedono elettroni.

Per questo motivo sulla tavola periodica sono riportati i numeri di ossidazione più comuni che l'elemento può avere: essi indicano quanti atomi di un determinato elemento possono combinarsi con esso sottraendogli o cedendogli un dato numero di elettroni a seconda della quantità e di altre condizioni in cui i due reagiscono, ed è un aiuto per prevedere il comportamento chimico dell'elemento durante una reazione.

Va infine fatto notare che, quando più elementi con elettronegatività diverse si uniscono, essi creano una molecola con forti sbilanciamenti di carica. Un esempio sono i sali ternari, cioè composti formati da due elementi molto elettronegativi legati fra loro e collegati anche ad un terzo elemento poco elettronegativo. In questo caso si genera una molecola composta da due parti: una molto "unita" creata dagli elementi molto elettronegativi, ed un'"appendice" costituita dall'atomo (o dagli atomi) meno elettronegativi.

In questo modo si ottengono due ioni:[2] la parte carica negativamente viene chiamata anione mentre quella positiva catione.[3]
Uno dei fenomeni più importanti per comprendere questa caratteristica è la solvatazione: quando un composto chimico i cui componenti hanno elettronegatività molto diverse viene sciolto in acqua, spesso si divide nei suoi ioni costituenti a seguito dell'impatto con le molecole del solvente. Questa trasformazione chimica è chiamata dissociazione ionica.
Note
[modifica | modifica sorgente]- ↑ Esistono tanti modi per misurare questa forza e perciò nella storia sono state stilate diverse liste di valori di elettronegatività degli elementi. Quella comunemente usata è quella di Linus Pauling, tabulata nella tavola periodica sotto riportata. Essa è un valore adimensionale (cioè un numero, senza unità di misura) che esprime la forza con cui un nucleo tende ad attrarre un elettrone cedutogli dall'esterno.
- ↑ Cioè particelle cariche elettricamente, descritte nel capitolo 2, ultime righe.
- ↑ In realtà anche l'atomo al centro dell'anione (lo zolfo nell'esempio) è carico positivamente (gli vengono sottratti 6 elettroni dagli atomi di ossigeno), e quindi è un catione, ma in questo caso lui e gli atomi che lo circondano formano un complesso unico che risucchia gli elettroni del terzo elemento meno elettronegativo, creando un'entità molecolare quasi indivisibile, che non viene più considerata formata da due parti cariche diversamente.
