Utente:Riccardo Rovinetti/Sandbox 30: differenze tra le versioni
| Riga 539: | Riga 539: | ||
{| align="center" style="text-align:center" width="30%" |
{| align="center" style="text-align:center" width="30%" |
||
|+ Con un unico stato di ossidazione |
|||
| ⚫ | |||
|- |
|- |
||
| ⚫ | |||
| ⚫ | |||
|- |
|||
| ⚫ | |||
|} |
|} |
||
| Riga 564: | Riga 564: | ||
;Nomenclatura IUPAC |
;Nomenclatura IUPAC |
||
La nomenclatura chimica ufficiale non è quella tradizionale, bensì quella stabilita dalla IUPAC nel 2005. <br /> |
La nomenclatura chimica ufficiale non è quella tradizionale, bensì quella stabilita dalla IUPAC nel 2005. <br /> |
||
Essa prevede diversi tipi di nomenclatura per i composti inorganici, e risulta spesso artificiosa (poiché deve essere applicabile a qualsiasi composto chimico, anche molto complesso). Quella più semplice si chiama ''compositional'' che mantiene i prefissi per gli anioni (Cl<sup>-</sup> rimane cloruro, NO<sub>3</sub><sup>-</sup> rimane nitrato ecc.) mentre elimina quello dei cationi (Ferroso e ferrico diventa solo "... di ferro" e così via). Il loro rapporto di combinazione viene indicato tramite i prefissi numerici greci ( |
Essa prevede diversi tipi di nomenclatura per i composti inorganici, e risulta spesso artificiosa (poiché deve essere applicabile a qualsiasi composto chimico, anche molto complesso). Quella più semplice si chiama ''compositional'' che mantiene i prefissi per gli anioni (Cl<sup>-</sup> rimane cloruro, NO<sub>3</sub><sup>-</sup> rimane nitrato ecc.) mentre elimina quello dei cationi (Ferroso e ferrico diventa solo "... di ferro" e così via) e di acidi ed anidridi. Il loro rapporto di combinazione viene indicato tramite i prefissi numerici greci (cloruro ferroso FeCl<sub>2</sub> è quindi bicloruro di ferro, Na<sub>3</sub>PO<sub>4</sub> diventa fosfato di trisodio, acido cloridrico HCl diventa cloruro di idrogeno, anidride solforosa SO<sub>2</sub> diventa diossido di zolfo.) |
||
{| class="wikitable" style="text-align:center; margin:1em auto 1em auto;" width="65%" |
{| class="wikitable" style="text-align:center; margin:1em auto 1em auto;" width="65%" |
||
|- |
|- |
||
! Formula || <big>PbF<sub>2</sub></big> |
! Formula || <big>PbF<sub>2</sub></big> || <big>Cu(MnO<sub>4</sub>)<sub>2</sub></big> || <big>K<sub>2</sub>MnO<sub>4</sub></big> || <big>NaHCO<sub>3</sub></big> || <big>HClO<sub>3</sub></big> || <big>Cl<sub>2</sub>O<sub>5</sub></big> |
||
|- |
|- |
||
! '''Compositional''' || Difluoruro di piombo || |
! '''Compositional''' || Difluoruro di piombo || Bipermanganato di rame || Manganato di dipotassio || Carbonato di sodio e idrogeno || Clorato di idrogeno || Pentossido di dicloro |
||
|- style="background:white" |
|- style="background:white" |
||
| '''Tradizionale''' || Fluoruro piomboso |
| '''Tradizionale''' || Fluoruro piomboso || Permanganato rameico || Manganato di potassio || Bicarbonato di sodio || Acido clorico || Anidride clorica |
||
|} |
|} |
||
;Nomenclatura di Stock |
;Nomenclatura di Stock |
||
Un altro sistema di nomenclatura rigoroso e chiaro quello di Alfred Stock. Esso è del tutto simile a quello usato dalla ''compositional'' ma al posto dei numerali greci utilizza i numeri romani per indicare lo stato di ossidazione del catione |
Un altro sistema di nomenclatura rigoroso e chiaro quello di Alfred Stock. Esso è del tutto simile a quello usato dalla ''compositional'' ma al posto dei numerali greci utilizza i numeri romani per indicare lo stato di ossidazione del catione e dell'anione. Come accade per le altre due nomenclature, non è necessario specificare lo stato di ossidazione se non c'è pericolo di ambiguità. |
||
{| class="wikitable" style="text-align:center; margin:1em auto 1em auto;" width="65%" |
{| class="wikitable" style="text-align:center; margin:1em auto 1em auto;" width="65%" |
||
|- |
|- |
||
! Formula || <big>PbF<sub>2</sub></big> || <big> |
! Formula || <big>PbF<sub>2</sub></big> || <big>H<sub>3</sub>AsO<sub>4</sub></big> || <big>Cu(MnO<sub>4</sub>)<sub>2</sub></big> || <big>K<sub>2</sub>MnO<sub>4</sub></big> || <big>HClO<sub>3</sub></big> || <big>Cl<sub>2</sub>O<sub>5</sub></big> |
||
|- |
|- |
||
! Stock || Fluoruro di piombo(II) || |
! Stock || Fluoruro di piombo(II) || Idrogenocarbonato di sodio || Manganato(VII) di rame(II) || Manganato(VI) di potassio || Clorato(V) di idrogeno || Ossido di cloro(V) |
||
|- style="background:white" |
|- style="background:white" |
||
| '''Compositional''' || Difluoruro di piombo || |
| '''Compositional''' || Difluoruro di piombo || Idrogenoarbonato di sodio || Bipermanganato di rame || Manganato di dipotassio || Clorato di idrogeno || Pentossido di dicloro |
||
|- style="background:white" |
|- style="background:white" |
||
| '''Tradizionale''' || Fluoruro piomboso || |
| '''Tradizionale''' || Fluoruro piomboso || Bicarbonato di sodio || Permanganato rameico || Manganato di potassio || Acido clorico || Anidride clorica |
||
|} |
|} |
||
Tale nomenclatura viene applicata soprattutto per dare il nome ai singoli cationi. Per esempio Cu<sup>2+</sup> è chiamato ''catione rameico'' nella tradizionale, ''catione Cu(+2)'' o ''rame(+2)'' dalla IUPAC e '''rame(II)''' o ''catione Cu<sup>II</sup>'' dalla nomenclatura di Stock. Tutti e cinque sono sinonimi, ma la versione in grassetto è quella solitamente più usata (ed approvata anche dalla IUPAC), specialmente quando il catione non è un singolo atomo ma una molecola intera. Per esempio [Cu(H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup> è una molecola che si forma sciogliendo un composto di rame(II) in acqua. Il suo nome ufficiale è ''esaacqua'''rame(II)'''''. |
|||
==Le equazioni di reazione== |
==Le equazioni di reazione== |
||
Versione delle 14:53, 21 mar 2014
La chimica è la scienza che studia la materia e le sue trasformazioni, nonché l'energia che vi è coinvolta. E così chi la studia vuole entrare a conoscenza di come trasformare o analizzare la materia.
Per farlo, come accade per ogni materia scientifica, è necessario disporre di un certo numero di conoscenze teoriche proporzionali al livello di capacità che si vuole ottenere.
Così questo libro è stato progettato per offrire a chiunque la possibilità di applicare le proprie conoscenze in campo chimico, per migliorare il loro apprendimento ed allo stesso tempo conoscere la materia con cui veniamo a contatto quotidianamente.
Per poter capire al meglio e mantenerle in memoria a lungo questo libro offre la possibilità di fare quattro cose: [1]
- Fare pratica di ciò che si ha studiato;
- Elaborare ed applicare creativamente le proprie conoscenze;
- Confrontarle con le esperienze di vita quotidiana;
- Approfondirle liberamente.
Così, per usare al meglio questo libro bisognerebbe accompagnare le attività di laboratorio da uno studio sistematico della chimica, e viceversa.
Questo libro non è un vero e proprio percorso di studio (che invece viene fornito da altri libri come Chimica per il liceo) ma è provvisto di proprie schede di introduzione ed approfondimento fatte su misura per le attività qui proposte. Nei diversi moduli del libro capiterà infatti di imbattersi in collegamenti alle pagine di approfondimento fatte apposta per spiegare le nozioni richieste durante l'esperienza, se non le si conosce già (tuttavia è sconsigliato studiare la materia solo sugli approfondimenti , ma andrebbe accompagnata da un libro didattico, per esempio un libro di scuola).
Prima di iniziale è tuttavia utile possedere alcune nozioni fondamentali, necessarie per poter praticare la maggior parte delle attività.
Parte prima
Nei seguenti moduli vengono trattate le nozioni di base per accedere alla prima parte del libro, quella di chimica inorganica: Sostanze inorganiche di partenza, Sostanze inorganiche artigianali, Strumentazione artigianale
- La costituzione della materia
- La struttura degli atomi
- La configurazione elettronica
- Le leggi di combinazione degli elementi
- La forma delle molecole
- I tipi di legame chimico
- I simboli chimici
- ...
Parte seconda
Nei seguenti moduli vengono fornite le nozioni necessarie a lavorare con sostanze organiche: Sostanze organiche di partenza, Sostanze organiche artigianali, Estratti.
Note
- ↑ Parisio Di Giovanni, La memoria (pag. 69-70), in Mente, comunicazione, educazione - temi di psicologia, 1° edizione, Milano, Paravia, 2010, p. 400.
La costituzione della materia
È risaputo che alcune volte, quando si mischiano assieme due sostanze si nota un qualche cambiamento, avviene una qualche trasformazione. Per esempio, gettando del bicarbonato di sodio nel vino rosso esso cambia di colore, e si può osservare lo sprigionamento di un gas.
Ma che cosa ha fatto avvenire la reazione? Cosa è cambiato nel vino mischiandolo col bicarbonato?
Se si prendesse un qualsiasi oggetto e lo si ingrandisse sempre di più, arrivati a circa una decina di miliardi di ingrandimenti noteremmo che essa è costituita da minuscole particelle. Quelle piccole sfere che costituiscono ogni oggetto materiale si chiamano atomi, e sono le combinazioni che essi formano a determinare la costituzione di un oggetto (colore, odore, densità, stato fisico ecc.), come lo sono i mattoni per un edificio.
È dunque conoscendo le proprietà e le leggi degli atomi che il chimico è in grado di trasformare la materia.







La struttura degli atomi
Le dimensioni di un atomo

L'immagine sopra rappresenta un atomo di elio: in nero la zona in cui possono orbitare i suoi due elettroni (più è scura maggiore è la probabilità che vi ci passi) e al centro di essa, ingrandito nel rettangolo nero in alto, è rappresentato il nucleo, formato da due protoni (in rosso) e due neutroni (in blu).
Il diametro del nucleo è circa 10-15 m (un milionesimo di miliardesimo di metro) e la distanza cui sciamano gli elettroni al perimetro della nuvola nera è circa 10-10 m (un decimo di miliardesimo di metro) cioè 10 000 volte il diametro del suo nucleo.
Gli atomi, quei corpuscoli che costituiscono la materia, sono delle specie di sistemi solari in miniatura. Essi sono quasi totalmente cavi, sono costituiti da un piccolo nucleo composto da due tipi di particelle: protoni, carichi positivamente, e neutroni, che non sono dotati di carica elettrica ma tengono insieme i protoni nel nucleo come una colla (questa forza è chiamata interazione forte).
Attorno a questo nucleo sciamano a grande distanza e velocità particelle leggere cariche negativamente chiamati elettroni. Essi sono vincolati al nucleo tramite l'attrazione elettrica delle cariche positive dei protoni ma non vi collassano per via della loro grande velocità, come accade per la Luna e la Terra.
In chimica gli atomi sono divisi in elementi. Ciò che determina di quale elemento si tratta (è un atomo di idrogeno, di ossigeno, di ferro ...) è il numero di protoni nel nucleo. A seconda del loro numero l'atomo appartiene ad un elemento diverso ed ha proprietà chimiche diverse.
Gli elementi sulla tavola periodica sono ordinati (da sinistra a destra e dall'alto al basso) in base a questo numero, chiamato numero atomico. Atomi con numero di protoni diverso sono elementi chimici diversi.

Le altre particelle del nucleo, i neutroni, non influenzano le proprietà chimiche dell'elemento[1] ed il loro numero può variare a seconda dell'elemento. L'ossigeno per esempio ha 8 protoni nel suo nucleo, ma nel suo nucleo può avere 8, 9 o 10 neutroni. Le sue proprietà chimiche sono sempre quelle dell'ossigeno, ma il suo peso è leggermente diverso. Atomi aventi stesso numero di protoni (quindi lo stesso elemento) ma aventi diverso numero di neutroni si chiamano isotopi. Il numero di isotopi è caratteristico di ogni elemento e quando supera un certo numero oppure è troppo basso, il nucleo atomico è instabile e tende a trasformarsi in un altro per decadimento radioattivo. Per questo motivo in natura sono presenti principalmente gli isotopi stabili dei vari elementi.

Questa tavola periodica evidenzia di un colore diverso gli elementi chimici per numero di isotopi stabili.
██ Nessun isotopo stabile
██ 1 isotopo stabile
██ 2 isotopi stabili
██ 3 isotopi stabili
██ 4 isotopi stabili
██ 5 isotopi stabili
██ 6 isotopi stabili
██ 7 o più isotopi stabili
La carica di ogni protone del nucleo è bilanciata da quella di un numero uguale di elettroni. L'azoto che troviamo nell'aria possiede 7 protoni nel suo nucleo, un numero variabile di 7 o 8 neutroni, e 7 elettroni che orbitano attorno ad esso. Quando un atomo attorno a sé ha un numero di elettroni uguale a quello dei protoni è detto atomo neutro perché non è carico elettricamente. Quando esso ha un numero di elettroni maggiore o minore di Z esso è chiamato ione, e più precisamente catione quando è carico positivamente perché gli mancano degli elettroni o anione quando è carico negativamente perché attorno a sé orbitano degli elettroni in più. Il numero degli elettroni attorno all'atomo influisce sulle sue proprietà chimiche, ma viene considerato sempre lo stesso elemento.
Il numero di neutroni e di protoni di un atomo non cambia durante le reazioni chimiche, delle quali sono gli elettroni i protagonisti assoluti.
La configurazione elettronica

Come detto in precedenza, gli atomi sono in grado di interagire fra loro legandosi a formare quei reticoli che determinano le caratteristiche di una sostanza, ma sono gli elettroni che tessono tale tela: il modo in cui essi tengono insieme con la propria carica elettrica i nuclei atomici genera un materiale con proprietà caratteristiche (colore, durezza, solubilità, ...) ed è dunque conoscendo il loro comportamento che si potranno spiegare le leggi che governano tali legami.
La prima regola dice che possono orbitare attorno al nucleo un numero massimo di elettroni a seconda della loro energia. Per usare una similitudine, gli elettroni si troveranno divisi in "zone" come i pianeti del sistema solare, che dopo Venere vengono improvvisamente divisi dalla Fascia di Kuiper trovandosi divisi da una anomala distanza. Raggiunto un numero massimo di elettroni per un certo numero atomico, gli elettroni di atomi con un numero atomico superiore si troveranno ad orbitare molto più distanti da quelli precedenti.



La seconda regola è una correzione della metafora usata in precedenza. Gli elettroni non ruotano attorno al nucleo seguendo orbite ellittiche, come fanno i pianeti, ma all'interno di questi ogni livello energetico gli elettroni orbitano in "zone preferenziali" chiamate orbitali. Il numero di queste zone cambia a seconda del livello.
In questa immagine vengono schematizzati i livelli con i rispettivi orbitali:

La terza ed ultima legge dice che in queste camere gli elettroni tendono ad accoppiarsi prima di passare al livello energetico successivo. Per esempio, nel secondo livello (in verde) ci sono quattro orbitali. Questi quattro orbitali possono ospitare 8 elettroni. I primi elementi cui corrisponde quel livello, litio (Li), berillio (Be), boro (B) e carbonio (C) avranno un solo elettrone all'interno di queste camere.[3] Essi tendono infatti a rimanere separati perché respinti dalle loro cariche di segno uguale. Nei successivi quattro elementi cioè azoto (N), ossigeno (O), fluoro (F) e neon (Ne) gli elettroni, uno alla volta, tendono ad occupare l'altra metà delle quattro camere in cui è già presente un elettrone. E così ogni livello energetico può contenere il doppio di elettroni rispetto al numero delle camere in esso presenti. Ecco rappresentati gli atomi dei primi due periodi con i rispettivi elettroni e livelli:
Le leggi di combinazione degli elementi



Nell'ambiente in cui viviamo non troviamo quasi mai atomi singoli, ma composti chimici in cui essi sono combinati fra loro.
Ciò che tiene insieme due atomi è chiamato legame chimico ed è sostanzialmente l'attrazione elettrostatica tra le cariche di segno opposto dei nuclei atomici e quelle degli elettroni, ma stavolta sono due elettroni che fanno da ponte fra due nuclei atomici: una specie di tiro alla fune fra atomi, in cui la corda sono due elettroni. Una situazione analoga si ha quando si collegano due calamite tramite un chiodo. In quel caso l'attrazione è magnetica, ma l'effetto è quello di creare un aggregato atomico, che nel linguaggio chimico è chiamato molecola. L'immagine in alto a destra rappresenta una molecola dell'acqua, composta da due atomi di idrogeno legati ad uno di ossigeno. Tramite altri legami elettrostatici (più deboli) le molecole si attraggono fra loro ed è così che si forma un aggregato che noi chiamiamo sostanza.
Gli atomi tuttavia non si combinano in maniera casuale come fanno pezzi di ferro e calamite: esistono diversi tipi di legami chimici, ed essi seguono precise regole di combinazione.
La prima legge, prima anche per importanza, dice che un atomo quando si combina con un altro lo fa solo con gli elettroni presenti nel suo livello più esterno (chiamati elettroni di valenza).
Questo perché, come già detto in precedenza, gli elettroni in uno stesso livello energetico hanno tutti la stessa distanza dal nucleo, e quindi sono attratti tutti con la stessa forza, ed essendo nel livello più esterno sono quelli che risentono di meno di questa attrazione; così possono essere attratti da un atomo vicino per formare un legame chimico, mentre quelli nel livello sottostante sono molto più vicini al nucleo e quindi occorre molta più energia per allontanarli da esso, quasi sempre troppa per creare un legame stabile.
Per questo motivo, quando verranno mostrate alcune combinazioni degli elementi, si potranno rappresentare gli atomi semplicemente disegnando il loro simbolo circondato dagli elettroni di valenza. Questo tipo di rappresentazione atomica è detta struttura di Lewis (essa tuttavia non rappresenta la vera struttura tridimensionale della molecola, è solo uno schema dei suoi legami chimici).

Come già detto in precedenza, il numero di elettroni di valenza di un elemento si vede dal gruppo della tavola periodica cui appartiene.
Nella tavola periodica tuttavia esistono 3 blocchi in cui i gruppi si ripetono periodicamente:
- Elementi rappresentativi: sono quelli che nel loro guscio di valenza hanno da 1 a 8 elettroni (eccezion fatta per idrogeno ed elio che ne hanno rispettivamente solo 1 e 2). Essi comprendono i primi due gruppi della tavola periodica, metalli alcalini (A I) ed alcalino-terrosi (A II) ed tutti i gruppi da quello del boro (A III) a quello dei gas nobili (A VIII).
- Metalli di transizione: Essi possono avere da 3 a 12 elettroni nel loro guscio di valenza, ma ne possono mettere in gioco al massimo 8, e solo in rari casi.[4] Vanno dal gruppo dello scandio (B III) a quello dello zinco (B II). Il fatto che in questo blocco il gruppo I sia alla fine ed il III sta all'inizio non è un errore: i metalli del gruppo del rame e dello zinco mettono solitamente in gioco rispettivamente 1 o 2 elettroni, ma non sono elencati all'inizio del blocco per rispettare l'ordine di numeri atomici, e lo stesso vale per il gruppo III B dello scandio (Sc, elemento 21) i cui elementi hanno 3 elettroni di valenza ma vengono prima di rame e zinco come numero atomico.
- Terre rare: Tali elementi hanno gusci atomici ancora più capienti degli elementi nei blocchi precedenti, e possono ospitare fino a 17 elettroni nel loro guscio più esterno, anche se raramente ne usano più di 6.[5]

La seconda regola fondamentale dice che ogni atomo tende ad assumere la stessa configurazione elettronica del gas nobile più vicino. Essa è chiamata regola dell'ottetto ed è stata già accennata prima: la maggior parte degli atomi ha la tendenza ad avere otto elettroni nel loro guscio più esterno (da questo deriva ottetto), come hanno tutti i gas nobili (ad eccezione dell'elio). Facciamo degli esempi. L'ossigeno appartiene al gruppo A-VI della tavola periodica (lo si può vedere nella tavola mostrata sopra) ed ha la seguente struttura di Lewis:

Avendo solo 6 elettroni di valenza tenderà ad acquistarne due per raggiungere l'ottetto.
Possiamo trovare in natura l'ossigeno in due sostanze indispensabili per la vita: l'acqua e l'aria.
Queste sono le rispettive strutture di Lewis dei loro componenti ossigenati: l'ossido di idrogeno (chiamato semplicemente acqua anche in chimica), l'ossigeno molecolare (che compone il 21% dell'aria) e l'anidride carbonica (emessa dai viventi durante la respirazione).
Nella prima immagine troviamo due atomi di ossigeno che si scambiano i propri elettroni spaiati. Così facendo i due elementi si ritrovano ad avere tutti gli elettroni appaiati, e ciò permette ad entrambi gli atomi di raggiungere la configurazione del gas nobile.
Nella seconda immagine possiamo osservare una molecola composta da due elementi diversi, idrogeno e ossigeno, entrambi aventi i propri livelli "sazi" di elettroni: l'idrogeno ottiene l'elettrone spaiato dell'ossigeno, andando a completare con due elettroni il livello 1 e raggiungendo la configurazione elettronica dell'elio (He, elemento 2) mentre l'ossigeno guadagna due elettroni dagli idrogeni, trovandosi 8 elettroni nel suo guscio di valenza (livello 2), gli stessi del gas nobile del suo periodo, il neon (Ne, elemento 10).
Nella terza immagine vediamo due ossigeni legati ad un atomo di carbonio (C, elemento 12). Quest'ultimo è il capostipite del IV gruppo degli elementi rappresentativi, il che significa che la sua valenza è 4. Esso è quindi in grado di prestare due suoi elettroni a due atomi di ossigeno, che completano il loro ottetto, e nel contempo lui si ritrova vicini due elettroni in più per ogni atomo di ossigeno, ottenendo anch'egli i quattro elettroni necessari a raggiungendo l'ottetto.
Dall'immagine a sinistra notiamo un'altra cosa molto importante: anche gli elementi allo stato fondamentale, cioè sostanza formate da un solo elemento chimico, hanno una specifica struttura molecolare (in questo caso l'ossigeno molecolare è composto da due atomi di ossigeno legati assieme). Solo i gas nobili, che hanno appunto l'ottetto completo, non necessitano di legarsi con altri elementi e quindi si trovano sempre sotto forma di singoli atomi, ma tutti gli altri si ritrovano legati in molecole.[6]
La terza regola fondamentale è quella dell'ottetto espanso. Un atomo che non ha completato il proprio ottetto può sottrarre una coppia di elettroni ad un altro atomo che ha già il guscio esterno completo.
Facciamo un esempio con fluoro (F, elemento 9) e cloro (Cl, elemento 17). Essi hanno entrambi 7 elettroni nel loro guscio di valenza, e quindi entrambi ne condivideranno uno ciascuno per completare l'ottetto.[7]

Tuttavia in alcune condizioni particolari una molecola di fluoro può ulteriormente reagire con il cloro strappandogli una coppia di elettroni, andando a formare il trifluoruro di cloro.

Nella molecola precedente il cloro e il fluoro mettevano in compartecipazione i propri elettroni ed entrambi raggiungevano l'ottetto. Ma in questa due atomi di fluoro sottraggono una coppia di elettroni appaiati al cloro, andando a formare quella che si chiama molecola ipervalente cioè una molecola in cui un atomo mette in compartecipazione un suo doppietto elettronico anche se ha già l'ottetto completo.
Nella molecola di trifluoruro di cloro l'atomo centrale possiede ancora due coppie di elettroni, ma può cederne solo una ad un'altra molecola di fluoro, diventando pentafluoruro di cloro.[8]

Quanto un atomo possa essere "generoso" con altri dipende dalle proprietà chimico-fisiche di essi e dalle condizioni in cui vengono fatti combinare, fattori che verranno spiegati in seguito.
La forma delle molecole
Le formule di Lewis usate precedentemente non danno indicazioni sulla forma tridimensionale della molecola, cosa che viene invece data dai modelli molecolari.
Essi si basano sul principio di repulsione dei doppietti elettronici abbreviato in VSEPR[9]: quando due atomi mettono in compartecipazione i propri elettroni per formare un legame chimico, gli elettroni nella molecola creata (quelli nei doppietti solitari e quelli di legame) tenderanno a stare il più distante possibile a causa della forza repulsiva fra le loro cariche negative.

L'immagine sopra riportata è la rappresentazione tridimensionale della molecola d'acqua. L'ossigeno è circondato da quattro coppie di elettroni, due solitarie e due formate dall'unione degli elettroni spaiati dell'idrogeno e dell'ossigeno. Secondo la teoria VSEPR le cariche di segno uguale dovranno stare il più distante possibile fra loro. In questo caso, la forma geometrica tridimensionale in cui quattro punti fanno il maggiore angolo fra di loro è la piramide a base triangolare (angoli di 109,5°), e perciò gli elettroni tenderanno a disporsi ai vertici di tale tetraedro, come mostrato in figura. Da ciò deriva la forma piegata della molecola d' acqua (e di altre molecole), con un angolo fra i due idrogeni (misurato per diffrazione di raggi X) di 106,45°.
| Geometrie più comuni | |||
|---|---|---|---|
| Lineare | Triangolare | Tetraedrica | Ottaedrica |
 |
 |
 |

|
 |
 |
 |

|
| Anidride carbonica | Fluoruro di boro | Metano | Ione esaaquorame(II) |
Nelle molecole contenenti coppie solitarie i doppietti elettronici (sia di legame che solitari) avranno una disposizione simile a quelle mostrate in precedenza, e la geometria della molecola risulterà "piegata" di conseguenza:
| Esempio: geometria tetraedrica | ||
|---|---|---|
| Molecola lineare | Molecola piegata | Molecola piramidale |
 |
 |

|
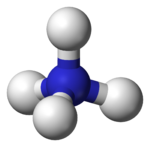
| Acido fluoridrico | Acqua | Ammoniaca |
 |
 |

|
Come si è potuto notare dalle immagini sopra riportate, le molecole vengono rappresentate utilizzando simbolismi diversi. Esistono due tipi di modelli tridimensionali:
- a ad asta e sfera: In tale rappresentazione tridimensionale le lunghezze di legame sono in scala, ma non lo sono le dimensioni degli atomi. Sono mostrati il numero di legami ed eventuali risonanze.
- a calotta: In tale rappresentazione tridimensionale sono mostrati gli atomi con il proprio raggio atomico ma non è mostrato il numero di legami che l'atomo fa.
In entrambi i casi, gli atomi hanno un colore specifico (scelto dai produttori del programma di rappresentazione molecolare).[10]
| 1 H |
2 He | |||||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |||
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |||
| 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |||
| 87 Fr |
88 Ra |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Uut |
114 Fl |
115 Uup |
116 Lv |
117 Uus |
118 Uuo | |||
| * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
Il colore degli atomi comunque non è una convenzione ufficiale e può variare da programma a programma. Solitamente per gli atomi più comuni (H, C, N, O, S) Si tende ad usare i colori adottati per la prima volta da Corey, Pauling e Kourt, o ad associare all'elemento il suo colore naturale o tipico dei suoi composti.
I legami chimici
I legami che tengono insieme atomi e molecole prendono nomi diversi a seconda delle loro caratteristiche e possono essere distinti in due categorie principali: legami intramolecolari (cioè fra gli atomi di una molecola) e intermolecolari (cioè fra gli atomi di molecole diverse). I legami intramolecolari sono generalmente i più forti e sono quelli di cui ci occuperemo in questo capitolo.
Nel capitolo precedente si è paragonato il legame chimico ad un tiro alla fune, e infatti gli atomi tendono ad attirare verso di sé gli elettroni. Ma come spesso accade anche nel tiro alla fune, ci sono atomi che esercitano un'attrazione maggiore di altri sugli elettroni di legame.
Tale forza di attrazione si chiama elettronegatività ed è uno dei valori generalmente riportati sulle tavole periodiche:
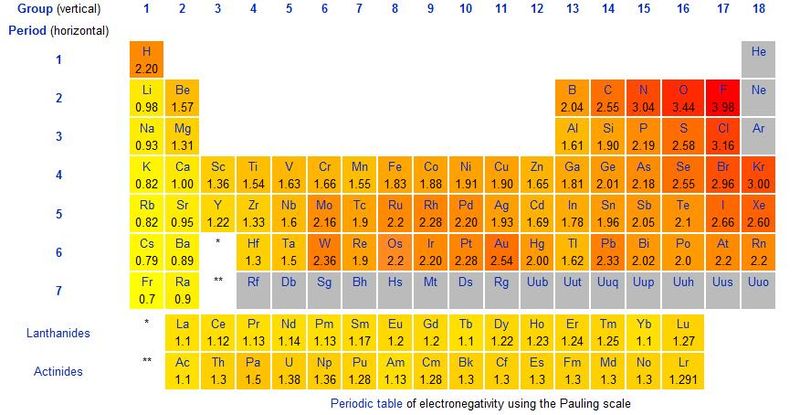
Esistono tanti modi per misurare questa forza e perciò nella storia sono state stilate diverse liste di valori di elettronegatività degli elementi. Quella comunemente usata è quella di Linus Pauling, tabulata nella tavola periodica sopra riportata. Essa è un valore adimensionale (cioè un numero, senza unità di misura) che esprime la forza con cui un nucleo tende ad attrarre un elettrone cedutogli dall'esterno. È Il valore assoluto della differenza di elettronegatività fra due elementi che ci indica che tipo di legame li unisce.

I tipi di legame forte
Anche se un legame chimico rimane sempre l'attrazione che due nuclei esercitano su una coppia di elettroni, la differenza di forza attrattiva fra i due cambia in maniera drastica le proprietà della molecola. Per questo motivo i chimici dividono per convenzione i legami in tre categorie basandosi sull'elettronegatività e su altri fattori minori:
- Covalente puro

Due atomi sono uniti da un legame covalente puro quando la differenza di elettronegatività è compresa tra 0 e 0,4. Esempi di legami puri sono quelli fra atomi dello stesso elemento (O=O, H-H, Cl-Cl, I-I, N≡N, ...) o fra elementi con elettronegatività molto simili (C-H, P-H, N-Cl, S-I, S-P, ...).
Tale legame chimico non lascia scoperta la carica dei due nuclei atomici, e così le molecole presentano basse attrazioni elettrostatiche fra di loro.
-
Molecola dell'ossigeno gassoso (modello a sfere e bastoncini)
-
Molecola dello zolfo solido
-
Arsina, composta da arsenico (e.n. 2,18 in viola) e idrogeno (e.n. 2,2 in bianco)
-
Tricloruro di azoto, composto da cloro e azoto (e.n. 3,04 in blu)
- Covalente polare

Quando la differenza di elettronegatività fra i due elementi è compresa tra 0,4 e 1,7 o 1,9 (in alcuni testi sono riportati valori diversi) si dice che il legame covalente è polare. In un legame polare, una coppia di elettroni tende ad orbitare "dalla parte" dell'elemento più elettronegativo. In questo modo la carica del nucleo dell'elemento meno elettronegativo può risultare scoperta, non bilanciata dalle cariche negative degli elettroni che ora si trovano ad orbitare più vicini ad un altro atomo, e risulta carico positivamente (l'altro invece si carica negativamente). Questa differenza di attrazione si traduce in un legame in cui l'elettrone orbita per più tempo attorno all'atomo più elettronegativo.
-
Diossido di zolfo, composto da zolfo e ossigeno (Δe.n. 0,86)
-
Acqua, composta da ossigeno e idrogeno (Δe.n. 1,24)
-
Cloruro di boro, composto da cloro e boro (Δe.n. 1,12)
-
Anidride carbonica, composto da carbonio e ossigeno (Δe.n. 0,89)
- Ionico


Quando la differenza di elettronegatività fra i due elementi è maggiore di 1,7/1,9[11] il legame è classificato come ionico. I due atomi sono sempre legati tramite una forza elettrostatica, ma l'elettrone sarà quasi completamente deviato verso l'elemento più elettronegativo. [12]
La caratteristica principale dei composti ionici è quella di possedere un reticolo cristallino polimerico (detto lattice) in cui gli atomi si dispongono in maniera regolare attratti reciprocamente l'un l'altro dalle rispettive forze elettrostatiche, senza formare singole molecole. Si tenga comunque presente che un minimo carattere covalente (cioè di condivisione dell'elettrone) è presente in qualsiasi composto ionico, come nelle molecole, l'unica differenza è che ogni ione è attratto dagli altri con la stessa forza (cosa che non accade nei solidi composti da vere molecole) formando un lattice polimerico in cui non sono distinguibili singole molecole.
Gli ioni presenti nei solidi ionici possono contenere legami covalenti di diverso tipo. Tali ioni sono chiamati complessi. Esempi molto comuni sono il catione ammonio NH4+ e gli ossoanioni SO42-, NO3-, PtCl42- ecc. I composti chimici derivati sono comunque classificati come composti ionici.
-
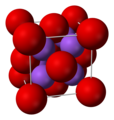
Fluoruro di calcio, composto da fluoro e calcio (Δe.n. 2,98)
-
Ossido di sodio, composto da ossigeno e sodio (Δe.n. 2,51)
-
Fluoruro di cesio , composto da cesio e fluoro (Δe.n. 3,19)
-
Cloruro di ammonio, [NH4]+Cl-
-
Solfato rameico, Cu2+[SO4]2-
-
Nitrato di potassio K+[NO3]-
- Dativo
Il legame dativo, già menzionato prima, è un legame covalente in cui un atomo sottrae un doppietto elettronico ad un altro atomo che ha già completato l'ottetto.
Questo legame può essere visto da due punti di vista: all'atomo centrale può essere rubato un elettrone da un atomo legante (caso del perclorato sopra riportato e dei fluoruri di cloro visti prima) oppure si può avere il caso inverso, in cui un nucleo positivo attrae a sé il doppietto elettronico di un'altro atomo avente già l'ottetto completo (caso dell'idrogeno che ruba un doppietto elettronico all'azoto nella molecola dell'ammoniaca). Quest'ultimo caso una volta era classificato separatamente dal primo (anche perché di solito il legame è più debole rispetto al primo caso), e le molecole come NH4+ erano detti complesi. Ora tale termine è esteso a tutte le molecole.
- Metallico

Da notare che anche i metalli hanno un reticolo cristallino, come i composti ionici, ed anche in essi gli atomi si trovano sotto forma di ioni, poiché gli elettroni che dovrebbero bilanciare la loro carica elettrostatica sono sparsi nello spazio che c'è fra atomo e atomo. Il legame metallico si mantiene anche quando più metalli sono fusi in una lega.
Negli elementi allo stato metallico (e nelle leghe) gli elettroni di valenza degli atomi non sono vincolati da orbitali di legame fissi come nelle molecole covalenti o negli ioni ma si muovono liberi nel reticolo cristallino del metallo saltando di atomo in atomo, come fossero un liquido. Per tale motivo i metalli sono in grado di condurre l'elettricità, risultano facilmente plasmabili e fusibili.[13]
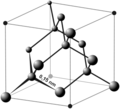
- Solido reticolare covalente
I solidi covalenti reticolari sono solidi costituiti da un reticolo cristallino, come i composti ionici, ma i cui atomi sono uniti da legami covalenti. Esempi di tali solidi sono il diamante, nitruro di boro, carburo di silicio ecc.
- Vi sono inoltre composti al limite fra ionici e covalenti reticolari, come i solfuri e gli ossidi dei metalli di transizione, che generalmente sono classificati come ionici ma presentano notevoli caratteristiche covalenti.[14]
-
Carbone amorfo
-
Diamante (carbonio)
-
Disolfuro di molibdeno (MoS2)
-
Quarzo (SiO2)
Legami intermolecolari
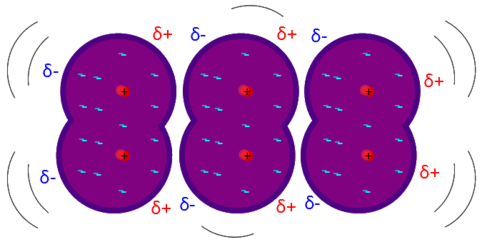
La carica elettrica rimasta sbilanciata da un legame polare può espandersi anche all'esterno della molecola. Essa risulta quindi polarizzata, come una calamita, con una parte negativa ed una positiva.
 |
 |

|
| I numeri in piccolo sono le elettronegatività degli atomi. | ||
La forza di tali campi elettrici non è data dalla sola polarità del legame ma è drasticamente influenzata dalla geometria della molecola: Se l'attrazione esercitata dagli atomi è perfettamente bilanciata, il campo elettrico verrà annullato esattamente come in un tiro alla fune, e la molecola risulterà di conseguenza apolare. Nella tabella qui sotto sono riportati alcuni esempi di molecole, tutte con legami molto polari, ma quelle a sinistra non risultano polarizzate a causa della loro geometria. La polarità viene confrontata con i punti di fusione ed ebollizione: più sono alti, più la molecola è polare.
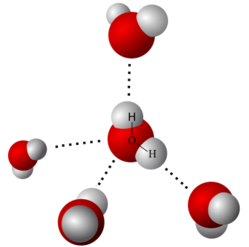
Le forze di attrazione dovute alla polarità ed alla geometria dei legami vengono chiamati dipoli permanenti e permettono alle molecole di essere attratte le une dalle altre tendendo ad aggregarsi. Abbiamo visto per esempio l'acqua, liquida fino a 100 °C o i composti ionici solidi.[15]
A queste si aggiungono altre forze di attrazione a corto raggio chiamati dipoli momentanei (o forze di Van der Waals) dovuti appunto al momentaneo sbilanciamento delle cariche elettriche della molecola. Questo a causa delle vibrazioni del nucleo e degli elettroni (Forza di London), o influenzate dai dipoli permanenti di molecole vicine (Forza di debye).
-
Dipoli permanenti nelle molecole di acqua (Legame a idrogeno).
-
Legame fra uno ione ed i dipoli permanenti delle molecole di acqua.
-
I dipoli permanenti dell'acqua attraggono gli elettroni di una molecola di cloro inducendo in essa dei dipoli momentanei (Forza di debye).
-
Dipoli momentanei causati dalle oscillazioni del nucleo in molecole di iodio, che causano lo spostamento delle nuvole elettroniche delle molecole vicine. (Forza di London).
Tali forze sono molto meno potenti dei dipoli momentanei, ma sono molto risentite da molecole dall'alto peso molecolare (lo iodio elementare per esempio è solido, al contrario degli altri alogeni come fluoro e cloro).

Tutti questi tipi di interazioni elettrostatiche determinano in maniera notevole certe proprietà (specialmente fisiche) della sostanza:
- La polarità della molecola ne determina la solubilità in un determinato composto: sostanze ioniche come i sali tenderanno a venire sciolti da solventi molto polari come l'acqua o gli acidi, mentre i composti apolari come gli oli tenderanno a venire sciolti da altri composti apolari come la benzina.
- Più un materiale presenta rugosità, più esporrà una superficie maggiore, ricca di molecole polari la cui carica elettrostatica genererà attrito rendendo il materiale facilmente incollabile (per esempio si graffiano le gomme delle biciclette con la carta vetrata prima di tappare i buchi con pezza e colla). Alcuni animali hanno peli sulle zampe per amplificare questa forza di attrazione ed arrampicarsi su pareti verticali (il geco addirittura può camminare sul vetro)
- Nel caso di un fluido, più esso è polare, più sarà viscoso (per esempio l'acqua è meno polare e meno viscosa dell'acido solforico, e viceversa è più polare e più viscosa della benzina). La cosa, come detto prima, vale sia per i liquidi che per i gas.
La simbologia chimica
Per comunicare più facilmente i chimici usano una serie di simbolismi e nomenclature che anche questo libro adotta e che è necessario conoscere per comprendere la scrittura chimica di base.
Per imparare la terminologia chimica più specifica si può consultare il Dizionario chimico divulgativo.
Ad ogni composto chimico è associato un nome ed una formula. Conoscendo entrambi è possibile avere un'idea della sua composizione e dei legami che i diversi elementi instaurano senza vedere la sua struttura di Lewis.
La formula bruta è una scrittura che condensa la struttura di Lewis, e cioè indica la composizione chimica di una "molecola"[16]

Le formule condensate hanno le seguenti caratteristiche:
- Gli elementi sono scritti in ordine di elettronegatività crescente.[17] Per esempio in NaCl viene prima Na (0,93) e poi Cl (3,16).
- I numeri al pedice indicano quanti atomi dell'elemento alla loro sinistra sono presenti nella molecola. Per esempio H2O contiene due atomi di idrogeno ed uno di ossigeno, AlCl3 uno di alluminio e tre di cloro.
- Le parentesi fanno ripetere il gruppo di atomi al loro interno. Cu(NO3)2 contiene un atomo di rame e due anioni NO3-.
La formula bruta tuttavia elimina tutti i riferimenti riguardo i legami fra gli elementi, quindi non sempre possibile partire da una formula bruta e risalire alla struttura di Lewis (specialmente se si è agli inizi). Per ovviare a questo problema il nome dei composti è stato scelto in modo che dia un'indicazione di come gli atomi sono legati.
La nomenclatura
Negli ambienti in cui si studia la chimica sono validi tre tipi di nomenclatura: quella tradizionale, quella IUPAC[18] e quella di Stock.
In questo libro è stato scelto di denominare i composti con il nome che viene dato loro più comunemente, che in genere è quello tradizionale, ma si farà uso anche degli altri due sistemi.
- Nomenclatura tradizionale
La nomenclatura più utilizzata in questo libro e nei laboratori è quella tradizionale. Essa compone il nome dei composti indicando le caratteristiche dell'anione e del catione: a entrambi assegna una radice simile a quella dell'elemento che lo compone (zolfo = solf-, ferro = ferr-, stagno = stann-, cloro = clor-, ecc.) ed una desinenza che ne indica lo stato di ossidazione.
| Anione (-) | Catione (+) | |
|---|---|---|
| ...-uro | ||
| Basso | ...-ito | ...-oso |
| Alto | ...-ato | ...-ico |
| Più basso | Ipo-... | |
| Più alto | Per-... | |
Per il ferro, per esempio, gli stati di ossidazione più comuni[19] sono +2 e +3. I composti di ferro +2 si chiameranno ferr-osi, gli altri ferr-ici (come mostrato in tabella). Dato che ogni anione in un composto chimico deve essere accompagnato da un catione, prendiamo il cloro come compagno del ferro. Esso può assumere stati di ossidazione -1 (da solo), +1, +3, +5 e +7 (nel suo ossoanione). I composti formati dalle combinazioni di questi due ioni sono:

Vi sono inoltre tre casi particolari di nomenclatura:
- Quando l'elemento chimico possiede un solo stato di ossidazione (metalli del I, II e III gruppo, più altri) non è necessario specificare lo stato di ossidazione del catione, il nome sarà "... di sodio, ... di boro, ..."
| + NaCl |
+2 CaSO4 |
+3 Al2O3 |
+2 Zn(NO3)2 |
| Cloruro di sodio | Solfato di calcio | Ossido di alluminio | Nitrato di zinco |
- I composti contenenti idrogeno in stato di ossidazione +1 vengono chiamati acidi.[20] Quelli contenenti solo l'idrogeno ed un altro elemento sono chiamati idracidi (HCl, H2S, HI) in cui l'anione prende il suffisso -idrico, mentre quelli contenenti anche l'ossigeno sono detti ossoacidi in cui il catione prende i suffissi visti prima per gli anioni.[21]

La stessa cosa avviene per le anidridi, che seguono la stessa formula: "anidride + nome dell'anione + suffisso". Le anidridi sono semplicemente degli ossidi, che hanno tuttavia la caratteristica di generare il rispettivo ossiacido a contatto con l'acqua (anidride solforica SO3 + acqua H2O → acido solforico H2SO4)

Una grande quantità di esempi è fornita nel capitolo Sostanze inorganiche artigianali.
- Nomenclatura IUPAC
La nomenclatura chimica ufficiale non è quella tradizionale, bensì quella stabilita dalla IUPAC nel 2005.
Essa prevede diversi tipi di nomenclatura per i composti inorganici, e risulta spesso artificiosa (poiché deve essere applicabile a qualsiasi composto chimico, anche molto complesso). Quella più semplice si chiama compositional che mantiene i prefissi per gli anioni (Cl- rimane cloruro, NO3- rimane nitrato ecc.) mentre elimina quello dei cationi (Ferroso e ferrico diventa solo "... di ferro" e così via) e di acidi ed anidridi. Il loro rapporto di combinazione viene indicato tramite i prefissi numerici greci (cloruro ferroso FeCl2 è quindi bicloruro di ferro, Na3PO4 diventa fosfato di trisodio, acido cloridrico HCl diventa cloruro di idrogeno, anidride solforosa SO2 diventa diossido di zolfo.)
| Formula | PbF2 | Cu(MnO4)2 | K2MnO4 | NaHCO3 | HClO3 | Cl2O5 |
|---|---|---|---|---|---|---|
| Compositional | Difluoruro di piombo | Bipermanganato di rame | Manganato di dipotassio | Carbonato di sodio e idrogeno | Clorato di idrogeno | Pentossido di dicloro |
| Tradizionale | Fluoruro piomboso | Permanganato rameico | Manganato di potassio | Bicarbonato di sodio | Acido clorico | Anidride clorica |
- Nomenclatura di Stock
Un altro sistema di nomenclatura rigoroso e chiaro quello di Alfred Stock. Esso è del tutto simile a quello usato dalla compositional ma al posto dei numerali greci utilizza i numeri romani per indicare lo stato di ossidazione del catione e dell'anione. Come accade per le altre due nomenclature, non è necessario specificare lo stato di ossidazione se non c'è pericolo di ambiguità.
| Formula | PbF2 | H3AsO4 | Cu(MnO4)2 | K2MnO4 | HClO3 | Cl2O5 |
|---|---|---|---|---|---|---|
| Stock | Fluoruro di piombo(II) | Idrogenocarbonato di sodio | Manganato(VII) di rame(II) | Manganato(VI) di potassio | Clorato(V) di idrogeno | Ossido di cloro(V) |
| Compositional | Difluoruro di piombo | Idrogenoarbonato di sodio | Bipermanganato di rame | Manganato di dipotassio | Clorato di idrogeno | Pentossido di dicloro |
| Tradizionale | Fluoruro piomboso | Bicarbonato di sodio | Permanganato rameico | Manganato di potassio | Acido clorico | Anidride clorica |
Tale nomenclatura viene applicata soprattutto per dare il nome ai singoli cationi. Per esempio Cu2+ è chiamato catione rameico nella tradizionale, catione Cu(+2) o rame(+2) dalla IUPAC e rame(II) o catione CuII dalla nomenclatura di Stock. Tutti e cinque sono sinonimi, ma la versione in grassetto è quella solitamente più usata (ed approvata anche dalla IUPAC), specialmente quando il catione non è un singolo atomo ma una molecola intera. Per esempio [Cu(H2O)6]2+ è una molecola che si forma sciogliendo un composto di rame(II) in acqua. Il suo nome ufficiale è esaacquarame(II).
Le equazioni di reazione
Le reazioni chimiche vengono descritte da particolari equazioni (dette appunto equazioni di reazione o equazioni chimiche) in cui le molecole di partenza (reagenti) sono scritte a sinistra, mentre quelle prodotte dalla reazione (prodotti) sono scritte a destra. Per convalidare l'equazione viene usata una freccia.

Lla reazione riportata sopra è quella fra carbonato di sodio ed acido cloridrico. In essa sta scritto che una molecola di carbonato (Na2CO3) reagisce con due di acido cloridrico (2 HCl). I prodotti sono due molecole di cloruro di sodio (2 NaCl), una di anidride carbonica (CO2) ed una di acqua (H2O). I numeri riportati dietro le molecole si chiamano coefficienti stechiometrici ed indicano, come è stato già intuito, il numero di molecole che prendono parte alla reazione.
Per il momento ci limiteremo a capire come mischiare due sostanze data un'equazione di reazione già pronta, verrà spiegato nel capitolo seguente come fare ad intuire i prodotti che si formano e a bilanciare (cioè mettere i giusti rapporti di combinazione) le reazioni.
Dal punto di vista pratico però, quando si mischiano due sostanze, non è possibile contare le molecole contenute in un campione. Si dispone solo della massa (peso)[22] del campione. Per questo è stata fissata una unità di misura per convertire la massa del campione in un numero preciso di molecole, chiamata mole. Ogni molecola ha un peso diverso, quindi una mole di sostanze diverse avrà pesi diversi relativi ad ogni sostanza, ma il numero di entità molecolari in essa contenute sarà sempre quella fissata per convenzione.
L'"unità di misura" che converte la massa in moli è la massa molare, espressa in g/mol (grammi ogni mole). Essa è stata misurata quella di ogni elemento chimico ed è riportata su ogni tavola periodica. [23]

Da esse è possibile ricavare la massa molecolare sommando le masse atomiche degli elementi chimici che la compongono.
Tali valori sono riportati anche su Wikipedia nella tabella posta a destra in ogni pagina sui composti chimici (infobox composto chimico) e si consiglia di riportarli anche sui contenitori delle sostanze di cui si dispone in laboratorio.
Per convertire i grammi in moli basta dividere i grammi per la per la massa molare del composto (e viceversa).

Prendiamo come esempio 10 grammi di Na2CO3. Quante moli sono? Abbiamo detto che per calcolarle bisogna dividere la massa di carbonato per il suo peso formula (ricavato prima):
Convertire dunque la massa in moli significa trovare quante molecole ci sono nel campione, ed è il primo passo da fare per iniziare qualsiasi calcolo chimico (chiamato calcolo stechiometrico).
A questo punto potremo chiederci: se usassimo quella quantità di carbonato per innescare la reazione proposta prima, quanti grammi di HCl dovremmo usare? Ora che conosciamo le moli di Na2CO3 sappiamo che dobbiamo usarne il doppio di quelle di HCl, stando ai coefficienti stechiometrici della reazione Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2.
Ed ora che abbiamo le moli di acido possiamo scoprire quanto pesano moltiplicandole per la massa molare dell'HCl, così da trovare i grammi da utilizzare per la reazione.
Con lo stesso metodo si possono prevedere anche le masse dei prodotti che si otterranno:
A questo punto possiamo verificare uno dei principi fondamentali della chimica: la conservazione della massa. Sommando assieme i pesi dei reagenti e confrontandolo con il peso totale dei prodotti possiamo notare che essi sono uguali:
| Reagenti | Prodotti | |||
|---|---|---|---|---|
| Na2CO3 | 10,0000000 g + | NaCl | 11,0293424 + | |
| HCl | 6,8798926 g = | H2O | 1,6982734 g + | |
| CO2 | 4,1522785 g = | |||
| 16,87989 g | 16,87989 g [25] | |||
Da questa dimostrazione, data sperimentalmente da Antoine Lavoisier negli anni 80 del XVIII secolo, deriva una famosa locuzione.
Tornando ad osservare l'equazione di reazione è possibile notare due cose importanti, che aiutano a spiegare il motivo per cui la massa dei prodotti e quella dei reagenti sono uguali.[26]
- Il numero di atomi si conserva: i mattoncini fondamentali che costituiscono la materia saranno sempre quelli. L'unica differenza è che saranno raggruppati in molecole più o meno grandi. Questo fatto è necessario per rendere vera l'equazione di reazione: gli atomi scritti a sinistra dell'equazione dovranno essere tanti quanti sono alla destra di essa, alimenti l'equazione di reazione è stata scritta in maniera sbagliata.
- Il numero di molecole non si conserva:
Da qua bisogna ricordarsi di leggere il rapporto stechiometrico non come numero esatto di molecole, ma come rapporto tra le molecole che reagiscono, cioè non è necessario che una mole esatta di carbonato di sodio reagisca con due moli esatte di composto, ma con il doppio di moli di acido cloridrico.
Questa considerazione, apparentemente scontata, va tenuta sempre a mente quando si leggono le equazioni di reazione, che possono essere scritte in diversi modi, purché i coefficienti stechiometrici siano sempre nello stesso rapporto fra loro:
Anche se l'esempio riportato a destra sembra un po' forzato, capiterà spesso di incontrare coefficienti frazionali nelle equazioni di reazione, così come capiterà spessissimo di non lavorare su intere moli di reagente ma su porzioni di esse. L'importante è che ogni volta le moli usate siano in proporzione come scritto nel rapporto stechiometrico (nell'esempio, l'equazione a destra usa la metà delle moli di HCl usate nella prima, e di conseguenza ne usa la metà di quelle di carbonato e produce la metà dei prodotti).
Alcuni tipi di reazione chimica
L'equilibrio chimico
Prevedere il risultato di una reazione
Acidi e basi
Note
- ↑ In realtà vi è una leggerissima differenza, ma a livelli di laboratorio domestico, o anche solo di laboratorio scolastico, essa è impercettibile.
- ↑ Una tavola periodica completa stampabile è disponibile qui.
- ↑ In verità anche questi orbitali sono di tipi diversi, e gli elettroni tendono ad occupare tutti quelli di un tipo, poi quelli di un altro fino a completare il livello. Tuttavia questi dettagli non sono necessari per l'utilizzo di questo manuale. Per approfondire si legga Chimica per il liceo.
- ↑ Attualmente il numero massimo di elettroni che un atomo può utilizzare in legami è 8. Tale stato è molto raro e poco stabile. Alcuni esempi sono tetraossido di osmio, tetraossido di rutenio e tetraossido di xeno.
- ↑ Due terre rare che creano molecole stabili in cui essi mettono in gioco 6 e 7 elettroni sono rispettivamente uranio e torio.
- ↑ Gli altri elementi possono trovarsi come atomi solati solo in condizioni estreme. Per esempio, all'interno del sole la temperatura è tale che la materia si ritrova in stato di plasma, e cioè elettroni e nuclei atomici fluttuano liberi senza riuscire a legarsi in maniera stabile. Tuttavia tali condizioni sono molto difficili da riprodurre in un normale laboratorio chimico.
- ↑ Si noti che i legami chimici sono sempre formati da due elettroni, non c'è mai un solo elettrone che tene cinti due atomi insieme, ma vanno sempre a formare doppietti elettronici.
- ↑ Si noti che nelle due immagini la struttura di Lewis è leggermente diversa: per questioni di spazio i doppietti elettronici possono essere rappresentati con delle stanghette attorno al simbolo atomico. Gli elettroni appaiati in un legame chimico vengono invece rappresentate con delle linee che collegano i due elementi. Gli elettroni invece ceduti da un atomo diventato ipervalente (in questo caso il cloro) vengono contrassegnati con una freccia, e a volte, per segnalare che sono passati da un atomo ad un altro, la freccia è rivolta verso una x che simboleggia la vacanza elettronica nell'atomo accettore (il fluoro nelle immagini). Si veda Struttura di Lewis su Wikipedia e Lewis structures su commons.
- ↑ Dall'inglese Valence Shell Electron Pairs Repulsion: repulsione dei doppietti elettronici di valenza.
- ↑ Per una lista completa e maggiori informazioni si veda CPK coloring su en.Wikipedia.
- ↑ Nei libri può essere presente l'uno o l'altro valore: un legame chimico è generalmente ionico quando la Δe.n. arriva ad 1,6-1,7 ma alcuni composti risultano molecolari fino a Δe.n. 1,9.
- ↑ Perciò nelle formule di struttura si usa disegnare i due ioni separati (es. Na+NO3-) invece che le stanghette, per sottolineare la (quasi totale) assenza di condivisione dell'elettrone fra anione e catione. Nell'immagine a sinistra per esempio abbiamo quattro legami covalenti tra un atomo di azoto e carbonio, mentre il quinto ionico tra cloro e azoto non è segnato da una stanghetta, ma ai due ioni viene assegnata solo la carica elettrica. Lo stesso accade nell'immagine più a destra nella galleria: il cloruro di ammonio è composto da ioni NH4+ (legame N-H covalente, tre polari ed uno dativo) e ioni Cl- uniti solo dalle rispettive cariche elettrostatiche.
- ↑ Animazione
- ↑ Si veda anche Sulfide su en.Wikipedia.
- ↑ Si ricorda che il legame ionico è sempre un legame forte ma non genera molecole, ed ogni ione è legato da forze elettrostatiche identiche ai dipoli molecolari (solo più forti).
- ↑ "Molecola" tra virgolette perché, come detto in precedenza, i composti ionici non sono molecole, e in questo caso la formula condensata esprime solo il loro rapporto di combinazione.
- ↑ Fa eccezione l'idrogeno, in composti come CH4 ed NH3, che per ragioni storiche sono lasciati scritti in tal modo.
- ↑ I.U.P.A.C. Sta per "International Union of Pure and Applied Chemistry" (Unione internazionale di chimica pura e applicata) la quale è l'ente che stabilisce le convenzioni internazionali riguardanti la chimica teorica e pratica.
- ↑ Esistono composti in cui lo stato di ossidazione dell'elemento non segue le regole consuete, e tali casi spesso evadono la nomenclatura tradizionale (per quelli verranno usate le due nomenclature spiegate nei paragrafi successivi).
- ↑ Il concetto di acidità verrà spiegato più avanti.
- ↑ Esistono anche acidi contenenti quattro elementi, come il clorosolfonico e il tiofosforico ma sono raramente incontrati in un semplice laboratorio.
- ↑ Nel linguaggio scientifico peso e massa sono due concetti differenti: la massa esprime la quantità di materia, in multipli e sottomultipli del grammo; il peso invece è la forza con cui due corpi si attraggono per gravità, magnetismo ecc. e si misura in Newton. Per non avere confusione in testa basta tenere a mente che ciò che stiamo pesando su una bilancia in chimica viene chiamato massa e non peso, ma solo perché le bilance sono regolate per ricavare tale quantità subendo la forza attrattiva della Terra. Se si andasse su un altro pianeta, la Luna per esempio, il peso misurato dalla bilancia sarebbe diverso; indicherebbe una massa diversa perché la forza peso con cui la Luna ed il campione si attraggono reciprocamente è diversa. Ma la quantità di materia (massa) sarebbe sempre quella.
- ↑ Come detto nel capitolo La struttura degli atomi ogni elemento può avere più isotopi, cioè atomi con nuclei aventi un numero diverso di neutroni, e quindi peso diverso! Le masse atomiche riportate sulla tavola periodica sono quindi masse relative all'abbondanza degli isotopi che compongono l'elemento. Per esempio il silicio possiede tre isotopi stabili, 28Si (14 n), 29Si (15 n) e 30Si (16 n). Quindi la massa di una mole di silicio sarà composta dal peso di ogni isotopo in percentuali diverse (tale massa comunque è uguale per qualsiasi campione, dato che l'abbondanza di ogni isotopo è equamente distribuita su tutto il pianeta).
- ↑ Nell'equazione, il × 2 è il rapporto stechiometrico dell' NaCl: Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2.
- ↑ Non sono state scritte le ultime due cifre della massa (26 e 43 rispettivamente) perché la differenza fra i sue pesi è dovuta solo all'approssimazione della calcolatrice e poteva confondere.
- ↑ In realtà i seguenti postulati non danno una vera spiegazione alla domanda perché nel nostro universo la massa non può scomparire? ma ne dà una abbastanza semplice, intuitiva e sufficientemente esaustiva.
















![Cloruro di ammonio, [NH4]+Cl-](http://upload.wikimedia.org/wikipedia/commons/thumb/4/48/NH4Cl.png/120px-NH4Cl.png)
![Solfato rameico, Cu2+[SO4]2-](http://upload.wikimedia.org/wikipedia/commons/thumb/6/67/Copper%28II%29-sulfate-3D-vdW.png/104px-Copper%28II%29-sulfate-3D-vdW.png)
![Nitrato di potassio K+[NO3]-](http://upload.wikimedia.org/wikipedia/commons/thumb/0/09/Potassium-nitrate-unit-cell-3D-vdW.png/120px-Potassium-nitrate-unit-cell-3D-vdW.png)