Biologia per istituti tecnici/L'acqua
L'acqua è molto importante per gli esseri viventi, poiché rappresenta il componente più abbondante. Senza l'acqua (soprattutto in forma liquida) la vita non potrebbe esistere.
Struttura della molecola
[modifica | modifica sorgente]

L'acqua è una molecola, formata da due atomi di idrogeno legati ad un atomo di ossigeno. La formula chimica più semplice con cui viene rappresentata è H2O, detta formula grezza ("grezza" perché si osserva solo il tipo e il numero di atomi legati tra loro).
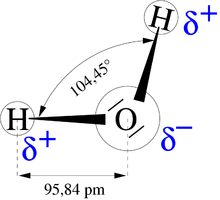
La formula di struttura invece fa notare che gli idrogeni sono legati agli ossigeni con un legame covalente ciascuno e questi legami formano un angolo di circa 104°. Il legame covalente si rappresenta graficamente con una linea nera.
Il legame covalente è un tipo di legame chimico che avviene quando due atomi si scambiano tra di loro due o più elettroni. Lo scambio di elettroni obbliga i due atomi a restare uniti. Gli elettroni scambiati si muovono da un atomo all'altro però nel caso dell'acqua i due atomi sono diversi (idrogeno e ossigeno) ed essi passano più tempo vicino all'ossigeno. Essendo gli elettroni negativi fanno sì che l'ossigeno presenti una parziale carica negativa e, di conseguenza, i due idrogeni presentano una parziale carica positiva. La molecola d'acqua diventa così una molecola polare, con un polo negativo e due poli positivi.
Legame a idrogeno
[modifica | modifica sorgente]
La conseguenza più importante del fatto che la molecola di ossigeno presenta cariche positive e negative è che si formano dei legami elettrostatici tra le molecole, poiché la carica positiva è attratta da quella negativa. Il legame che si forma si chiama legame a idrogeno e si forma quindi tra l'idrogeno di una molecola e l'ossigeno di un'altra molecola che si trova nelle vicinanze. Una singola molecola d'acqua può fare al massimo quattro legami a idrogeno e nell'acqua liquida si formano e si rompono in continuazione (mediamente ce ne sono 2,4). Nel ghiaccio i quattro legami si formano tutti e diventano stabili.
Proprietà principali
[modifica | modifica sorgente]La presenza dei legami a idrogeno tra le molecole determina tutte le principali proprietà dell'acqua.
Coesione e adesione
[modifica | modifica sorgente]
La coesione è la forza che tiene unite molecole dello stesso tipo. Nel caso dell'acqua la coesione è determinata dai legami a idrogeno. Questa forza fa sì che le molecole tendono a stare unite anche quando ci sono forze contrastanti. Ad esempio quando si riempie un contenitore di acqua fino al bordo in realtà lo si può superare senza che l'acqua fuoriesca.


L'adesione invece è la forza che tiene unite molecole, sostanze di tipo diverso, ad esempio acqua e vetro. Una goccia rimane attaccata al vetro grazie a queste forze.
Tensione superficiale
[modifica | modifica sorgente]Nella superficie dell'acqua le molecole sono legate tra loro grazie ai legami a idrogeno e questo determina la formazione di una specie di pellicola elastica invisibile. Questo fenomeno si chiama tensione superficiale. La tensione superficiale è utilizzata dagli insetti per pattinare sull'acqua senza sprofondare. Oppure si riesce a far galleggiare un graffetta di metallo o una piccola moneta (che essendo più denso dovrebbe sprofondare). Le gocce d'acqua tendono ad essere sferiche anche grazie a questa "pellicola" invisibile (ma anche a causa delle forze di coesione).
I tensioattivi, come i saponi e i detergenti in generale, sono sostanze che diminuiscono o eliminano la tensione superficiale.



Capillarità
[modifica | modifica sorgente]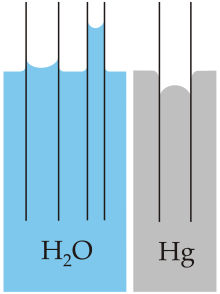
Se si immerge parzialmente in acqua un tubicino di vetro (in verticale) si osserva che l'acqua risale un po'. Tanto più è stretto, tanto più risale. Questo fenomeno si chiama capillarità ed è una conseguenza dei fenomeni di coesione e adesione che agiscono contemporaneamente quando l'acqua si trova in un contenitore stretto come un tubo. L'adesione fa sollevare i bordi dell'acqua sulla parete e la coesione si tira dietro anche l'acqua che sta sotto.
Densità
[modifica | modifica sorgente]La densità esprime il rapporto tra massa e volume di un corpo. d=m/V. Nel caso dell'acqua la densità è di circa 1g/cm3 (= 1kg/dm3 = 1kg/L).
La massima densità viene raggiunta allo stato liquido a 4°C (ed è una eccezione rispetto al comportamento di altre sostanze). La tabella sottostante mostra le diverse densità alle varie temperature. Il ghiaccio è meno denso poiché quando si stabilizzano i legami a idrogeno, le molecole devono allontanarsi un po' diminuendo la densità. Il ghiaccio infatti galleggia.
| Temperatura (°C) | Densità (g/cm3) | Volume specifico (cm3/g) |
|---|---|---|
| 100 | 0,9584 | 1,0434 |
| 80 | 0,9718 | 1,0290 |
| 60 | 0,9832 | 1,0171 |
| 40 | 0,9922 | 1,00786 |
| 30 | 0,9956502 | 1,00437 |
| 25 | 0,9970479 | 1,00296 |
| 22 | 0,9977735 | 1,00223 |
| 20 | 0,9982071 | 1,001796 |
| 15 | 0,9991026 | 1,000898 |
| 10 | 0,9997026 | 1,000297 |
| 4 | 0,9999720 | 1,0000280 |
| 0 | 0,9998395 | 1,00016 |
| −10 | 0,998117 | 1,001886 |
| −20 | 0,993547 | 1,006495 |
| −30 | 0,983854 | 1,01641 |
Soluzioni
[modifica | modifica sorgente]Una soluzione è un miscuglio omogeneo tra due sostanze (e quella più abbondante viene definita solvente). L'acqua è un ottimo solvente per tutte le sostanze polari, per esempio i sali, grazie alle cariche positive e negative che le molecole presentano. Il disegno mostra come le molecole con le loro cariche riescono a circondare e portare in soluzione uno ione.


Esercizi sull'acqua
[modifica | modifica sorgente]Nella pagina Esercizi sull'acqua puoi svolgere alcuni esercizi on-line riguardo all'argomento.
