Propulsione aerea/Capitolo I°
Struttura della materia
[modifica | modifica sorgente]Una sostanza qualsiasi è concepita come un sistema meccanico formato da un numero enorme di particelle: queste sono le molecole.
Ciascuna molecola è formata da uno o più atomi della stessa specie o specie diversa, collegati tra loro da forze di natura elettrica.
L'atomo, secondo le attuali vedute, è costituito da da un nucleo e da elettroni (atomi di elettricità) esterni al nucleo; il nucleo è costituito a sua volta, sempre secondo le attuali vedute, da un insieme di neutroni e protoni tra loro associati da forze di "contatto" ancora non bene chiarite; neutroni e protoni hanno quasi la stessa massa mentre l'elettrone ha massa quasi duemila volte più piccola del protone.
Il protone ha una carica elettrica uguale e contraria (positiva) a quella dell'elettrone (negativa); ne viene che in un atomo non ionizzato si hanno protoni ed elettroni in ugual numero. Il numero di protoni del nucleo definisce le caratteristiche chimiche dell'elemento e rappresenta il rango dell'elemento nella scala periodica di Mendeleieff; il numero dei neutroni di un nucleo può variare entro limiti ristretti avendosi così elementi di pari comportamento chimico e diverso peso atomico (isotopi, cioè occupanti lo stesso posto nella successione di Mendeleieff).
Per esempio l'idrogeno pesante è il primo isotopo dell'idrogeno.
Nuclei ed elettroni sono a distanze relative grandissime (in scala atomica s'intende). La materia che ai nostri sensi appare compatta e continua, in realtà è vuota e discontinua.
Un atomo può perdere uno o più elettroni: allora dicesi ionizzato. Alcuni elettroni possono vibrare per cause svariate senza dissociarsi dal nucleo; l'atomo in qiesto caso assorbe o irradia energia elettromagnetica (raggi visibili, ultravioletti, infrarossi, X, gamma, ecc.). Atomi di uguale o diversa natura possono associarsi per interazione tra gli elettroni esterni ai nuclei; nascono così le molecole dei corpi semplici e composti; la valenza sarebbe quindi un fatto legato alle interazioni degli elettroni dei vari atomi. Si spiegano così le reazioni della chimica.
Se il numero delle cariche del nucleo varia per un motivo qualsiasi cambia la natura fisica dell'elemento; è questa la trasformazione degli elementi, oggetto dello studio della fisica nucleare.
Quello che importa osservare è che tutte queste associazione dissociazioni di atomi o nuclei si effettuano con assorbimento o emissione di energia.
Atomi o molecole sono sistemi complessi, costituiti di particelle di materia, elettricità, energia.
Nelle trasformazioni nucleari (atomiche) le energie in gioco sono enormemente più grandi che nelle trasformazioni molecolari (si confronti per esempio l'effetto a pari peso di un esplosivo atomico e di uno molecolare).
Nelle usuali trasformazioni chimiche o reazioni chimiche che dir si voglia, non si hanno trasformazioni dei nuclei, cioè degli atomi, ma trasformazioni delle molecole; in altre parole vengono soltanto interessati gli elettroni esterni di ogni atomo.
Materia ed energia
[modifica | modifica sorgente]Nello studio dei fenomeni fisici, i concetti di materia ed energia sono fondamentali; in verità non si conosce l'intima essenza della materia e dell'energia; forse non la si conoscerà mai malgrado i meravigliosi sviluppi della fisica.
Una fondamentale conquista della scienza fu la scoperta della legge della conservazione della materia (Lavoisier); seguì la scoperta della legge della conservazione dell'energia (Helmholtz e altri).
Questi due cardini fondamentali di filosofia naturale sembravano distinti seppure interdipendenti. L'indagine dei rapporti tra materia ed energia (w:energia raggiante|raggiante in particolare) condussero alla veduta attuale secondo la quale esiste un solo principio universale, la conservazione simultanea della energia e della materia, meglio della massa e dell'energia (Einstein); massa ed energia sono quindi due aspetti di un'unica realtà fisica; in accordo con i risultati della fisica relativistica si dimostra che esiste un rapporto costante tra massa ed energia; precisamente, indicando con ΔE e Δm gli incrementi di energia e di massa si ha:
con C velocità della luce;la fisica relativistica mostra che la velocità della luce è la massima velocità possibile nel mondo fisico; quindi se due masse reagendo emettono energia (per esempio comburente e combustibile) la massa finale risulterà ridotta della quantità
viceversa se assorbono energia.
Per esempio circa 16 kg di miscela aria+benzina, nel giusto rapporto stechiometrico, emettono circa 10.000 Cal = 4.270.000 kgm.
La massa quindi verrebbe ridotta di
e si dovrebbe constatare la perdita di peso di 4,7×9,81×10-11 kg = 4,6×10-7 grammi, cioè 46 milionesimi di grammo su 16 kg di quantità che sfugge a ogni più sensibile controllo sperimentale; nei fatti nucleari però la legge di Einstein è stata sperimentalmente controllata poiché allora i rapporti tra massa ed energia in gioco sono sensibili.
Nei fenomeni della tecnica corrente le deviazioni dalla legge fondamentale sono inapprezzabili e si possono considerare valide separatamente le due leggi della conservazione della massa e della energia.
Usualmente l'energia si definisce come l'attitudine a produrre lavoro meccanico; l'energia può essere di natura diversa: muscolare, meccanica, termica, elettrica, magnetica, nucleare, elettromagnetica, chimica, molecolare, nucleare, ecc.; tuttavia queste forme possono, con opportuni processi fisici e chimici, mutarsi l'una nell'altra secondo un tasso ben definito quando si usino unità di misura caratteristiche del tipo di energia.
Le trasformazioni usuali più importanti che interessano la tecnica attuale in genere partono dall'energia termica in senso lato che viene trasformata in energia meccanica utile direttamente o con una trasformazione intermedia, elettrica; l'energia meccanica, a sua volta, si trasforma, con vicende più o meno complesse, in energia termica difficilmente riutilizzabile come energia meccanica.
Generalmente le trasformazioni di energia non sono mai complete; parte dell'energia di una specie si trasforma in misura maggiore o minore in forme non desiderate. È possibile però sempre la completa trasformazione di ogni specie di energia in calore.
Il tasso di trasformazione dell'energia termica in meccanica, del calore cioè in lavoro, è chiamato equivalente meccanico del calore; per ogni chilocaloria si hanno 427 kgm circa.
Struttura dei gas
[modifica | modifica sorgente]Il gas è un sistema materiale costituito da numerosissime molecole libere guizzanti entro tutto lo spazio del sistema che le racchiude. Le molecole del gas possono essere monoatomiche, biatomiche, triatomiche e in genere poliatomiche.
Monoatomiche sono le molecole dei gas rari(elio, argon, ecc.); biatomiche quelle dei gas idrogeno, ossigeno, azoto, ossido di carbonio, ecc; triatomiche quelle del gas d'acqua, anidride carbonica; a quattro atomi l'ammoniaca, a cinque il metano, ecc.
Spesso il gas è un miscuglio di gas di diversa natura.
Ad alta temperatura le molecole possono dissociarsi; cioè possono ad alta temperatura venire meno i legami tra gli elettroni esterni degli atomi e le molecole ridursi in maggiore o minore percentuale a molecole più semplici o addirittura in atomi.
Nel gas la coesione tra le molecole è praticamente nulla.
Le molecole nel loro moto disordinato si urtano scambievolmente e colpiscono le pareti del recipiente che le racchiude; la pressione del gas è dovuta proprio a questi urti incessanti di tipo elastico con le pareti; dato il grandissimo numero di molecole e la frequenza altissima degli urti, non è possibile avvertire in scala macroscopica la discontinuità intrinseca del fenomeno; così un manometro fornisce un valore fisso e costante della pressione; se il manometro fosse di dimensioni molecolari allora sarebbe possibile mettere in luce il numero discreto degli urti e quindi le fluttuazioni della pressione.
Quando le molecole vengono in collisione tra loro, si scambiano energia cinetica, di traslazione e rotazione (per le molecole poliatomiche) come corpi perfettamente elastici; si tenga ben presente che le molecole hanno dimensioni estremamente piccole rispetto alle distanze che le dividono. La traiettoria di una molecola deve essere dunque pensata come una spezzata irregolare; a ogni vertice corrisponde un urto con altra molecola, urto che modifica la direzione e grandezza della velocità.
È bene avvertire che l'urto delle molecole in realtà non è dovuto a contatto materiale così come avviene per una palla elastica macroscopica che ne urti un'altra; l'incontro di due molecole non è altro che un avvicinamento a brevissima distanza che provoca l'insorgere di azioni elettriche repulsive dovute alle cariche elettriche intrinseche degli atomi.
L'esperienza mostra che un velo sottilissimo di molecole del gas ambiente aderisce fermamente, sempre per azioni elettriche, alle molecole della superficie di un corpo solido: l'urto delle molecole sulle pareti solide è quindi in sostanza un urto tra le molecole del gas aderenti alla superficie solida.
Poiché il numero delle molecole presenti in un definito volume è ingente si può pensare in scala macroscopica il gas costituito da una distribuzione continua di fluido caratterizzato da certi parametri fisici; questa comoda raffigurazione permette di formulare leggi semplici sul comportamento dei gas; queste semplici leggi sono quindi statistiche e valide per stati non estremamente condensati o rarefatti. La verifica sperimentale dell'esistenza degli atomi e delle molecole data da pochi decenni mentre le leggi statistiche di insieme sono di data assai più antica. Va da sé che le leggi macroscopiche statistiche debbono essere giustificate dalle leggi riguardanti il comportamento medio dei singoli costituenti. Partendo da queste considerazioni è possibile definire il comportamento dei gas così detti ideali o perfetti.
I gas perfetti
[modifica | modifica sorgente]Perfetti sono detti per definizione i gas caratterizzati dalle seguenti proprietà:
- Possono trasmettere solamente sforzi normali (di pressione) e non possono trasmettere sforzi tangenziali; i gas ideali sono concepiti quindi privi di attrito o viscosità come suol dirsi;
- La pressione per ciascun punto della massa è la stessa in qualsiasi direzione (principio di Pascal);
- sono omogenei e isostropi in ogni punto;
- obbediscono alla legge generale di stato
Poiché v=1/(ρ g) la precedente espressione può anche essere scritta
- p=pressione
- ρ=densità (massa dell'unità di volume)
- v=volume specifico (volume dell'unità di peso)
- T=temperatura assoluta
- R=costante
- J=equivalente meccanico del calore
- g=accelerazione di gravità
Le dimensioni di p in unità tecniche sono kg/m², di v: m³/kg, di J: kgm/cal di T(temperatura assoluta): K. Si ricava per le dimensioni di R
Le dimensioni di R sono quindi quelle di un calore specifico (calorie divise per kg e per temperatura); vedremo precisamente che R è differenza tra due calori specifici detti a volume costante e a volume costante.
L'equazione (1) per T costante rappresenta la legge di Boyle-Mariotte; per v o p costante la legge di Gay-Lussac.
Se del gas sono prese quantità pari all'unità di peso, la R varia con la natura del gas; se invece sono presi in considerazione pesi pari al peso molecolare cioè proporzionali al peso della singola molecola, la R è una costante universale, indipendente dalla natura del gas; sia B questa costante.
Per convincersi che la B è veramente indipendente, si rammenti la legge di Avogadro "Volumi uguali di gas diversi, nelle stesse condizioni di temperatura e pressione, contengono un numero uguale di molecole". Ne segue che i pesi di uguali volumi sono proporzionali ai rispettivi pesi molecolari.
Se adesso si prendono in considerazione pesi di gas diversi contenenti lo stesso numero di molecole, proporzionali quindi al peso molecolare, se ne conclude che hanno lo stesso volume v, sempre naturalmente a parità di pressione e temperatura.
Se V è il volume della kg-mol la legge dei gas va scritta
Il volume della kg-mol, per T = 273 K (0 °C) e p = 10300 kg/m², è uguale a circa 22,4 m³.
Ne segue:
B ha le dimensioni di un calore specifico riferito al peso della kg-molecola.
Generalmente nei calcoli tecnici ci si riferisce all'unità di peso del gas e non al peso della kg-mol: cioè si usa applicare la (1) e non la (2). Dividendo la (2) per la (1) si ha:
Ma V/v, rapporto tra volume della kg-mol e volume della unità di peso, è niente altro che il peso molecolare M (peso della kg-molecola); ne segue che il prodotto di R per M è costante per ogni gas. Quindi:
La (1) può scriversi quindi:
Alcuni dati:
- Per l'aria M=28,96 kg; l'aria è un miscuglio di gas diversi, in prevalenza ossigeno e azoto.
- Per l'azoto (molecola biatomica), poiché il peso atomico è 14, M=28 kg.
- Per l'ossigeno (molecola biatomica) poiché il peso atomico è 16 M=32 kg.
- Per l'ottano C8H18=8×12+18×1,008≅114,14 kg.
È facile quindi calcolare il peso della kg-mol, noti i pesi atomici dei costituenti la molecola è facile calcolare il peso molecolare dei miscugli note le percentuali dei componenti.
I gas reali e la viscosità
[modifica | modifica sorgente]La legge pv=J R T è tanto più verificata quanto più il gas è lontano dalle condizioni critiche, cioè quanto più alta è la temperatura e moderata la pressione; per i valori che questi parametri assumono nelle macchine termiche la legge di Boyle-Mariotte rappresenta una eccellente approssimazione così come mostrano i risultati sperimentali.
Se invece il gas si trova sotto alte pressioni o basse temperature, cioè se il gas si trova in uno stato condensato, il volume proprio delle molecole (covolume) incomincia ad avere un valore sensibile rispetto al volume del recipiente e le forze di coesione, nulle per il gas perfetto, incominciano ad avere influenza apprezzabile.
Partendo da queste considerazioni Van der Waals arrivò alla celebre equazione che porta il suo nome:
a è una costante che rappresenta l'effetto della coesione che risulta inversamente proporzionale al quadrato del volume: b è un'altra costante che permette di tenere conto dell'effetto del volume proprio delle molecole. Queste costanti sono precisate sperimentalmente per ogni gas; evidentemente per v molto grande, cioè per moderate pressioni,
tende a zero, b diviene trascurabile rispetto a v e l'equazione di Van der Waals viene a coincidere con quella limite pv=JRT dei gas perfetti.
L'equazione (3) non viene di regola impiegata nello studio delle macchine termiche che interessano la tecnica della locomozione terrestre, marittima e aerea; essa però ha molta importanza per le macchine frigorifere, di liquefazione dei gas, e per tutti i processi che presentano stati condensati del gas.
Il gas ideale è concepito privo di attrito interno, di viscosità; in realtà i gas sono dotati di viscosità, viscosità che si manifesta quando strati di gas a contatto posseggono velocità relative; per convincersi di questo, si rammenti che un gas è formato con molecole in continua agitazione con velocità distribuite secondo la legge del caso; quando due strati a contatto hanno velocità globali relative diverse, si ha scambio di molecole tra essi proprio per effetto dell'agitazione intrinseca; lo strato a velocità maggiore riceve molecole con velocità più piccole e viceversa; ne nasce per questo fatto un frenamento reciproco con conseguente dissipazione della loro energia meccanica che viene trasformata in calore.
Maxwell definì viscosità lo sforzo tangenziale τ per unità di superficie che si esercità tra due piani a distanza unitaria con differenza di velocità unitaria; naturalmente lo spazio tra i due piani è pieno di gas. La viscosità usa indicarsi col simbolo μ; le sue dimensioni scaturiscono dalla definizione stessa; in unità forza (f), lunghezza (l), tempo (t): per le dimensioni di μ si ha:
- .
La viscosità dei gas cresce con la temperatura poiché cresce la velocità propria di agitazione delle molecole; quella dei liquidi diminuisce. Nelle trattazioni scientifiche e tecniche compare spesso la cosiddetta viscosità cinematica, rapporto tra viscosità assoluta μ e densità ρ; questo rapporto
gioca un ruolo importantissimo nei fatti fluidodinamici.
Alcuni risultati importanti della teoria cinetica dei gas
[modifica | modifica sorgente]La teoria della materia allo stato gassoso è più facile a concepirsi e a svilupparsi per la mancanza delle forze di coesione imponenti negli altri stati condensati, liquidi e solidi.
Maxwell per primo edificò la teoria cinetica, completata poi da altri illustri fisici (Boltzmann, Van der Waals, Lorenz, ecc.); la teoria cinetica fu il primo passo verso l'atomismo.
Come già detto, le molecole hanno moti di traslazione, di rotazione attorno al proprio centro di gravità e inoltre moti interni tra le varie particelle costituenti ciascuna molecola e atomi.
Quando un gas racchiuso in un recipiente è mantenuto a temperatura costante assume uno stato permanente macroscopicamente uniforme; a prima vista sembrerebbe impossibile poter determinare la distribuzione della velocità delle molecole ma non è così; Maxwell trovò la legge di distribuzione delle velocità; questa legge è statistica, cioè non riguardante l'individuo ma percentuali sulla totalità presente.
Data la natura di queste note non si entra in sviluppi o dettagli ma si riportano alcuni risultati.
L'energia cinetica di traslazione di una molecola è
se m è la massa e v la velocità in atto; l'energia cinetica della massa del gas è data dalla somma delle energie delle singole molecole; questa somma può essere pensata uguale a
con M massa del gas e vrms Velocità quadratica media.
La pressione del gas, come già detto, è dovuta al bombardamento delle pareti da parte delle molecole; la teoria cinetica mostra che la pressione p è data dalla
con ρ densità del gas e vrms, velocità quadratica media, avanti definita.
D'altro canto la legge dei gas perfetti riferita alla kg/mol è p V=J B T come mostrato; sostituendo per p il valore precedente, si trova
ma ρ V è la massa M/g della kg/mol; ne segue la relazione:
L'energia cinetica di traslazione propria delle molecole costituenti la kg/mol, alla stessa temperatura, è uguale per tutti i gas: a 0 °C questa energia è circa 346.000 kgm/(kg/mol) però non è utilizzabile dato il moto disordinato delle molecole.
Se si indica con N il numero delle molecole della kg/mol(N è il numero di Avogadro), l'energia cinetica media di una molecola vale
B/N è detta costante di Boltzmann.
Poiché la quantità in parentesi è uguale per ogni gas, se ne deduce che la temperatura assoluta del gas è proporzionale alla energia cinetica media delle molecole; è questa la famosa interpretazione cinetica della temperatura del gas.
Il numero N è cira 6,0210×1023 per kg/mol.
La velocità del suono
[modifica | modifica sorgente]Tutti gli aggregati materiali sono elastici; non esistono corpi pefettamente rigidi in natura.
Una qualsiasi perturbazione di piccola intensità si propaga in seno alla materia con una certa velocità che dipende dalla densità e dalle caratteristiche elastiche del materiale. Si dimostra in Meccanica che la velocità di propagazione delle perturbazioni di piccola ampiezza dipende dalla densità ρ e dal modulo di elasticità longitudinale E secondo la formula:
Il modulo di modulo di elasticità longitudinale è il rapporto tra lo sforzo unitario di trazione o compressione e la relativa deformazione (allungamento o accorciamento percentuale); E si misura quindi in kg/m 2. Per i liquidi e i gas il modulo di elasticita ha senso fisico solamente per la compressione.
Per l'acqua, per esempio, E=212.000.000 kg/m2;
quindi
Questa è la velocità di propagazione delle piccole perturbazioni nell'acqua; se la perturbazione ha la frequenza compresa tra quelle udibili, Vs è niente altro che la velocità di propagazione del suono nell'acqua. Vs è però sempre la velocità del suono anche per le frequenze non udibili (infrasuoni e ultrasuoni).
Per l'acciaio E=20.000.000.000 kg/m2
quindi
La velocità del suono è tanto più alta quanto più è rigido e leggero il corpo; per i corpi perfettamente rigidi la velocità sarebbe infinita.
Dal punto di vista fisico le molecole a contatto con la sorgente perturbatrice trasmettono la perturbazione con oscillazioni attorno alla loro posizione di equilibrio; si ha quindi un susseguirsi di compressioni e dilatazioni di debole intensità che viaggiano in seno al corpo proprio con la velocità Vs.
I gas sono caratterizzati da una grande compressibilità e, come si è visto, il loro stato fisico dipende da due dei tre parametri p,v,T. Quando la perturbazione si manifesta in seno al gas, si hanno variazioni non solo di p e v, ma anche di T; il fenomeno non è dunque isotermico come a prima vista potrebbe sembrare; esso è invece un fatto fisico senza apporto o perdita di calore, è senza degradazione interna di energia; è isentropico come suol dirsi, cioè senza variazione di entropia; su questo significato sarà discusso nei capitoli seguenti.
Il modulo di elasticità per i gas può essere ricavato con le seguenti considerazioni; si supponga di avere un cilindro pieno di gas a pressione p con un pistone a tenuta, mobile a una estremità; spostando il pistone nel senso di aumentare il volume di una piccola corsa dl nel senso di aumentare il volume del gas la pressione diminuisce, cioè subirà l'incremento -dp. Se l è la lunghezza del cilindro di volume v si ha per la definizione stessa di E:
La legge della trasformazione isoentropica, come si vedrà avanti, è data dalla pvk=cost con k costante, differenziando si ha
cioè
Il modulo di elasticità per i gas è allora
la costante k è il rapporto tra il calore specifico a pressione costante e quello a volume costante. La velocità del suono nei gas diviene esplicitamente:
Tenuta presente la legge di stato (1) si trova in funzione di T
Sempre dall'equazione isoentropica, nella forma pρ-k=cost, differenziando si ottiene,
da queste si ricava inoltre:
La(6) mostra che la velocità del suono nei gas dipende dalla natura del gas (costanti k e R) e dalla radice quadrata della temperatura assoluta.
Per esempio, per l'aria k=1,4 e R=1,985/28,5 (cal/(kg x K) si ha la nota formula
- m/sec
- a 273 K; Vs ≅340 m/s ≅1200 km/h
- a -55 °C = 218 K (stratosfera), Vs≅300 m/s≅1080 km/h.
Dal confronto dell'espressione (4) o (5) con la (6) si deduce
La velocità del suono è proporzionale secondo la costante alla velocità quadratica media vrms del caos molecolare; per l'aria (miscuglio biatomico) si trova, a 0 °C, vrms=490 m/s, K=1,4: poiché come già visto.
Resta confermato quindi che la velocità di propagazione delle perturbazioni di piccola ampiezza in seno a un gas sono legate allo stato di agitazione delle molecole e quindi alla radice quadrata della temperatura assoluta.
Il numero di Mach
[modifica | modifica sorgente]Per definizione si chiama numero di Mach e lo si indica con M il rapporto tra la velotità relativa di un corpo in un gas e la velocità del suono nello stesso gas nelle condizioni di stato non perturbate dalla presenza del corpo stesso.
Mach fu un ufficiale austriaco di artiglieria che per primo mise nella dovuta luce l'importanza che ha la velocità del suono sulla resistenza aerodinamica dei proiettili.
Il numero di Mach riveste una importanza fondamentale nella formulazione concettuale e analitica dei fatti dell'aerodinamica, della gasdinamica, della balistica e in genere di tutti i fenomeni di interazione tra solidi e gas in moto relativo.
Se M<1 le velocità sono dette subsoniche; se M>1, supersoniche.
Risulta quindi:
Si è visto che, secondo la teoria cinetica dei gas, la temperatura assoluta è una misura della energia cinetica posseduta dalle molecole nel loro moto disordinato; precisamente se vrms è la velocità media quadratica, si ha (formula 7)
quindi
Il numero di Mach ha quindi una interpretazione fisica ben precisa; il quadrato di esso è proporzionale al rapporto tra l'energia cinetica di traslazione delle molecole, corrispondente alla velocita V di insieme, e l'energia cinetica intrinseca, dovuta al loro moto disordinato, al caos molecolare. Da notare che nelle formulazioni analitiche M entra sempre al quadrato, così come si vedrà.
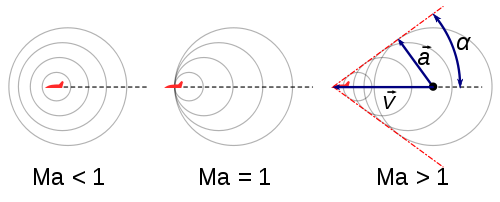
Supponiamo di avere una sorgente sonora in seno a un gas.
Se la sorgente si muove con velocità V la perturbazione sonora avanza con la velocità vs-V: le onde di propagazione mostrano l'andamento tracciato nella figura M<1.
Quando V=vs, cioè M=1, l'andamento è segnato nella figura M=1.
Se V>vs la perturbazione è tutta contenuta entro il cono d'inviluppo delle sfere di perturbazione che crescono di raggio proporzionalmente al tempo Fig(M>1) contato a partire dall'istante di formazione.
Entro il cono si ha rumore, fuori silenzio; l'apertura del cono diminuisce col crescere della velocità di traslazione della sorgente; per V=vs (fig.M=1) il cono degenera in un piano normale alla direzione di V e il suono rimane contenuto nel semispazio interessato.
Questo cono è chiamato Cono di Mach. Se α è la metà dell'angolo di aperture, si vede che
Vi è analogia tra le onde superficiali di un liquido e le onde spaziali in seno a un gas. Non si confonda il Cono di Mach' col cono delle onde d'urto.
Il numero di Mach avanti definito si riferisce alla velocità relativa non perturbata dalla presenza del corpo; la presenza del corpo di dimensioni finite ha l'effetto di incrementare (in senso vettoriale) la velocità dei vari filetti fluidi e gli incrementi sono più sensibili nelle vicinanze del corpo. Si avranno in certi punti del contorno dell'ostacolo aumenti locali della velocità rispetto alla V di traslazione, per esempio sul dorso delle ali, lungo il contorno di corpi affusolati, ecc.; la velocità del filetto fluido che lambisce la superficie aumenta mentre la temperatura diminuisce per effetto dell'espansione; se ne conclude che al crescere di V già con corrente subsonica si raggiungerà localmente la velocità del suono.
Si defisce N° di Mach locale, Machloc, il rapporto tra la velocità locale del suono per le condizioni del gas nel posto considerato. Si avrà quindi in certi posti Mloc>1 mentre M è ancota <1. La velocità V di traslazione del corpo, alla quale corrisponde per una certa incidenza per la prima volta in un posto qualsiasi Mloc=1, è detta velocità critica.
L'atmosfera tipo
[modifica | modifica sorgente]Le condizioni di temperatura, pressione, umidità, ecc. variano irregolarmente durante la giornata e con le stagioni.
Allo scopo di rendere confrontabili le prove, le esperienze, le caratteristiche di volo degli aeromobili e dei gruppi propulsori, ecc. è stata definita una atmosfera tipo, riconosciuta internazionalmente; questa atmosfera il più vicino possibile ai valori medi delle nostre latitudini è definita come segue:
- accelerazione di gravità invariabile con la quota uguale a 9,80665 m/s²
- aria asciutta a quota zero: T=288 K (15 °C), p=760 mmHg, ρ=0,125 kg s²/m³
- da quota zero a 11.000 m., la temperatura diminuisce gradualmente in ragione di 6,5 °C ogni 1000 m.
Con queste condizioni si ha fino a 11.000 m, con Z altezza in metri (atmosfera politropica):
Da quota 11.000 a 20.000 metri la temperatura si assume costante (atmosfera isoteerma); t= -55 °C. Con questa condizione si trova (con log. decimali)
Le formule precedenti servono a costruire la tabella dell'aria tipo sino a 20.000 metri. Tutti i calcoli concreti vengono fatti impiegando queste tabelle e tutte le caratteristiche di volo vengono fornite in aria tipo.
Si riportano alcuni dati concreti per la pressione, la densità e le temperature effettive e relative.
| H (metri) | p () | T (K) | ||||
|---|---|---|---|---|---|---|
| 0 | 10332 | 1,000 | 0,125 | 1,000 | 288,0 | 1,000 |
| 1000 | 9120 | 0,887 | 0,113 | 0,907 | 281,5 | 0,977 |
| 2000 | 8080 | 0,785 | 0.103 | 0.821 | 275,0 | 0.955 |
| 3000 | 7100 | 0,692 | 0,693 | 0,742 | 268,5 | 0,932 |
| 4000 | 6250 | 0,608 | 0,084 | 0,670 | 262,0 | 0,909 |
| 5000 | 5500 | 0,533 | 0,075 | 0,600 | 255,5 | 0,887 |
| 6000 | 4800 | 0,466 | 0,067 | 0,538 | 249,0 | 0,864 |
| 8000 | 3610 | 0,351 | 0,054 | 0,429 | 236,0 | 0,819 |
| 10000 | 2675 | 0,260 | 0,042 | 0,337 | 223,0 | 0,774 |
| 15000 | 1220 | 0,119 | 0,02 | 0,158 | 218,0 | 0,756 |
| 20000 | 556 | 0,054 | 0,009 | 0,072 | 218,0 | 0,756 |