Laboratorio di chimica in casa/I legami chimici
I legami che tengono insieme atomi e molecole prendono nomi diversi a seconda delle loro caratteristiche e possono essere distinti in due categorie principali: legami intramolecolari (cioè fra gli atomi di una molecola) e intermolecolari (cioè fra gli atomi di molecole diverse).
Nel capitolo precedente si è paragonato il legame chimico ad un tiro alla fune, e infatti gli atomi tendono ad attirare verso di sé gli elettroni. Ma come spesso accade anche nel tiro alla fune, ci sono atomi che esercitano un'attrazione maggiore di altri sugli elettroni di legame.
Tale forza di attrazione si chiama elettronegatività ed è uno dei valori generalmente riportati sulle tavole periodiche:
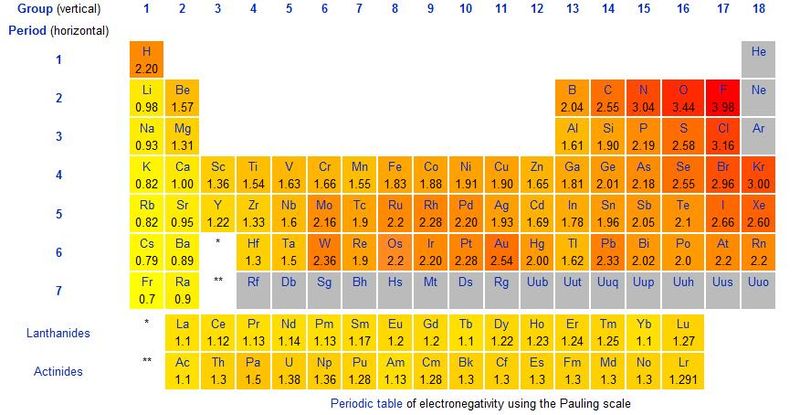
Esistono tanti modi per misurare questa forza e perciò nella storia sono state stilate diverse liste di valori di elettronegatività degli elementi. Quella comunemente usata è quella di Linus Pauling, tabulata nella tavola periodica sopra riportata. Essa è un valore adimensionale (cioè un numero, senza unità di misura) che esprime la forza con cui un nucleo tende ad attrarre un elettrone cedutogli dall'esterno.
Quando due elementi aventi elettronegatività diverse si uniscono uno dei due tende ad attrarre di più l'elettrone dell'altro. Ciò conferisce ai due elementi legati una caratteristica fondamentale: il numero di ossidazione. Tale valore indica il numero di elettroni che l'atomo ha acquistato o ceduto nel legame (anche se i due elementi li stanno comunque mettendo in compartecipazione).

È Il valore assoluto della differenza di elettronegatività fra due elementi che ci indica che tipo di legame li unisce.

I legami intramolecolari
[modifica | modifica sorgente]Anche se un legame chimico rimane sempre l'attrazione che due nuclei esercitano su una coppia di elettroni, la differenza di forza attrattiva fra i due cambia in maniera drastica le proprietà della molecola. Per questo motivo i chimici dividono per convenzione i legami in tre categorie basandosi sull'elettronegatività e su altri fattori minori:
- Covalente puro

Due atomi sono uniti da un legame covalente puro quando la differenza di elettronegatività è compresa tra 0 e 0,4. Esempi di legami puri sono quelli fra atomi dello stesso elemento (O=O, H-H, Cl-Cl, I-I, N≡N, ...) o fra elementi con elettronegatività molto simili (C-H, P-H, N-Cl, S-I, S-P, ...).
Tale legame chimico non lascia scoperta la carica dei due nuclei atomici, e così le molecole presentano basse attrazioni elettrostatiche fra di loro.
-
Molecola dell'ossigeno gassoso (modello a sfere e bastoncini)
-
Molecola dello zolfo solido
-
Arsina, composta da arsenico (e.n. 2,18 in viola) e idrogeno (e.n. 2,2 in bianco)
-
Tricloruro di azoto, composto da cloro e azoto (e.n. 3,04 in blu)
- Covalente polare

Quando la differenza di elettronegatività fra i due elementi è compresa tra 0,4 e 1,7 o 1,9 (in alcuni testi sono riportati valori diversi) si dice che il legame covalente è polare. In un legame polare, una coppia di elettroni tende ad orbitare "dalla parte" dell'elemento più elettronegativo. In questo modo la carica del nucleo dell'elemento meno elettronegativo può risultare scoperta, non bilanciata dalle cariche negative degli elettroni che ora si trovano ad orbitare più vicini ad un altro atomo, e risulta carico positivamente (l'altro invece si carica negativamente). Questa differenza di attrazione si traduce in un legame in cui l'elettrone orbita per più tempo attorno all'atomo più elettronegativo.
-
Diossido di zolfo, composto da zolfo e ossigeno (Δe.n. 0,86)
-
Acqua, composta da ossigeno e idrogeno (Δe.n. 1,24)
-
Cloruro di boro, composto da cloro e boro (Δe.n. 1,12)
-
Anidride carbonica, composto da carbonio e ossigeno (Δe.n. 0,89)
- Ionico


Quando la differenza di elettronegatività fra i due elementi è maggiore di 1,7/1,9[1] il legame è classificato come ionico. I due atomi sono sempre legati tramite una forza elettrostatica, ma l'elettrone sarà quasi completamente deviato verso l'elemento più elettronegativo. [2]
La caratteristica principale dei composti ionici è quella di possedere un reticolo cristallino polimerico (detto lattice) in cui gli atomi si dispongono in maniera regolare attratti reciprocamente l'un l'altro dalle rispettive forze elettrostatiche, senza formare singole molecole. Si tenga comunque presente che un minimo carattere covalente (cioè di condivisione dell'elettrone) è presente in qualsiasi composto ionico, come nelle molecole, l'unica differenza è che ogni ione è attratto dagli altri con la stessa forza (cosa che non accade nei solidi composti da vere molecole) formando un lattice polimerico in cui non sono distinguibili singole molecole.
Gli ioni presenti nei solidi ionici possono contenere legami covalenti di diverso tipo. Tali ioni sono chiamati complessi. Esempi molto comuni sono il catione ammonio NH4+ e gli ossoanioni SO42-, NO3-, PtCl42- ecc. I composti chimici derivati sono comunque classificati come composti ionici.
-
Fluoruro di calcio, composto da fluoro e calcio (Δe.n. 2,98)
-
Ossido di sodio, composto da ossigeno e sodio (Δe.n. 2,51)
-
Fluoruro di cesio, composto da cesio e fluoro (Δe.n. 3,19)
-
Cloruro di ammonio, [NH4]+Cl-
-
Solfato rameico, Cu2+[SO4]2-
-
Nitrato di potassio K+[NO3]-
- Dativo
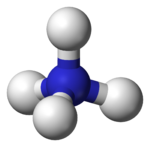
Il legame dativo, già menzionato prima, è un legame covalente in cui un atomo sottrae un doppietto elettronico ad un altro atomo che ha già completato l'ottetto.
Questo legame può essere visto da due punti di vista: all'atomo centrale può essere rubato un elettrone da un atomo legante (caso del perclorato sopra riportato e dei fluoruri di cloro visti prima) oppure si può avere il caso inverso, in cui un nucleo positivo attrae a sé il doppietto elettronico di un altro atomo avente già l'ottetto completo (caso dell'idrogeno che ruba un doppietto elettronico all'azoto nella molecola dell'ammoniaca). Quest'ultimo caso una volta era classificato separatamente dal primo (anche perché di solito il legame è più debole rispetto al primo caso), e le molecole come NH4+ erano detti complessi. Ora tale termine è esteso a tutte le molecole.
- Metallico

Da notare che anche i metalli hanno un reticolo cristallino, come i composti ionici, ed anche in essi gli atomi si trovano sotto forma di ioni, poiché gli elettroni che dovrebbero bilanciare la loro carica elettrostatica sono sparsi nello spazio che c'è fra atomo e atomo. Il legame metallico si mantiene anche quando più metalli sono fusi in una lega.
Negli elementi allo stato metallico (e nelle leghe) gli elettroni di valenza degli atomi non sono vincolati da orbitali di legame fissi come nelle molecole covalenti o negli ioni ma si muovono liberi nel reticolo cristallino del metallo saltando di atomo in atomo, come fossero un liquido. Per tale motivo i metalli sono in grado di condurre l'elettricità, risultano facilmente plasmabili e fusibili.[3]
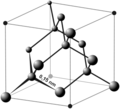
- Solido reticolare covalente
I solidi covalenti reticolari sono solidi costituiti da un reticolo cristallino, come i composti ionici, ma i cui atomi sono uniti da legami covalenti. Esempi di tali solidi sono il diamante, nitruro di boro, carburo di silicio ecc.
- Vi sono inoltre composti al limite fra ionici e covalenti reticolari, come i solfuri e gli ossidi dei metalli di transizione, che generalmente sono classificati come ionici ma presentano notevoli caratteristiche covalenti.[4]
Legami intermolecolari
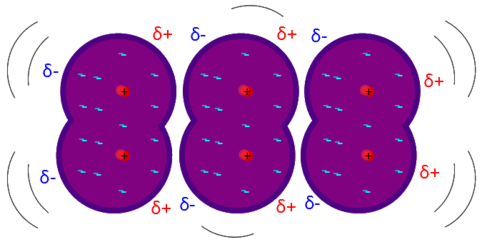
[modifica | modifica sorgente]La carica elettrica rimasta sbilanciata da un legame polare può espandersi anche all'esterno della molecola. Essa risulta quindi polarizzata, come una calamita, con una parte negativa ed una positiva.
 |
 |

|
| I numeri in piccolo sono le elettronegatività degli atomi. | ||
La forza di tali campi elettrici non è data dalla sola polarità del legame ma è drasticamente influenzata dalla geometria della molecola: Se l'attrazione esercitata dagli atomi è perfettamente bilanciata, il campo elettrico verrà annullato esattamente come in un tiro alla fune, e la molecola risulterà di conseguenza apolare. Nella tabella qui sotto sono riportati alcuni esempi di molecole, tutte con legami molto polari, ma quelle a sinistra non risultano polarizzate a causa della loro geometria. La polarità viene confrontata con i punti di fusione ed ebollizione: più sono alti, più la molecola è polare.
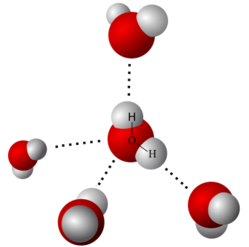
Le forze di attrazione dovute alla polarità ed alla geometria dei legami vengono chiamati dipoli permanenti e permettono alle molecole di essere attratte le une dalle altre tendendo ad aggregarsi. Abbiamo visto per esempio l'acqua, liquida fino a 100 °C o i composti ionici solidi.[5]
A queste si aggiungono altre forze di attrazione a corto raggio chiamati dipoli momentanei (o forze di Van der Waals) dovuti appunto al momentaneo sbilanciamento delle cariche elettriche della molecola. Questo a causa delle vibrazioni del nucleo e degli elettroni (Forza di London), o influenzate dai dipoli permanenti di molecole vicine (Forza di debye).
-
Dipoli permanenti nelle molecole di acqua (Legame a idrogeno).
-
Legame fra uno ione ed i dipoli permanenti delle molecole di acqua.
-
I dipoli permanenti dell'acqua attraggono gli elettroni di una molecola di cloro inducendo in essa dei dipoli momentanei (Forza di debye).
-
Dipoli momentanei causati dalle oscillazioni del nucleo in molecole di iodio, che causano lo spostamento delle nuvole elettroniche delle molecole vicine. (Forza di London).
Tali forze sono molto meno potenti dei dipoli momentanei, ma sono molto risentite da molecole dall'alto peso molecolare (lo iodio elementare per esempio è solido, al contrario degli altri alogeni come fluoro e cloro).

|

|

|

Tutti questi tipi di interazioni elettrostatiche determinano in maniera notevole certe proprietà (specialmente fisiche) della sostanza:
- La polarità della molecola ne determina la solubilità in un determinato composto: sostanze ioniche come i sali tenderanno a venire sciolti da solventi molto polari come l'acqua o gli acidi, mentre i composti apolari come gli oli tenderanno a venire sciolti da altri composti apolari come la benzina.
- Più un materiale presenta rugosità, più esporrà una superficie maggiore, ricca di molecole polari la cui carica elettrostatica genererà attrito rendendo il materiale facilmente incollabile (per esempio si graffiano le gomme delle biciclette con la carta vetrata prima di tappare i buchi con pezza e colla). Alcuni animali hanno peli sulle zampe per amplificare questa forza di attrazione ed arrampicarsi su pareti verticali (il geco addirittura può camminare sul vetro)
- Nel caso di un fluido, più esso è polare, più sarà viscoso (per esempio l'acqua è meno polare e meno viscosa dell'acido solforico, e viceversa è più polare e più viscosa della benzina). La cosa, come detto prima, vale sia per i liquidi che per i gas.
Note
[modifica | modifica sorgente]- ↑ Nei libri può essere presente l'uno o l'altro valore: un legame chimico è generalmente ionico quando la Δe.n. arriva ad 1,6-1,7 ma alcuni composti risultano molecolari fino a Δe.n. 1,9.
- ↑ Perciò nelle formule di struttura si usa disegnare i due ioni separati (es. Na+NO3-) invece che le stanghette, per sottolineare la (quasi totale) assenza di condivisione dell'elettrone fra anione e catione. Nell'immagine a sinistra per esempio abbiamo quattro legami covalenti tra un atomo di azoto e carbonio, mentre il quinto ionico tra cloro e azoto non è segnato da una stanghetta, ma ai due ioni viene assegnata solo la carica elettrica. Lo stesso accade nell'immagine più a destra nella galleria: il cloruro di ammonio è composto da ioni NH4+ (legame N-H covalente, tre polari ed uno dativo) e ioni Cl- uniti solo dalle rispettive cariche elettrostatiche.
- ↑ Animazione
- ↑ Si veda anche Sulfide su en.Wikipedia.
- ↑ Si ricorda che il legame ionico è sempre un legame forte ma non genera molecole, ed ogni ione è legato da forze elettrostatiche identiche ai dipoli molecolari (solo più forti).











![Cloruro di ammonio, [NH4]+Cl-](http://upload.wikimedia.org/wikipedia/commons/thumb/4/48/NH4Cl.png/120px-NH4Cl.png)
![Solfato rameico, Cu2+[SO4]2-](http://upload.wikimedia.org/wikipedia/commons/thumb/6/67/Copper%28II%29-sulfate-3D-vdW.png/104px-Copper%28II%29-sulfate-3D-vdW.png)
![Nitrato di potassio K+[NO3]-](http://upload.wikimedia.org/wikipedia/commons/thumb/0/09/Potassium-nitrate-unit-cell-3D-vdW.png/120px-Potassium-nitrate-unit-cell-3D-vdW.png)