Dizionario chimico divulgativo/A
| A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z |
Acetale
[modifica | modifica sorgente]
A-ce-tà-le (![]() /
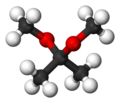
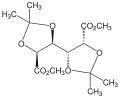
/![]() ): è il nome di un insieme di gruppi funzionali costituiti da un carbonio legato a due ossigeni tramite legami singoli e a due atomi di carbonio e/o di idrogeno tramite gli altri due.[1] L'immagine a destra rappresenta un generico acetale. I due gruppi R1 e R2 possono essere idrogeni (es. dimetossimetano[2]) o atomi di carbonio (es. 2,2-dimetossipropano[3]).
): è il nome di un insieme di gruppi funzionali costituiti da un carbonio legato a due ossigeni tramite legami singoli e a due atomi di carbonio e/o di idrogeno tramite gli altri due.[1] L'immagine a destra rappresenta un generico acetale. I due gruppi R1 e R2 possono essere idrogeni (es. dimetossimetano[2]) o atomi di carbonio (es. 2,2-dimetossipropano[3]).
Se questi due gruppi sono identici il composto è detto acetale simmetrico altrimenti è un acetale asimmetrico. Anche ai due ossigeni possono essere collegate una o due molecole organiche . Nel caso in cui uno dei gruppi -OR fosse un -OH, il gruppo funzionale è detto emiacetale ma se entrambi -OR1 ed -OR2 fossero gruppi -OH allora il gruppo funzionale non sarebbe più un acetale ma un gemdiolo.
Tali gruppi funzionali derivano dalla condensazione di un carbonile (aldeide o chetone) con una o due molecole di alcol. Nel caso in cui l'acetale derivasse da un chetone, viene utilizzato il termine più specifico "chetale".[4]
Tali gruppi funzionali sono caratteristici dei monosaccaridi ciclici (es. glucosio) e dei farmaci benzodiossolici.
-
Dimetossimetano, acetale in cui al carbonio sono collegati due idrogeni (R1 ed R2) e due gruppi metossido (OR1 ed OR2).
-
Dimetossipropano, acetale in cui al carbonio sono collegati due carboni (R1 ed R2) e due metossidi (OR1 ed OR2).
-
Il glucosio contiene un gruppo emiacetalico nel suo ciclo.
-
Benzodiossolo, un derivato del benzene.
-
Diossolano, un acetale ciclico.
Acetiluro
[modifica | modifica sorgente]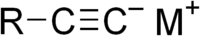
A-ce-ti-lù-ro (![]() /
/![]() ): anione derivato dalla salificazione di un alchino. Gli acetiluri per antonomasia sono quelli derivati dall'acetilene, ma il termine è stato esteso ai sali di qualsiasi altro alchino terminale. Questi a volte vengono chiamati alchinuri ma il termine è improprio.
): anione derivato dalla salificazione di un alchino. Gli acetiluri per antonomasia sono quelli derivati dall'acetilene, ma il termine è stato esteso ai sali di qualsiasi altro alchino terminale. Questi a volte vengono chiamati alchinuri ma il termine è improprio.
Acetonide
[modifica | modifica sorgente]
A-ce-tò-ni-de (![]() /
/![]() ): Gruppo funzionale derivato dall'acetone (è il suo chetale) utilizzato come groppo protettivo per gli alcoli.
): Gruppo funzionale derivato dall'acetone (è il suo chetale) utilizzato come groppo protettivo per gli alcoli.
Assegna inoltre il nome ad una categoria di corticosteroidi in cui esso svolge la funzione di migliorarne l'assorbimento attraverso la pelle.
-
Molecola dell'acetone.
-
Fluclorolone acetonide, un corticosteroide contenente il gruppo acetonide.
-
Fluocinolone acetonide, un corticosteroide acetonide.
-
Triamcinolone acetonide, un corticosteroide acetonide.
-
Due gruppi acetonidi proteggono i gruppi ossidrile della molecola di acido galattarico.
Acidi grassi
[modifica | modifica sorgente]À-ci-di gràs-si (![]() ): acidi monocarbossilici (cioè con un solo gruppo carbossile) non ramificati, con un numero pari di atomi di carbonio che va solitamente da 4 a 28, con o senza insaturazioni, presenti in forma esterificata nei trigliceridi e nelle cere, o comunque derivati da essi.
): acidi monocarbossilici (cioè con un solo gruppo carbossile) non ramificati, con un numero pari di atomi di carbonio che va solitamente da 4 a 28, con o senza insaturazioni, presenti in forma esterificata nei trigliceridi e nelle cere, o comunque derivati da essi.
Acidità
[modifica | modifica sorgente]A-ci-di-tà (![]() /
/![]() ): caratteristica di una sostanza di avere proprietà acide.
): caratteristica di una sostanza di avere proprietà acide.
HA + B → A- + HB+ es. HCl + H2O → Cl- + H3O+
Come mostrato nella reazione sopra riportata, un generico acido a contatto con una sostanza è in grado di dissociarsi in un H+ (che si lega alla sostanza accettrice) e nella rispettiva base coniugata A-. in questo modo l'acidità di una sostanza può essere:
- La quantità di ioni H+ in essa disciolti, se si sta parlando di una soluzione acida (aceto, succo di limone, succhi gastrici...) solitamente espressa con la scala del pH. Per esempio, il succo di limone è meno acido dei succhi gastrici perché l'acido in esso contenuto è meno concentrato, oppure i saponi devono avere lo stesso pH della pelle, cioè né più né meno acidi.
- La capacità di un acido di dissociare un protone e legarlo ad una sostanza con cui viene messo a contatto. Per esempio, HCl è una molecola più acida di HF perché il primo tende a rilasciare il suo H+ più facilmente di HF.
Acido
[modifica | modifica sorgente]À-ci-do (![]() /
/![]() ):Esistono due definizioni di acido.
):Esistono due definizioni di acido.
- Generalmente per acido si intende un composto chimico in grado di rilasciare ioni H+ quando messo a contatto con un'altra sostanza (es. H2SO4, HCN, HCl, HNO3) in questo caso si parla di acido del tipo "di Arrhenius" (
 ) o di Brønsted-Lowry (
) o di Brønsted-Lowry ( ).
). - Secondo invece la teoria di Lewis (
 ), dicesi acido qualsiasi sostanza in grado di attirare a sé una coppia di elettroni (es. H+, Fe3+, Cu2+, BF3, PtCl4). Tale definizione è un'espansione di quella precedente poiché l'H+ rilasciato dagli acidi di Brønsted attira a sé una coppia di elettroni esattamente come fanno altri ioni positivi e molecole elettrondeficienti.
), dicesi acido qualsiasi sostanza in grado di attirare a sé una coppia di elettroni (es. H+, Fe3+, Cu2+, BF3, PtCl4). Tale definizione è un'espansione di quella precedente poiché l'H+ rilasciato dagli acidi di Brønsted attira a sé una coppia di elettroni esattamente come fanno altri ioni positivi e molecole elettrondeficienti.
L'acido acetico (in figura) è un acido di Brønsted perché è in grado di cedere uno ione H+ ad altre sostanze, per esempio all'acqua.

La teoria di Lewis spiega il compostamento sia degli acidi contenenti ioni H+ di Brønsted che di innumeri altri composti che non rilasciano ioni H+ ma che attirano i doppietti elettronici di altre molecole.
-
Lo ione Cu2+ quando sciolto in acqua attrae un doppietto elettronico da sei molecole di solvente.
-
Ione Cu2+ che attira i doppietti solitari di quattro molecole di ammoniaca.
-
Addotto BF3-NH3 in cui il trifluoruro di boro è l'acido di Lewis e l'ammoniaca la base. Da notare che nessuno dei due composti è uno ione e nessuno dei due segue la teoria Brønsted-Lowry.
-
Addotto in cui l'anidride solforica si lega al doppietto elettronico dell'azoto nella molecola della piridina.
-
Ferricianuro di potassio, dove lo ione Fe3+ del cianuro ferrico attrae a sé altri tre ioni cianuro, formando un sale complesso.
Vedi anche: base, anfotero, elettrofilo
Acido carbossilico
[modifica | modifica sorgente]À-ci-do car-bos-sì-li-co (![]() /
/![]() ): composto organico caratterizzato dal gruppo funzionale -COOH (detto "carbossile", da cui il nome), il quale impartisce il carattere acido a tale composto.
): composto organico caratterizzato dal gruppo funzionale -COOH (detto "carbossile", da cui il nome), il quale impartisce il carattere acido a tale composto.
Acile
[modifica | modifica sorgente]A-cì-le (![]() /
/![]() ): gruppo funzionale derivato dalla privazione d'un gruppo idrossilico da un acido carbossilico.
): gruppo funzionale derivato dalla privazione d'un gruppo idrossilico da un acido carbossilico.
Acqua di cristallizzazione
[modifica | modifica sorgente]Acqua di cris-tal-liz-za-ziò-ne (![]() ): acqua che rimane inglobata nel reticolo cristallino di una sostanza quando questa solidifica.
): acqua che rimane inglobata nel reticolo cristallino di una sostanza quando questa solidifica.
Adiabatico
[modifica | modifica sorgente]A-dia-bà-ti-co (![]() /
/![]() ): un processo (ad esempio una reazione chimica o una trasformazione termodinamica) è detto adiabatico quando avviene senza scambio di calore con l'esterno.
): un processo (ad esempio una reazione chimica o una trasformazione termodinamica) è detto adiabatico quando avviene senza scambio di calore con l'esterno.
Adsorbimento
[modifica | modifica sorgente]
Ad-sor-bi-mèn-to (![]() /
/![]() ): accumulo di particelle di una sostanza (adsorbato) sulla superficie di un materiale solido (substrato adsorbente).
): accumulo di particelle di una sostanza (adsorbato) sulla superficie di un materiale solido (substrato adsorbente).
Se tale assorbimento non modifica la natura chimica delle due sostanze, si ha un adsorbimento fisico, altrimenti si ha un adsorbimento chimico.
- Tale fenomeno chimico-fisico viene sfruttato per la purificazione delle sostanze liquide: all'interno di una soluzione viene versata una sostanza solida molto porosa (carbone attivo,[5] Fe(OH)2, gel di silice ecc.) in grado di assorbire e trattenere il particolato che si vuole eliminare. Il tutto può essere poi facilmente rimosso per decantazione, filtrazione ecc.
- Esso è di fondamentale importanza anche nella chimica dei catalizzatori, i quali possono essere depositati su una superficie adsorbente, che trattiene le molecole che devono reagire per più tempo nelle cavità dove subiscono l'effetto del catalizzatore, o l'adsorbente può essere il catalizzatore stesso (platino nell'idrogenazione, magnetite nel processo Haber-Bosh).
Vedi anche: desorbimento, chelante, cromatografia, legame intermolecolare
Aerosol
[modifica | modifica sorgente]Aglicone
[modifica | modifica sorgente]A-gli-cò-ne (![]() /
/![]() ): un glicoside è una molecola in cui sono riconoscibili una o più molecole di un glucide legate ad una molecola che non è uno zucchero. Quest'ultima (isolabile a seguito dell'idrolisi del glicoside) è chiamata aglicone.
): un glicoside è una molecola in cui sono riconoscibili una o più molecole di un glucide legate ad una molecola che non è uno zucchero. Quest'ultima (isolabile a seguito dell'idrolisi del glicoside) è chiamata aglicone.
Numerose molecole biologiche possono assumere il ruolo di aglicone: steroidi, cianidine, antrachinoni, cumarine ecc.

Alambicco
[modifica | modifica sorgente]Alcaloide
[modifica | modifica sorgente]Al-ca-lòi-de (![]() /
/![]() ): gli alcaloidi sono una famiglia eterogenea di composti, solitamente di origine vegetale, accomunati dall'avere nella loro struttura molecolare un atomo di azoto che li conferisce proprietà più o meno basiche.
): gli alcaloidi sono una famiglia eterogenea di composti, solitamente di origine vegetale, accomunati dall'avere nella loro struttura molecolare un atomo di azoto che li conferisce proprietà più o meno basiche.
Alcano
[modifica | modifica sorgente]Al-cà-no (![]() /
/![]() ): Idrocarburo non ciclico che non contiene doppi o tripli legami tra atomi di carbonio contigui.
): Idrocarburo non ciclico che non contiene doppi o tripli legami tra atomi di carbonio contigui.
Alchene
[modifica | modifica sorgente]Al-ché-ne (![]() /
/![]() ): Idrocarburo non ciclico che contiene almeno un doppio legame tra atomi di carbonio contigui.
): Idrocarburo non ciclico che contiene almeno un doppio legame tra atomi di carbonio contigui.
Alchilazione
[modifica | modifica sorgente]Alchile
[modifica | modifica sorgente]Al-chì-le (![]() /
/![]() ): gruppo funzionale formato da una molecola d'un alcano privato d'un solo atomo d'idrogeno.
): gruppo funzionale formato da una molecola d'un alcano privato d'un solo atomo d'idrogeno.
Alchilico
[modifica | modifica sorgente]| Al-chì-li-co: vedi il lemma Alchile. |
Alchino
[modifica | modifica sorgente]Al-chì-no (![]() /
/![]() ): Idrocarburo non ciclico che contiene almeno un triplo legame tra atomi di carbonio contigui.
): Idrocarburo non ciclico che contiene almeno un triplo legame tra atomi di carbonio contigui.
Alchino terminale
[modifica | modifica sorgente]Al-chì-no terminà-le (![]() ): alchino in cui si ha un triplo legame tra un carbonio terminale (cioè posizionato in corrispondenza di un estremo della catena di atomi di carbonio) e un atomo di carbonio ad esso contiguo.
): alchino in cui si ha un triplo legame tra un carbonio terminale (cioè posizionato in corrispondenza di un estremo della catena di atomi di carbonio) e un atomo di carbonio ad esso contiguo.
Alchinuro
[modifica | modifica sorgente]| Al-chi-nù-ro: vedi il lemma Acetiluro. |
Alcol
[modifica | modifica sorgente]
Àl-col (![]() /
/![]() ): composto organico caratterizzato dalla presenza di un gruppo ossidrile legato alla catena carboniosa. L'alcol più semplice è l'alcol metilico (o metanolo), di formula CH3OH.
): composto organico caratterizzato dalla presenza di un gruppo ossidrile legato alla catena carboniosa. L'alcol più semplice è l'alcol metilico (o metanolo), di formula CH3OH.
Alcool
[modifica | modifica sorgente]| Al-cool: vedi il lemma Alcol. |
Alcossido
[modifica | modifica sorgente]Aldeide
[modifica | modifica sorgente]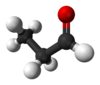
Al-dèi-de (![]() /
/![]() ): composto organico avente il gruppo carbonilico (C=O) legato a un atomo di idrogeno. A differenza dei chetoni, quindi, il carbonile è posto alla fine della catena. L'aldeide più semplice è l'aldeide formica (o metanale) di formula CH2O.
): composto organico avente il gruppo carbonilico (C=O) legato a un atomo di idrogeno. A differenza dei chetoni, quindi, il carbonile è posto alla fine della catena. L'aldeide più semplice è l'aldeide formica (o metanale) di formula CH2O.
Alifatico
[modifica | modifica sorgente]A-li-fà-ti-co (![]() /
/![]() ): aggettivo con cui ci si riferisce a tutti i composti non aromatici.
): aggettivo con cui ci si riferisce a tutti i composti non aromatici.
Allele
[modifica | modifica sorgente]Allele
Allile
[modifica | modifica sorgente]Allile
Allotropia
[modifica | modifica sorgente]| Al-lo-tro-pì-a: vedi il lemma Allotropo. |
Allotropo
[modifica | modifica sorgente]Al-lò-tro-po (![]() /
/![]() ): sono allotrope fra loro due o più sostanze formate da un solo elemento chimico (semplici) in cui gli atomi sono legati in maniera diversa.
): sono allotrope fra loro due o più sostanze formate da un solo elemento chimico (semplici) in cui gli atomi sono legati in maniera diversa.
- Alcuni allotropi dello zolfo
-
Trizolfo (S3)
-
Cicloesazolfo (S6)
-
Cicloottazolfo (S8)
-
Ciclododecazolfo (S12)
- Alcuni allotropi del fosforo

- Alcuni allotropi del carbonio

Vedi anche: isomerio, dimorfismo
Alluminato
[modifica | modifica sorgente]Alluminio
[modifica | modifica sorgente]Al-lu-mì-nio (![]() /
/![]() ): metallo leggero e argenteo poco elettronegativo appartenente al gruppo del Boro di simbolo Al e Z 13. Il suo unico stato di ossidazione stabile è +3 ma ad alte temperature può formare composti in cui ha stato di ossidazione +1. Viene utilizzato in lega con il magnesio, il titanio ed altri metalli per la costruzione di mobili e macchine volanti. Quando esposto all'aria si ricopre di uno strato di ossido trasparente che inibisce la corrosione del metallo sottostante.
): metallo leggero e argenteo poco elettronegativo appartenente al gruppo del Boro di simbolo Al e Z 13. Il suo unico stato di ossidazione stabile è +3 ma ad alte temperature può formare composti in cui ha stato di ossidazione +1. Viene utilizzato in lega con il magnesio, il titanio ed altri metalli per la costruzione di mobili e macchine volanti. Quando esposto all'aria si ricopre di uno strato di ossido trasparente che inibisce la corrosione del metallo sottostante.
| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Alogenazione
[modifica | modifica sorgente]Alogeno
[modifica | modifica sorgente]A-lò-ge-no (![]() /
/![]() ): Elemento appartenente al VII gruppo della tavola periodica. Gli alogeni sono: fluoro (F), cloro (Cl), bromo (Br), iodio (I), astato (At).
): Elemento appartenente al VII gruppo della tavola periodica. Gli alogeni sono: fluoro (F), cloro (Cl), bromo (Br), iodio (I), astato (At).
Sono gli elementi più elettronegativi dei rispettivi periodi della tavola periodica, allo stato elementare si presentano come molecole biatomiche (Es. Cl2, I2).
Godono di forti proprietà ossidanti ed i loro idracidi (HCl, HBr ecc. tutti acidi forti tranne HF) si generano gli anioni chiamati alogenuri (Cl-, Br- ecc.).
Alogenoalcano
[modifica | modifica sorgente]A-lo-ge-no-al-cà-no (![]() ): alcano in cui un atomo di idrogeno è stato sostituito con un alogeno.
): alcano in cui un atomo di idrogeno è stato sostituito con un alogeno.
Alogenuro
[modifica | modifica sorgente]A-lo-ge-nù-ro (![]() /
/![]() ): composto chimico in cui è presente un atomo di alogeno avente numero di ossidazione pari a -1. Possono essere inorganici (come ad esempio il cloruro di sodio, NaCl o l'acido bromidrico, HBr) od organici (come il clorometano, CH3Cl).
): composto chimico in cui è presente un atomo di alogeno avente numero di ossidazione pari a -1. Possono essere inorganici (come ad esempio il cloruro di sodio, NaCl o l'acido bromidrico, HBr) od organici (come il clorometano, CH3Cl).
Ambiente acido
[modifica | modifica sorgente]Ambiente basico
[modifica | modifica sorgente]Ambiente di reazione
[modifica | modifica sorgente]Sistema in cui avviene una reazione chimica
Americio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Amfifilico
[modifica | modifica sorgente]| Am-fi-fì-li-co: vedi il lemma Anfifilico. |
Ammide
[modifica | modifica sorgente]
Am-mì-de (![]() /
/![]() ): composto organico derivato da un acido carbossilico con sostituzione del gruppo ossidrile con un gruppo amminico NRR'. Se R e R' sono entrambi atomi di idrogeno si ha un'ammide primaria, se uno di essi è una catena alchilico si ha invece un'ammide secondaria, se invece sono entrambi dei residui alchilici si parla di ammide terziaria.
): composto organico derivato da un acido carbossilico con sostituzione del gruppo ossidrile con un gruppo amminico NRR'. Se R e R' sono entrambi atomi di idrogeno si ha un'ammide primaria, se uno di essi è una catena alchilico si ha invece un'ammide secondaria, se invece sono entrambi dei residui alchilici si parla di ammide terziaria.
Ammina
[modifica | modifica sorgente]
Am-mì-na (![]() /
/![]() ): composto organico ottenuto per sostituzione formale di uno o più atomi di idrogeno della molecola di ammoniaca (NH3) con gruppi alchilici. Se è solo uno l'atomo di idrogeno sostituito si parla di ammine primarie, se sono 2 di ammine secondarie e infine se sono tutti e tre sostituiti di ammine terziarie. Hanno formula generale NRR'R'', dove R è un generico gruppo alchilico o arilico o altrimenti un atomo di idrogeno.
): composto organico ottenuto per sostituzione formale di uno o più atomi di idrogeno della molecola di ammoniaca (NH3) con gruppi alchilici. Se è solo uno l'atomo di idrogeno sostituito si parla di ammine primarie, se sono 2 di ammine secondarie e infine se sono tutti e tre sostituiti di ammine terziarie. Hanno formula generale NRR'R'', dove R è un generico gruppo alchilico o arilico o altrimenti un atomo di idrogeno.
Amminoacido
[modifica | modifica sorgente]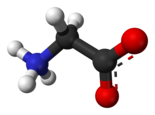
Am-mi-no-à-ci-do (![]() /
/![]() ): molecola organica contenente contemporaneamente uno o più gruppi amminici -NH2 ed uno o più gruppi carbossilici -CO2H.
): molecola organica contenente contemporaneamente uno o più gruppi amminici -NH2 ed uno o più gruppi carbossilici -CO2H.
Ventuno fra le migliaia di amminoacidi possibili sono alla base degli organismi eucarioti poiché legati insieme compongono le proteine,e perciò vengono chiamati amminoacidi essenziali o biogenici. Hanno la caratteristica di essere degli zwitterioni, perciò vengono solitamente rappresentati con il gruppo amminico protonato -NH3+ e quello carbossilico salificato -CO2-.
Vedi anche: betaina
Amminoacido biogenico
[modifica | modifica sorgente]| Am-mi-no-à-ci-do bio-gè-ni-co: vedi il lemma Amminoacido essenziale. |
Amminoacido essenziale
[modifica | modifica sorgente]Am-mi-no-à-ci-do es-sen-zià-le (![]() /
/![]() ): uno dei 21 amminoacidi con cui sono formate le proteine degli esseri viventi.
): uno dei 21 amminoacidi con cui sono formate le proteine degli esseri viventi.
Analogo
[modifica | modifica sorgente]A-nà-lo-go (![]() /
/![]() ):: composto chimico avente struttura simile ad un altro ma differente per alcune sue parti. Si usa anche il termine analogo strutturale poiché la struttura molecolare di due analoghi è simile ma al suo interno possono esservi eteroatomi e gruppi funzionali diversi.
):: composto chimico avente struttura simile ad un altro ma differente per alcune sue parti. Si usa anche il termine analogo strutturale poiché la struttura molecolare di due analoghi è simile ma al suo interno possono esservi eteroatomi e gruppi funzionali diversi.
Vedi anche: isotopologo, isomero, omologo, derivato, analogo funzionale.
Analogo funzionale
[modifica | modifica sorgente]Anfifilico
[modifica | modifica sorgente]Anfipatico
[modifica | modifica sorgente]| An-fi-pà-ti-co: vedi il lemma Anfifilico. |
Anfiprotico
[modifica | modifica sorgente]
An-fi-prò-ti-co (![]() /
/![]() ):: Una sostanza che può sia liberare che accettare ioni H+. Esempi di tali sostanze sono gli acidi parzialmente dissociati, l'acqua, gli amminoacidi ecc.
):: Una sostanza che può sia liberare che accettare ioni H+. Esempi di tali sostanze sono gli acidi parzialmente dissociati, l'acqua, gli amminoacidi ecc.
Lo ione H2PO4- (diidrogenofosfato) è una specie chimica anfiprotica:
H2PO4- + NH3 → HPO42- + NH4+ rilascio di un protone
H2PO4- + H3O+ → H3PO4 + H2O accettazione di un protone
Vedi anche: zwitterione, anfotero
Anfotero
[modifica | modifica sorgente]An-fò-te-ro (![]() /
/![]() ): sostanza chimica che può comportarsi da acido o da base a seconda della sostanza con cui reagisce.
): sostanza chimica che può comportarsi da acido o da base a seconda della sostanza con cui reagisce.
Un esempio molto comune è l'idrossido di alluminio: a contatto con un acido può rilasciare uno ione OH- e salificarsi ad Al3+ come un qualsiasi altro idrossido basico:
- Al(OH)3 + 3 HCl → AlCl3 + 3 H2O
Ma può reagire anche con le basi, in quanto l'atomo di Al3+ nel composto Al(OH)3 ha una carica positiva sufficientemente forte da attrarre uno ione OH- in più e complessarsi sotto forma di [Al(OH)4]- come un qualsiasi acido di Lewis.
(HO)3Alδ+ + δ-OH- → [Al(OH)4]-
Anche gli ioni che derivano dalla salificazione parziale di acidi deboli, come KH2PO4 (derivato da H3PO4, acido debole) possono sia accettare che cedere ioni H+ (cioè comportarsi sia da basi che da acidi di Brønsted). In questo caso si possono dire anfiprotici:
KH2PO4 + KOH → K2HPO4 + H2O Reazione con una base
KH2PO4 + HNO3 → H3PO4 + KNO3 Reazione con un acido
Vi sono infine composti che contengono sia una parte acida che una basica nella loro molecola, che si salificano l'una con l'altra (cioè l'H+ collegato alla parte acida si sposta e va ad attaccarsi alla parte basica) pur mantenendo la molecola integra. Questi sono chiamati zwitetrioni:
 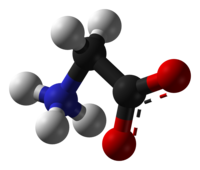
|
La glicina contiene un gruppo carbossile acido (rosso) da cui si può staccare uno ione H+ per legarsi al doppietto elettronico libero del gruppo -NH2 base di Lewis (azzurro) creando una molecola in cui coesistono uno ione -NH3+ ed un -CO2-. |
Anidride
[modifica | modifica sorgente]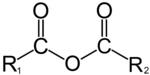
A-ni-drì-de (![]() /
/![]() ): il termine ha due significati distinti e tra loro non correlati:
): il termine ha due significati distinti e tra loro non correlati:
- in chimica inorganica con anidride si intende un ossido che a condizioni di pressione e temperatura ambiente è allo stato aeriforme; un esempio è l'anidride carbonica, CO2
- in chimica organica si tratta invece del composto ottenuto, almeno formalmente, dalla condensazione di due acidi carbossilici. Fa parte della famiglia dei composti acilici.
Anidride mista
[modifica | modifica sorgente]Anidrificazione
[modifica | modifica sorgente]Anidro
[modifica | modifica sorgente]
Àn-i-dro (![]() /
/![]() ): privo di molecole d'acqua (intesa sia come umidità o acqua disciolta [6] che come acqua di cristallizzazione [7]).
): privo di molecole d'acqua (intesa sia come umidità o acqua disciolta [6] che come acqua di cristallizzazione [7]).
Non indica invece quei composti le cui molecole sono state distrutte chimicamente per far perdere loro acqua (per esempio un ossido non è considerato la versione anidra di un idrossido né l'anidride quella di un acido e nemmeno un etere quella di un alcol).
Vedi anche: anidrificazione, idratazione, essiccatoio, idrometro, condensazione
Anione
[modifica | modifica sorgente]A-niò-ne (![]() /
/![]() ):: Ione dotato di carica negativa, ossia un atomo o una molecola avente degli elettroni "in più" rispetto al numero di protoni nel nucleo.[8]
):: Ione dotato di carica negativa, ossia un atomo o una molecola avente degli elettroni "in più" rispetto al numero di protoni nel nucleo.[8]
Esempi di anioni sono Cl-, S2-, SO42-, CO32-, AlCl4-, CuCl42-, CH3CO2- (il numero all'apice è quello degli elettroni cariche che l'entità molecolare ha in più rispetto al numero di protoni totali).
Anodo
[modifica | modifica sorgente]À-no-do (![]() /
/![]() ): componente di una pila in cui finiscono gli elettroni che scorrono nel circuito.
): componente di una pila in cui finiscono gli elettroni che scorrono nel circuito.
Anomero
[modifica | modifica sorgente]Anossia
[modifica | modifica sorgente]Antiaromaticità
[modifica | modifica sorgente]Antimarkovnikov
[modifica | modifica sorgente]Reazione che va contro la regola di Markovnikov, cioè l'idrogeno va a legarsi all'atomo di carbonio meno idrogenato
Antistaminico
[modifica | modifica sorgente]Argento
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Argon
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Arile
[modifica | modifica sorgente]A-rì-le (![]() /
/![]() ): gruppo funzionale avente un anello aromatico senza un atomo di idrogeno.
): gruppo funzionale avente un anello aromatico senza un atomo di idrogeno.
Aromaticità
[modifica | modifica sorgente]A-ro-ma-ti-ci-tà (![]() /
/![]() ): caratteristica di quei composti formati da molecole aventi gli elettroni π delocalizzati. Ciò conferisce loro particolare stabilità, tanto che danno reazioni diverse rispetto agli altri composti con atomi di carbonio ibridati sp2. Infatti mentre gli alcheni a contatto con un elettrofilo rompono il loro doppio legame e i carboni passano a un'ibridazione sp3, i composti aromatici conservano la loro struttura durante una reazione chimica, e danno quindi reazioni di sostituzione elettrofila, conservando i doppi legami. Il capostipite dei composti aromatici è il benzene.
): caratteristica di quei composti formati da molecole aventi gli elettroni π delocalizzati. Ciò conferisce loro particolare stabilità, tanto che danno reazioni diverse rispetto agli altri composti con atomi di carbonio ibridati sp2. Infatti mentre gli alcheni a contatto con un elettrofilo rompono il loro doppio legame e i carboni passano a un'ibridazione sp3, i composti aromatici conservano la loro struttura durante una reazione chimica, e danno quindi reazioni di sostituzione elettrofila, conservando i doppi legami. Il capostipite dei composti aromatici è il benzene.
Astrochimica
[modifica | modifica sorgente]Atomo
[modifica | modifica sorgente]-
Rappresentazione di un atomo 4He (non in scala)
-
Diagramma di Bohr di un atomo di litio
-
molecola di acqua, modello a calotta
À-to-mo (![]() /
/![]() ): particella più piccola di una sostanza che conserva le proprietà chimiche di un elemento.
): particella più piccola di una sostanza che conserva le proprietà chimiche di un elemento.
Esso è costituito da un nucleo formato da particelle positive (protoni) e particelle prive di carica elettrica (neutroni) cui orbitano attorno un numero di particelle negative (elettroni) solitamente uguali al numero di particelle positive (quarta immagine da sinistra).
Attraendosi fra loro, nuclei positivi ed elettroni negativi danno origine a legami detti appunto legami chimici che vanno a legare insieme gli atomi per dare origine ad una sostanza.
L'atomo, per via della sua infima massa e piccolissime dimensioni, sta al limite tra il mondo governato dalla fisica classica e quello spiegato dalla meccanica quantistica, perciò il suo comportamento a livello chimico viene spiegato dalla prima scienza (e con l'ausilio della statistica, visto che gli atomi sono piccoli, numerosi ed il loro comportamento è prevedibile solo a grandi linee) mentre quello dei suoi componenti (elettroni, protoni e neutroni) lo è dalla seconda.
La chimica studia le proprietà degli atomi e soprattutto dei legami chimici per poter trasformare una sostanza in altre, concentrandosi sulle trasformazioni delle "orbite" degli elettroni, mentre la fisica nucleare e la chimica nucleare studiano le trasformazioni dei nuclei atomici.
Vedi anche: ione, isotopo, molecola, orbitale, nuclide, atomo esotico
| Altri libri: | ||
| Chimica generale |
Chimica per il liceo |
Laboratorio di chimica in casa |
| Teoria atomicaChimica generale/Teoria atomica | Modelli atomiciChimica per il liceo/Modelli atomici | La costituzione della materiaLaboratorio di chimica in casa/La costituzione della materia |
| La struttura degli atomiLaboratorio di chimica in casa/La struttura degli atomi | ||
Atomo esotico
[modifica | modifica sorgente]Atropisomero
[modifica | modifica sorgente]Attinoide
[modifica | modifica sorgente]
At-ti-nòi-de (![]() /
/![]() ):: Gruppo di metalli radioattivi solitamente separato dalla tavola periodica, comprendente gli elementi dal n° 89 (Attinio) al n° 103 (Laurenzio).
):: Gruppo di metalli radioattivi solitamente separato dalla tavola periodica, comprendente gli elementi dal n° 89 (Attinio) al n° 103 (Laurenzio).
Vedi anche: lantanoide, elemento transuranico
Autocomplessazione
[modifica | modifica sorgente]Azide
[modifica | modifica sorgente]Azocomposto
[modifica | modifica sorgente]Azoto
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Azoturo
[modifica | modifica sorgente]Note
[modifica | modifica sorgente]- ↑ Gold Book, Acetal
- ↑
- ↑

- ↑ I due termini "chetale" ed "acetale" in passato distinguevano i derivati dai chetoni da quelli delle aldeidi, ma attualmente il termine "chetale" è ridotto a sottocategoria di acetali. Gold Book, Ketal
- ↑

- ↑ Esempi: etanolo assoluto, acido acetico glaciale, acido solforico 100%.
- ↑ solfato di rame anidro
- ↑ Essendovi più elettroni che protoni attorno all'atomo o alla molecola, rimangono non bilanciate le cariche elettriche degli elettroni, perciò l'anione è dotato di carica formale negativa, ossia quella degli elettroni
Bibliografia
[modifica | modifica sorgente]- IUPAC Gold Book online, su goldbook.iupac.org.
- Dizionario di chimica e chimica industriale online, su minerva.unito.it.
- Dizionario di italiano Sabatini Coletti online, su minerva.unito.it.
- Termini chimici su Wikizionario in italiano.
- Termini chimici di tutte le lingue su Wikizionario in inglese.