Dizionario chimico divulgativo/L
| A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z |
L è un simbolo utilizzato spesso per indicare la base coniugata (L-) di un acido di Lewis.
Lantanio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Lantanoide
[modifica | modifica sorgente]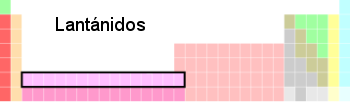
Lan-tà-noi-de (![]() /
/![]() ): Gruppo di metalli di numero atomico compreso fra 57 (Lantanio) e 71 (Lutezio). Solitamente vengono separati dalla tavola periodica per questioni di spazio.
): Gruppo di metalli di numero atomico compreso fra 57 (Lantanio) e 71 (Lutezio). Solitamente vengono separati dalla tavola periodica per questioni di spazio.
Vedi anche: attinoide, terra rara
Lattame
[modifica | modifica sorgente]Lattice
[modifica | modifica sorgente]Lattice cristallino
[modifica | modifica sorgente]Lattone
[modifica | modifica sorgente]Laurenzio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Legame
[modifica | modifica sorgente]| Le-gà-me: vedi il lemma Legame chimico. |
Legame agostico
[modifica | modifica sorgente]Legame a idrogeno
[modifica | modifica sorgente]Legame ad alogeno
[modifica | modifica sorgente]Legame alogeno
[modifica | modifica sorgente]| Le-gà-me a-lò-ge-no: vedi il lemma Legame ad alogeno. |
Legame a tre centri e due elettroni
[modifica | modifica sorgente]Legame chimico
[modifica | modifica sorgente]Le-gà-me chì-mi-co (![]() ): forza elettrostatica che tiene uniti due o più atomi per originare una sostanza. Tali legami possono essere di tipo intramolecolare, in cui gli atomi mettono in compartecipazione i propri elettroni di valenza per creare delle molecole, oppure intermolecolari in cui le molecole si attraggono fra di loro tramite legami più deboli, senza mettere in compartecipazione i propri elettroni, ma sempre attratte dalle cariche di segno opposto dei nuclei e degli elettroni.
): forza elettrostatica che tiene uniti due o più atomi per originare una sostanza. Tali legami possono essere di tipo intramolecolare, in cui gli atomi mettono in compartecipazione i propri elettroni di valenza per creare delle molecole, oppure intermolecolari in cui le molecole si attraggono fra di loro tramite legami più deboli, senza mettere in compartecipazione i propri elettroni, ma sempre attratte dalle cariche di segno opposto dei nuclei e degli elettroni.
| Altri libri: | ||
| Chimica generale |
Chimica per il liceo |
Laboratorio di chimica in casa |
| Il legame chimicoChimica generale/Il legame chimico |
I legamiChimica per il liceo/I legami | Le leggi di combinazione degli elementiLaboratorio di chimica in casa/Le leggi di combinazione degli elementi |
| I legami chimiciLaboratorio di chimica in casa/I legami chimici | ||
Legame covalente
[modifica | modifica sorgente]| Immagine |
|---|
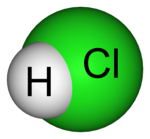  |
| Molecola dell'acido cloridrico HCl in cui l'idrogeno condivide il proprio elettrone spaiato con quello del cloro, instaurano un legame covalente. |
Le-gà-me co-va-lèn-te (![]() /
/![]() ): legame chimico in cui due atomi condividono una coppia di elettroni, che tiene legati i due nuclei atomici tramite attrazione elettrostatica, come fossero un paio di manette.
): legame chimico in cui due atomi condividono una coppia di elettroni, che tiene legati i due nuclei atomici tramite attrazione elettrostatica, come fossero un paio di manette.
Tali elettroni sono chiusi all'interno di un orbitale molecolare e tengono vicini i due nuclei atomici, creando un aggregato chiamato molecola. Tale aggregato può essere anche di grandi dimensioni, entrando a far parte di categorie particolari come i polimeri e i solidi reticolari.
Tipologie: legame puro, legame polare, legame dativo, legame a tre centri e due elettroni, legame σ, legame π
Vedi anche: ordine di legame, legame ionico
Legame dativo
[modifica | modifica sorgente]Particolare tipo di legame covalente, in cui la coppia di elettroni è fornita da un solo atomo.
Legame intermolecolare
[modifica | modifica sorgente]
Le-gà-me in-ter-mo-le-co-là-re (![]() ): legame chimico fra molecole distinte.
): legame chimico fra molecole distinte.
Le molecole, essendo composte da particelle dotate di carica elettrica possono possedere dei deboli campi elettrici (detti dipoli) in grado di attrarsi o respingersi gli uni con gli altri, come i poli di due calamite. In questo modo le molecole possono aggregarsi tenendosi unite dalla forza elettrostatica dei loro dipoli di segno opposto. Queste forze sono generalmente molto più deboli dei legami intramolecolari.
Tali campi elettrici possono essere di natura diversa: forza di van der Waals, interazioni ione-dipolo e persino il legame ionico viene considerato al limite fra legame intramolecolare ed intermolecolare.
Legame intramolecolare
[modifica | modifica sorgente]Legame ionico
[modifica | modifica sorgente]Le-gà-me iò-ni-co (![]() /
/![]() ): legame che si instaura tra ioni di carica opposta. Ciò accade quando tra due atomi vi sia un forte differenza di elettronegatività, tale che l'atomo più elettronegativo si appropria di un elettrone "strappandolo" all'atomo meno elettronegativo. Si formano così due ioni, uno negativo (anione, l'atomo coll'eccedenza di elettroni) e uno positivo (il catione, con una deficienza di elettroni). Un esempio comune è il cloruro di sodio, NaCl, formato da ioni positivi Na+ e ioni negativi Cl- uniti tra loro per mezzo di questo legame. Questo tipo particolare di legame non è dato quindi dalla condivisone di due o più elettroni, ma dall'attrazione elettrostatica che sussiste tra gli atomi carichi. Il legame ionico non porta alla formazione di molecole, come nel caso del legame covalente, ma di sali, costituiti da un reticolo cristallino dove gli ioni sono disposti nello spazio secondo un determinato schema geometrico. Il legame ionico è il più forte tra i legami chimici.
): legame che si instaura tra ioni di carica opposta. Ciò accade quando tra due atomi vi sia un forte differenza di elettronegatività, tale che l'atomo più elettronegativo si appropria di un elettrone "strappandolo" all'atomo meno elettronegativo. Si formano così due ioni, uno negativo (anione, l'atomo coll'eccedenza di elettroni) e uno positivo (il catione, con una deficienza di elettroni). Un esempio comune è il cloruro di sodio, NaCl, formato da ioni positivi Na+ e ioni negativi Cl- uniti tra loro per mezzo di questo legame. Questo tipo particolare di legame non è dato quindi dalla condivisone di due o più elettroni, ma dall'attrazione elettrostatica che sussiste tra gli atomi carichi. Il legame ionico non porta alla formazione di molecole, come nel caso del legame covalente, ma di sali, costituiti da un reticolo cristallino dove gli ioni sono disposti nello spazio secondo un determinato schema geometrico. Il legame ionico è il più forte tra i legami chimici.
Legame metallico
[modifica | modifica sorgente]Legame π
[modifica | modifica sorgente]Legame polare
[modifica | modifica sorgente]| Le-gà-me po-là-re: vedi il lemma Polarità. |
Legame puro
[modifica | modifica sorgente]Legame σ
[modifica | modifica sorgente]Legante
[modifica | modifica sorgente]Ligando
[modifica | modifica sorgente]Litio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Livermorio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Lutezio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Bibliografia
[modifica | modifica sorgente]- IUPAC Gold Book online, su goldbook.iupac.org.
- Dizionario di chimica e chimica industriale online, su minerva.unito.it.
- Dizionario di italiano Sabatini Coletti online, su minerva.unito.it.
- Termini chimici su Wikizionario in italiano.
- Termini chimici di tutte le lingue su Wikizionario in inglese.
