Dizionario chimico divulgativo/E
| A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z |
Eccimero
[modifica | modifica sorgente]Ecciplesso
[modifica | modifica sorgente]Eccitazione
[modifica | modifica sorgente]Ecologia
[modifica | modifica sorgente]Effervescenza
[modifica | modifica sorgente]Elastomero
[modifica | modifica sorgente]Elemento
[modifica | modifica sorgente]Elemento chimico
[modifica | modifica sorgente]E-le-mèn-to chì-mi-co (![]() /
/![]() ): è una sostanza che non può essere scomposta o trasformata in sostanze più semplici, costituita da atomi della stessa natura. Fra gli elementi chimici più conosciuti c'è l'ossigeno.
): è una sostanza che non può essere scomposta o trasformata in sostanze più semplici, costituita da atomi della stessa natura. Fra gli elementi chimici più conosciuti c'è l'ossigeno.
Elettrofilo
[modifica | modifica sorgente]E-let-trò-fi-lo (![]() /
/![]() ): specie chimica che in una reazione lega (in altre parole acquista) un doppietto elettronico formando un legame covalente col partner di reazione (che fa da nucleofilo). Esempio:
): specie chimica che in una reazione lega (in altre parole acquista) un doppietto elettronico formando un legame covalente col partner di reazione (che fa da nucleofilo). Esempio:
Lo ione idrogeno si comporta da elettrofilo perché lega la coppia elettronica localizzata sull'atomo di azoto dell'ammoniaca (che è il nucleofilo).
Elettron-attrattore
[modifica | modifica sorgente]| E-let-tron-attrattòre: vedi il lemma Effetto induttivo. |
Elettrondeficienza
[modifica | modifica sorgente]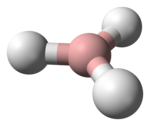
E-let-tro-de-fi-cien-za (![]() /
/![]() ): significa "mancanza di elettroni" ed è la situazione di un atomo che ha bisogno del doppietto elettronico di un altro atomo per essere stabile.
): significa "mancanza di elettroni" ed è la situazione di un atomo che ha bisogno del doppietto elettronico di un altro atomo per essere stabile.
La parola elettrondeficiente non ha una definizione rigorosa e viene sovente usata per gli atomi che non hanno raggiunto l'ottetto in una molecola (Esempi molto comuni di molecole con tale caratteristica sono i borani ed i composti degli altri elementi del gruppo A-III) ma può essere riferito anche ad atomi i cui elettroni sono attratti da altri atomi molto elettronegativi: la loro nuvola elettronica viene deviata e la carica positiva del nucleo rimane scoperta, quindi diventano capaci di attrarre a sé altri doppietti elettronici. In questi casi può assumere il sinonimo di elettrofilo e di acido di Lewis.
Al limite si può espandere anche al legame metallico.
Elettrone
[modifica | modifica sorgente]-
Tubo di Crookes, invenzione che permise i primi studi sugli elettroni
-
Rappresentazione stilizzata di un atomo
-
Schema di un circuito elettrico
-
Scarica da una bobina di Tesla
E-let-trò-ne (![]() /
/![]() ): particella subatomica avente carica elettrica negativa. Gli elettroni sono quelle particelle che, tramite attrazione elettrostatica, collegano gli atomi per formare le molecole. A loro volta queste ultime si attraggono (sempre tramite forze elettrostatiche) per formare aggregati macroscopici: le sostanze solide e liquide (nei gas le attrazioni tra le molecole sono troppo deboli per rimanere unite).
): particella subatomica avente carica elettrica negativa. Gli elettroni sono quelle particelle che, tramite attrazione elettrostatica, collegano gli atomi per formare le molecole. A loro volta queste ultime si attraggono (sempre tramite forze elettrostatiche) per formare aggregati macroscopici: le sostanze solide e liquide (nei gas le attrazioni tra le molecole sono troppo deboli per rimanere unite).
Gli elettroni sono anche quelle particelle che compongono la corrente elettrica e i fulmini: in entrambi i casi tali particelle si muovono attratte dalla forza elettromotrice generando effetti come accendere una lampadina o produrre una scintilla.
I fenomeni elettrici erano da sempre conosciuti dall'uomo ma si scoprì che l'elettrone era qualcosa di diverso dalla materia ordinaria solo nel XIX secolo, e nel 1896 fu dimostrato che esso è una particella subatomica.
Gli studi sul comportamento quantistico degli elettroni e delle altre particelle a livello subatomico cominciarono invece nel 1900. Nel 1924 fu scoperto che l'elettrone aveva un particolare comportamento ondulatorio (come la luce ed altre particelle), cosa che aiutò a spiegare il motivo per cui esso orbita attorno al nucleo degli atomi in zone preferenziali (orbitali e livelli) tramite le equazioni di Shrӧdinger e Dirac formulate rispettivamente nel 1925 e nel 1928.
Elettronegatività
[modifica | modifica sorgente]E-let-tro-ne-ga-ti-vi-tà (![]() /
/![]() ): valore numerico che esprime la forza con cui un atomo tende ad attrarre gli elettroni che gli orbitano attorno.[1]
): valore numerico che esprime la forza con cui un atomo tende ad attrarre gli elettroni che gli orbitano attorno.[1]
Elio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Effetto induttivo
[modifica | modifica sorgente]Emiacetale
[modifica | modifica sorgente]

E-mi-a-ce-ta-le (![]() /
/![]() ): gruppo funzionale costituito da un atomo di carbonio collegato a due carboni e/o idrogeni, ad un gruppo ossidrile -OH e ad un etere -OR.[2] Esso fa parte della categoria più vasta degli acetali, in cui uno dei gruppi -OR è sostituito da un gruppo -OH. Il termine "emiacetale" è usato per indicare in maniera specifica il gruppo funzionale derivato da un'aldeide (cioè in cui il carbonio centrale è legato ad un ossidrile, un etere, un carbonio ed un idrogeno) mentre gli emiacetali derivati da un chetone (in cui l'idrogeno è rimpiazzato con un atomo di carbonio) vengono detti emichetali.
): gruppo funzionale costituito da un atomo di carbonio collegato a due carboni e/o idrogeni, ad un gruppo ossidrile -OH e ad un etere -OR.[2] Esso fa parte della categoria più vasta degli acetali, in cui uno dei gruppi -OR è sostituito da un gruppo -OH. Il termine "emiacetale" è usato per indicare in maniera specifica il gruppo funzionale derivato da un'aldeide (cioè in cui il carbonio centrale è legato ad un ossidrile, un etere, un carbonio ed un idrogeno) mentre gli emiacetali derivati da un chetone (in cui l'idrogeno è rimpiazzato con un atomo di carbonio) vengono detti emichetali.
Emialdeide
[modifica | modifica sorgente]- Vedi Semialdeide.
Emiaminale
[modifica | modifica sorgente]Emichetale
[modifica | modifica sorgente]
E-mi-che-ta-le (![]() /
/![]() ): Gruppo funzionale costituito da un atomo di carbonio collegato a due carboni, ad un gruppo ossidrile -OH e ad un etere -OR.[3] E' una categoria specifica di acetali in cui il carbonio centrale non è mai legato ad un idrogeno, ed uno dei due gruppi -OR è sostituito da un gruppo -OH. Il termine, anche se non rigoroso, è largamente usato per indicare questa specifica categoria di composti.
): Gruppo funzionale costituito da un atomo di carbonio collegato a due carboni, ad un gruppo ossidrile -OH e ad un etere -OR.[3] E' una categoria specifica di acetali in cui il carbonio centrale non è mai legato ad un idrogeno, ed uno dei due gruppi -OR è sostituito da un gruppo -OH. Il termine, anche se non rigoroso, è largamente usato per indicare questa specifica categoria di composti.
Essi derivano dalla condensazione di una molecola di chetone con un solo equivalente di alcol.
Emulsione
[modifica | modifica sorgente]E-mul-siò-ne (![]() /
/![]() ): dispersione di un fluido in un altro fluido immiscibile, sotto forma di piccole bolle o gocce. Il latte intero, per esempio, è un'emulsione costituita prevalentemente da acqua e grassi.
): dispersione di un fluido in un altro fluido immiscibile, sotto forma di piccole bolle o gocce. Il latte intero, per esempio, è un'emulsione costituita prevalentemente da acqua e grassi.
Enantiomero
[modifica | modifica sorgente]Energia di risonanza
[modifica | modifica sorgente]Entità molecolare
[modifica | modifica sorgente]En-ti-tà mo-le-co-là-re (![]() /
/![]() ): qualsiasi cosa microscopica che prende parte ad una reazione chimica.[4]
): qualsiasi cosa microscopica che prende parte ad una reazione chimica.[4]
Per essere tali devono avere caratteristiche (energia cinetica, carica elettrica, massa isotopica, chiralità ecc.) che le rendono identificabili, ma possono essere entità di qualsiasi tipo: ioni, particelle subatomiche, atomi, macromolecole eccetera (non devono essere necessariamente molecole come può far pensare il nome).
Per usare un paragone, Voltaire e un gatto sono individui come una molecola di metano o l'atomo di uranio 238 che ha innescato una fissione a catena sono entità molecolari.
Vedi anche: specie chimica, sostanza chimica, composto chimico, isomero, isotopologo
Epimero
[modifica | modifica sorgente]Epossido
[modifica | modifica sorgente]Equazione chimica
[modifica | modifica sorgente]Equazione di Shrӧdinger
[modifica | modifica sorgente]Erbio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Essiccatore
[modifica | modifica sorgente]Esoso
[modifica | modifica sorgente]Esotermico
[modifica | modifica sorgente]E-so-tèr-mi-co (![]() /
/![]() ): che sprigiona calore.
): che sprigiona calore.
Estere
[modifica | modifica sorgente]
È-ste-re (![]() /
/![]() ): composto organico derivato dagli acidi carbossilici con sostituzione formale del gruppo ossidrile con un gruppo -OR (dove R è un generico residuo idrocarburico).
): composto organico derivato dagli acidi carbossilici con sostituzione formale del gruppo ossidrile con un gruppo -OR (dove R è un generico residuo idrocarburico).
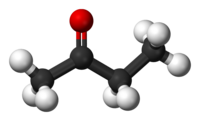
Etere
[modifica | modifica sorgente]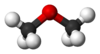
È-te-re (![]() /
/![]() ): composto organico avente un ponte ossigeno che lega due catene carboniose, di formula generica R-O-R', dove R è un qualsiasi gruppo alchilico (o arilico). Un esempio è CH3OCH3, l'etere dimetilico (o dimetiletere o metossimetano).
): composto organico avente un ponte ossigeno che lega due catene carboniose, di formula generica R-O-R', dove R è un qualsiasi gruppo alchilico (o arilico). Un esempio è CH3OCH3, l'etere dimetilico (o dimetiletere o metossimetano).
Etile
[modifica | modifica sorgente]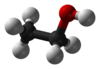
E-tì-le (![]() /
/![]() ): molecola di etano cui è stato rimosso un atomo di idrogeno (•CH2CH3).
): molecola di etano cui è stato rimosso un atomo di idrogeno (•CH2CH3).
Esso è un frammento di molecola molto comune nelle sostanze chimiche usate in laboratorio ed in molti altri ambiti. In esse l'idrogeno rimosso dall'etano è sostituito con un altro gruppo funzionale (immagine a destra).
Ai composti in cui è presente viene associato l'aggettivo etilico, fra i quali il più comune è l'alcol etilico contenuto nelle bevande alcoliche. Altri esempi sono l'acetato di etile[5], l'etere etilico[6] ed il metil-etil chetone[7], usati come solventi.
Etossido
[modifica | modifica sorgente]Europio
[modifica | modifica sorgente]| Gruppi → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodi ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 color: #000;Fr |
88 Ra |
89 Ac |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||||
| ** | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||
| Metalli alcalini | Metalli alcalino-terrosi | Metalli di transizione | Lantanoidi |
| Attinoidi | Metalli del blocco p | Metalloidi | Non metalli | Gas nobili |
Evaporazione
[modifica | modifica sorgente]E-va-po-ra-ziò-ne (![]() /
/![]() ): passaggio dallo stato di aggregazione liquido a quello aeriorme che coinvolge solo la superficie del liquido.
): passaggio dallo stato di aggregazione liquido a quello aeriorme che coinvolge solo la superficie del liquido.
Bibliografia
[modifica | modifica sorgente]- IUPAC Gold Book online, su goldbook.iupac.org.
- Dizionario di chimica e chimica industriale online, su minerva.unito.it.
- Dizionario di italiano Sabatini Coletti online, su minerva.unito.it.
- Termini chimici su Wikizionario in italiano.
- Termini chimici di tutte le lingue su Wikizionario in inglese.
Note
[modifica | modifica sorgente]- ↑ GB electronegativity
- ↑ IUPAC Gold Book - Hemiacetals.
- ↑ IUPAC Gold Book - Ketals.
- ↑ GB molecular entity
- ↑

- ↑

- ↑