Nelle condizioni operative dell’analisi qualitativa inorganica, le diverse reazioni di precipitazione impiegate, ad esempio nella ricerca sistematica dei cationi, consentono di raggiungere valori di RM opportuni (0,999 – 0,9999), nello stesso tempo è possibile avere un ottimo grado di separazione dagli altri componenti  .
Questi risultati sono accessibili se si controllano adeguatamente le condizioni di reazione, che dipendono dal tipo di precipitante.
.
Questi risultati sono accessibili se si controllano adeguatamente le condizioni di reazione, che dipendono dal tipo di precipitante.
Esempi:
- Separazione di cationi come idrossidi
- Mm+ (aq) + m OH- <-> M(OH)m (s)
- equilibrio governato da una Ks
- pH di inizio precipitazione degli idrossidi,
![{\displaystyle [M^{m+}]\cong 0,02M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1897d9d55cedcd8ddb148e9c0c7c9b112e01fe08)

- Il pH di INIZIO precipitazione dipende dalla concentrazione iniziale di catione presente:
- [Zn2+]i = 0,25 M - pHi = 5,8
- [Zn2+]i = 0,01 M - pHi = 6,5
- Separazione di Mm+ da Nn+
- Le condizioni di separazione “ideale” sono quelle in cui il catione che precipita per primo (es. Mm+) ha raggiunto
 e, inoltre, in queste condizioni di pH
e, inoltre, in queste condizioni di pH
 .
.
Lo studio “a priori” di questa condizione è alla base del soddisfacente impiego della precipitazione nella separazione dei cationi in gruppi analitici.
Sia M un componente maggiore del campione (1-100%), RM = 0,999 (questo caso è tipico nei campioni analizzati con la tecnica dell’analisi qualitativa “semi-micro”). Dopo le operazioni di dissoluzione si ottiene una soluzione dove:
![{\displaystyle [M^{m+}]_{i}\cong 1x10^{-2}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f90f8fa775105663324e91f89b5a96c6319b340f) (limite superiore
(limite superiore  ).
).
Al fine di ridurre al minimo l’effetto degli errori operativi sulla separazione, si impongono condizioni più restrittive: RM = 0,9999.
![{\displaystyle [M^{m+}]_{i}\cong 10^{-2}M\Rightarrow M(OH)_{m}(s)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78f27f79a514b857d0641009584f84ec9d3c3b40)
![{\displaystyle [M^{m+}]_{f}=[M^{m+}]_{i}-[M^{m+}]_{i}\quad R_{M}=[M^{m+}]_{i}\quad (1-R_{M})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/64b2a8f7edafc7d32319db5ad97407eb03d05a65)
![{\displaystyle [M^{m+}]_{f}\cong 1x10^{-6}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d87ccf3ae2eb15592ebcc938361fca568490c87)
Per raggiungere questa resa (0,9999), a quale pH è necessario operare?
![{\displaystyle K_{S(M)}=[M^{m+}][OH^{-}]^{m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29a8cb6d121c72f722b142369726dfddd122cf4b)
![{\displaystyle [OH^{-}]_{f}={\sqrt[{m}]{\frac {K_{S(M)}}{[M^{m+}]_{f}}}}={\sqrt[{m}]{10^{6}K_{S(M)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edbc90c37664fcb6dd1b30346448be7c66f64aca)
In quali casi, con questa resa di M, non si ha precipitazione da parte di altri componenti presenti?
Se nella soluzione è presente Nn+, e [Nn+]i [OH-]nf < KS(M), allora NON si ha precipitazione di N(OH)n (s) (KS(M) = 0).
![{\displaystyle [N^{n+}]_{i}<{\frac {K_{S(N)}}{[OH^{-}]_{f}^{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5b9e63efe7c6308a28e962e1f17ab62862d83368)
![{\displaystyle [OH^{-}]_{f}={\sqrt[{m}]{10^{6}K_{S(N)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5c265ac2f214d757b665fad50c4601fead1ea04)
![{\displaystyle [N^{n+}]_{i}<{\frac {K_{S(N)}}{[10^{6}K_{S(N)}]^{n/m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53e357102cff115db3868b244ebb36fb69fe2804)
La condizione più generale di separazione “ideale” del componente M come idrossido è pertanto:
![{\displaystyle [N^{n+}]_{i}<{\frac {K_{S(N)}}{[10^{6}K_{S(N)}]^{n/m}}}([M^{m+}]_{i}(1-R_{M}))^{n/m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a35b852755cf62b730823ffa7015388451f5d725)
È essenziale tenere presente che, se CM è la concentrazione totale del componente M in soluzione, NON SEMPRE: [Mm+] = CM; infatti, lo ione metallico può essere presente in altre forme (oltre a quella Mm+ che interessa ai fini separativi).
Il caso del Fe3+ è un esempio tipico.
Separazione della specie Mm+ dall’impurezza Nn+
![{\displaystyle [N^{n+}]<{\frac {K_{S(N)}}{K_{S(M)}^{2/3}}}(C_{M}(1-R_{M}))^{2/3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b76bab26e7bef2292d229648e38183cc7b5d33d)
LIMITI: all’interno dell’assunzione [Mm+] = CM
Fe3+ + 3 OH- <-> Fe(OH)3 (s)
![{\displaystyle K_{S}=[Fe^{3+}][OH^{-}]^{3}=2x10^{-39}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7efaa180309f5a3f7cba234ea48b91be2fd30c3e)
Fe3+ + H2O <-> Fe(OH)2+ + H+
![{\displaystyle K_{h1}={\frac {[Fe(OH)^{2+}][H^{+}]}{[Fe^{3+}]}}=9x10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db7b7f1127981eb43c206da918b9ce91f326fa30)
Fe(OH)2+ + H2O <-> Fe(OH)2+ + H+
![{\displaystyle K_{h2}={\frac {[Fe(OH)_{2}^{+}][H^{+}]}{[Fe(OH)^{2+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cfa6e01b7df2ef360c7f05173437131665b3a13d)
![{\displaystyle K_{2}={\frac {[Fe(OH)_{2}^{+}][H^{+}]^{2}}{[Fe^{3+}]}}=5x10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1279119e287636c196b55b84b1e638bd6a5e6e23)
2 Fe3+ + 2 H2O <-> Fe2(OH)24+ + 2 H+
![{\displaystyle K_{d}={\frac {[Fe_{2}(OH)_{2}^{4+}][H^{+}]^{2}}{[Fe^{3+}]^{2}}}=1,1x10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ec98a507e62959c15356bc02281e95f46c53b26)

Concentrazione delle specie in equilibrio con Fe(OH) 3(s)
| pH
|
[Fe3+]
|
[Fe(OH)2+]
|
[Fe(OH)2+]
|
[Fe2(OH)24+]
|
[Fe (OH)3 sat]
|
| 3
|
2 x 10-6
|
1,8 x 10-6
|
1 x 10-6
|
4 x 10-9
|
< 2 x 10-9
|
| 4
|
2 x 10-9
|
2 x 10-8
|
1 x 10-7
|
4 x 10-13
|
< 2 x 10-9
|
| 7
|
2 x 10-18
|
2 x 10-14
|
1 x 10-10
|
4 x 10-25
|
< 2 x 10-9
|
A3+ + 3 OH- <-> A(OH)3 (s) KS = 10-30
B2+ + 2 OH- <-> B(OH)2 (s) K’S = 10-16
[A3+]0 = (CA)0 = 1M
[B2+]0 = (CB)0 = 1M

È possibile la separazione senza contaminazione?
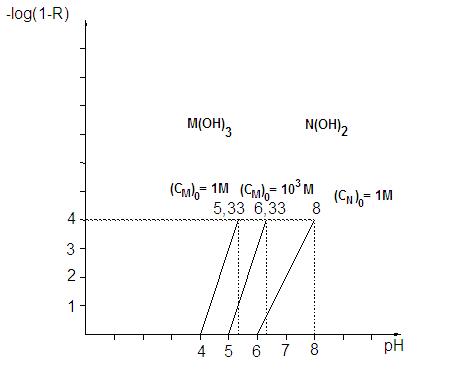
[A3+]0 = 1M = (CA)0
[A3+]f = (CA)f = (CA)0 (1-RA3+) = 1 x 10-4 M
- Calcolo del pH di INIZIO della precipitazione:
![{\displaystyle [OH^{-}]_{in}={\sqrt[{3}]{\frac {K_{s}}{(C_{A})_{0}}}}=10^{-10}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0bbc8d07c589a4d1ae45000778147d412a7a488f)
- pOH = 10; pH = 4
- Calcolo del pH di FINE precipitazione:
![{\displaystyle [OH^{-}]_{f}={\sqrt[{3}]{\frac {K_{s}}{(C_{A})_{0}(1-R_{A^{3+}})}}}=sqrt{10}10^{-9}=2,1510^{-9}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9302e5b0116d6f12ff972a02bbf57219996f82a)
- pOH = 8,67; pH = 5,33
- Verifica della condizione di NON CONTAMINAZIONE (pHin ppN < pHf ppM)
![{\displaystyle [OH^{-}]_{in}={\sqrt {\frac {K_{s}^{,}}{(C_{B})_{0}}}}=10^{-8}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6dda8e401ad7a2588b5b6977b187ff49fb0040b3)
- pOH = 8; pH = 6
- risposta POSITIVA
L’analisi dell’andamento della precipitazione degli idrossidi si può fare in modo generale.
In presenza di corpo di fondo, l’equilibrio eterogeneo è governato dalla costante del prodotto di solubilità:
- Mm+ + m OH- <-> M(OH)m (s)
![{\displaystyle [OH^{-}]=\left({\frac {K_{s}}{C_{M}}}\right)^{1/m}=\left[{\frac {K_{s}}{(C_{M})_{0}(1-R_{M})}}\right]^{1/m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b866d31bbb429599cc3bf65ccd26dc63f6e6c2b)
![{\displaystyle {\frac {K_{W}}{[H^{+}]}}=\left[{\frac {K_{s}}{(C_{M})_{0}(1-R_{M})}}\right]^{1/m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/504b0a02922d7fff3da98faaa7db3beeb4723afd)
![{\displaystyle logK_{W}-log[H^{+}]={\frac {1}{m}}logK_{S}-{\frac {1}{m}}log(C_{M})_{0}-{\frac {1}{m}}log(1-R_{M})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f44231a2af2183b3b709cb5c1de04325e1410736)


Analisi dell’esempio precedente:




Il controllo della concentrazione del precipitante (S2-) è basato sul controllo del pH.
- H2S <-> HS- + H+
- HS- <-> S2- + H+
![{\displaystyle K_{a1}={\frac {[HS^{-}][H^{+}]}{[H_{2}S]}}=1x10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23f563830783aff58ddfcef8799cf46ffd24377c)
![{\displaystyle K_{a2}={\frac {[S^{2-}][H^{+}]}{[HS^{-}]}}=1,3x10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe7f1c76543969d018640f7e3b6750d5f15b86b2)
![{\displaystyle K_{a1}K_{a2}={\frac {[S^{2-}][H^{+}]^{2}}{[H_{2}S]}}=1,3x10^{-20}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d6014ae554797a7723a90c3098efc34ffb33f92)
Se in una soluzione la concentrazione analitica (totale) del solfuro è CH2S, soltanto una parte di questo solfuro si trova nella forma utile ai fini della reazione (S2-):
![{\displaystyle C_{H_{2}S}=[H_{2}S]+[HS^{-}]+[S^{2-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/253139f661f3f45b3be37fb068d4a4eae3144e25)
![{\displaystyle \alpha _{S^{2-}}{\frac {S^{2-}}{[H_{2}S]+[HS^{-}]+[S^{2-}]}}={\frac {K_{a1}K_{a2}}{[H^{+}]^{2}+K_{a1}[H^{+}]+K_{a1}K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a6a83bdde2fbd25ebcb00ad59ef8265fc20cab4)

Ad ogni pH, la concentrazione effettiva di solfuro (S2-) è calcolabile:
![{\displaystyle [S^{2-}]_{(pH)}=\alpha _{S^{2-(pH)}}C_{H_{2}S}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cea76e3a75ae793222cb281104dd5e8d27975678)
dove CH2S = concentrazione totale (analitica)
Caso generale:
- 2 Mm+ + m S2- <-> M2Sm (s)
![{\displaystyle K_{S}=[M^{m+}]^{2}[S^{2-}]^{m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fcdee11b156787b10375465b49d290106bd74853)
![{\displaystyle [S^{2-}]_{i}\geq {\sqrt[{m}]{\frac {K_{S}}{[M^{m+}]_{i}^{2}}}}={\sqrt[{m}]{\frac {K_{S}}{C_{M}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dce718e1ba73f53981f84506272dace641916a4d)
- CM = concentrazione totale di Mm+ (iniziale)
La concentrazione di solfuro finale (alla fine della precipitazione) dovrà essere compatibile con la resa prevista:
![{\displaystyle [S{2-}]_{f}={\sqrt[{m}]{K_{S}}}{[C_{M}](1-R_{M})]^{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5b0d606314d7576bc17636552825d7f7a33a21e) nel caso M2Sm
nel caso M2Sm
Sperimentalmente due cationi si possono separare se l’intervallo di pH calcolato è di almeno una unità.


![{\displaystyle [M^{m+}]\cong 0,02M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1897d9d55cedcd8ddb148e9c0c7c9b112e01fe08)


![{\displaystyle [M^{m+}]_{i}\cong 1x10^{-2}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f90f8fa775105663324e91f89b5a96c6319b340f)

![{\displaystyle [M^{m+}]_{i}\cong 10^{-2}M\Rightarrow M(OH)_{m}(s)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78f27f79a514b857d0641009584f84ec9d3c3b40)
![{\displaystyle [M^{m+}]_{f}=[M^{m+}]_{i}-[M^{m+}]_{i}\quad R_{M}=[M^{m+}]_{i}\quad (1-R_{M})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/64b2a8f7edafc7d32319db5ad97407eb03d05a65)
![{\displaystyle [M^{m+}]_{f}\cong 1x10^{-6}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d87ccf3ae2eb15592ebcc938361fca568490c87)
![{\displaystyle K_{S(M)}=[M^{m+}][OH^{-}]^{m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29a8cb6d121c72f722b142369726dfddd122cf4b)
![{\displaystyle [OH^{-}]_{f}={\sqrt[{m}]{\frac {K_{S(M)}}{[M^{m+}]_{f}}}}={\sqrt[{m}]{10^{6}K_{S(M)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edbc90c37664fcb6dd1b30346448be7c66f64aca)
![{\displaystyle [N^{n+}]_{i}<{\frac {K_{S(N)}}{[OH^{-}]_{f}^{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5b9e63efe7c6308a28e962e1f17ab62862d83368)
![{\displaystyle [OH^{-}]_{f}={\sqrt[{m}]{10^{6}K_{S(N)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5c265ac2f214d757b665fad50c4601fead1ea04)
![{\displaystyle [N^{n+}]_{i}<{\frac {K_{S(N)}}{[10^{6}K_{S(N)}]^{n/m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53e357102cff115db3868b244ebb36fb69fe2804)
![{\displaystyle [N^{n+}]_{i}<{\frac {K_{S(N)}}{[10^{6}K_{S(N)}]^{n/m}}}([M^{m+}]_{i}(1-R_{M}))^{n/m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a35b852755cf62b730823ffa7015388451f5d725)
![{\displaystyle [N^{n+}]<{\frac {K_{S(N)}}{K_{S(M)}^{2/3}}}(C_{M}(1-R_{M}))^{2/3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b76bab26e7bef2292d229648e38183cc7b5d33d)
![{\displaystyle K_{S}=[Fe^{3+}][OH^{-}]^{3}=2x10^{-39}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7efaa180309f5a3f7cba234ea48b91be2fd30c3e)
![{\displaystyle K_{h1}={\frac {[Fe(OH)^{2+}][H^{+}]}{[Fe^{3+}]}}=9x10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db7b7f1127981eb43c206da918b9ce91f326fa30)
![{\displaystyle K_{h2}={\frac {[Fe(OH)_{2}^{+}][H^{+}]}{[Fe(OH)^{2+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cfa6e01b7df2ef360c7f05173437131665b3a13d)
![{\displaystyle K_{2}={\frac {[Fe(OH)_{2}^{+}][H^{+}]^{2}}{[Fe^{3+}]}}=5x10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1279119e287636c196b55b84b1e638bd6a5e6e23)
![{\displaystyle K_{d}={\frac {[Fe_{2}(OH)_{2}^{4+}][H^{+}]^{2}}{[Fe^{3+}]^{2}}}=1,1x10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ec98a507e62959c15356bc02281e95f46c53b26)


![{\displaystyle [OH^{-}]_{in}={\sqrt[{3}]{\frac {K_{s}}{(C_{A})_{0}}}}=10^{-10}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0bbc8d07c589a4d1ae45000778147d412a7a488f)
![{\displaystyle [OH^{-}]_{f}={\sqrt[{3}]{\frac {K_{s}}{(C_{A})_{0}(1-R_{A^{3+}})}}}=sqrt{10}10^{-9}=2,1510^{-9}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9302e5b0116d6f12ff972a02bbf57219996f82a)
![{\displaystyle [OH^{-}]_{in}={\sqrt {\frac {K_{s}^{,}}{(C_{B})_{0}}}}=10^{-8}M}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6dda8e401ad7a2588b5b6977b187ff49fb0040b3)
![{\displaystyle [OH^{-}]=\left({\frac {K_{s}}{C_{M}}}\right)^{1/m}=\left[{\frac {K_{s}}{(C_{M})_{0}(1-R_{M})}}\right]^{1/m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b866d31bbb429599cc3bf65ccd26dc63f6e6c2b)
![{\displaystyle {\frac {K_{W}}{[H^{+}]}}=\left[{\frac {K_{s}}{(C_{M})_{0}(1-R_{M})}}\right]^{1/m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/504b0a02922d7fff3da98faaa7db3beeb4723afd)
![{\displaystyle logK_{W}-log[H^{+}]={\frac {1}{m}}logK_{S}-{\frac {1}{m}}log(C_{M})_{0}-{\frac {1}{m}}log(1-R_{M})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f44231a2af2183b3b709cb5c1de04325e1410736)






![{\displaystyle K_{a1}={\frac {[HS^{-}][H^{+}]}{[H_{2}S]}}=1x10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23f563830783aff58ddfcef8799cf46ffd24377c)
![{\displaystyle K_{a2}={\frac {[S^{2-}][H^{+}]}{[HS^{-}]}}=1,3x10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe7f1c76543969d018640f7e3b6750d5f15b86b2)
![{\displaystyle K_{a1}K_{a2}={\frac {[S^{2-}][H^{+}]^{2}}{[H_{2}S]}}=1,3x10^{-20}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d6014ae554797a7723a90c3098efc34ffb33f92)
![{\displaystyle C_{H_{2}S}=[H_{2}S]+[HS^{-}]+[S^{2-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/253139f661f3f45b3be37fb068d4a4eae3144e25)
![{\displaystyle \alpha _{S^{2-}}{\frac {S^{2-}}{[H_{2}S]+[HS^{-}]+[S^{2-}]}}={\frac {K_{a1}K_{a2}}{[H^{+}]^{2}+K_{a1}[H^{+}]+K_{a1}K_{a2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a6a83bdde2fbd25ebcb00ad59ef8265fc20cab4)

![{\displaystyle [S^{2-}]_{(pH)}=\alpha _{S^{2-(pH)}}C_{H_{2}S}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cea76e3a75ae793222cb281104dd5e8d27975678)
![{\displaystyle K_{S}=[M^{m+}]^{2}[S^{2-}]^{m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fcdee11b156787b10375465b49d290106bd74853)
![{\displaystyle [S^{2-}]_{i}\geq {\sqrt[{m}]{\frac {K_{S}}{[M^{m+}]_{i}^{2}}}}={\sqrt[{m}]{\frac {K_{S}}{C_{M}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dce718e1ba73f53981f84506272dace641916a4d)
![{\displaystyle [S{2-}]_{f}={\sqrt[{m}]{K_{S}}}{[C_{M}](1-R_{M})]^{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5b0d606314d7576bc17636552825d7f7a33a21e)