Laboratorio di chimica in casa/Saccarosio
Il comune zucchero da tavola è costituito da una sostanza organica chiamata saccarosio. Esso viene commercializzato come polvere cristallina bianca/trasparente e forma cristalli monoclini trasparenti.
Struttura
[modifica | modifica sorgente]I seguenti contenuti possono essere approfonditi alla pagina dedicata agli zuccheri.


La molecola del saccarosio è complessa e può essere osservata da diversi punti di vista.[1] Ad un primo sguardo (immagine a sinistra) si può notare che in essa sono presenti due cicli, tenuti insieme da un atomo di ossigeno; il saccarosio è infatti biosintetizzato per unione (condensazione) di due molecole cicliche: una di glucosio (l'anello a 6 termini), ed una di fruttosio (quello a 5 termini) i quali sono composti appartenenti alla classe degli zuccheri monosaccaridi.

Una caratteristica comune a tutti i carboidrati (compresi il saccarosio ed i suoi due precursori) è quella di avere un gruppo -OH (ossidrile) legato ad ogni carbonio, tranne uno. Quest'ultimo è chiamato gruppo carbonile; il saccarosio ne contiene due: sono i due carboni legati all'ossigeno che tiene insieme l'esagono e il pentagono menzionati prima (vedere l'immagine in basso). Osservando i due centri (cerchiati di rosso) si può notare che ad essi sono collegati due atomi di ossigeno, a differenza di tutti gli altri carbonii. Tale carbonio, chiamato anche carbonio anomerico, può trovarsi in due forme: nel saccarosio è presente in forma acetalica, cioè con due atomi di ossigeno attaccati ad esso, e a loro volta legati a un altro atomo di carbonio (segnati in lilla e in rosso).



Nel glucosio e nel fruttosio invece, sotto forma di molecole separate, il carbonio carbonilico è anche lì legato a due atomi di ossigeno, ma forma quello che viene chiamato un emiacetale poiché vi sono sempre due ossigeni legati allo steso carbonio, ma uno solo è legato a due atomi di carbonio; l'altro è legato ad un idrogeno.
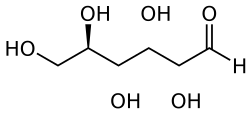
Il saccarosio, il fruttosio ed il glucosio sono molecole cicliche ma gli zuccheri possono esistere anche come molecole lineari, mantenendo invariato il numero di atomi ma cambiandoli di posizione. In tal caso è il carbonile ad assume un'altra forma. In esso compare un doppio legame fra carbonio e ossigeno ( C=O ) chiamato aldeide se si trova alla fine della molecola (quindi ha struttura C-CH=O, caso del glucosio, immagine a sinistra), altrimenti è un chetone ( C-C=O-C, immagine del fruttosio a destra).[2]
Sono dunque le reazioni tipiche di alcoli, aldeidi e chetoni a delineare la chimica del saccarosio e dei suoi due monomeri.[3] Va tuttavia ricordato che la vicinanza di due gruppi funzionali cambia la chimica della molecola (per esempio un gruppo -C-OH adiacente ad un gruppo -C=O può dare alcune reazioni caratteristiche che possono avvenire solo quando i due gruppi sono vicini), perciò il saccarosio può dare reazioni tipiche dei dioli vicinali, degli α-idrossichetoni e delle α-idrossialdeidi, degli acetali ecc.
Un'altra caratteristica importante del saccarosio è che i due monomeri che lo compongono (glucosio e fruttosio) sono composti dallo stesso numero di atomi (in particolare 6 atomi di carbonio ciascuno, che li fa rientrare nella categoria degli zuccheri esosi). L'unica differenza sta nella posizione del carbonile (si vede meglio nelle immagini delle strutture lineari di glucosio e fruttosio, qui a destra e a sinistra) il quale è il primo degli atomi di carbonio della molecola del glucosio, mentre è il secondo nella molecola del fruttosio (il primo è un CH2OH). Questa caratteristica è chiamata isomeria costituzionale, ed avviene quando due molecole hanno lo stesso numero di atomi, ma questi sono legati fra di loro in maniera diversa o in posizioni diverse. La trasformazione di Lobry de Bruyn–van Ekenstein è una reazione in cui uno zucchero isomerizza in presenza di una base.
Stereochimica
[modifica | modifica sorgente]
Anche la posizione dei sostituenti (gruppi -OH e legame glicosidico) rispetto al piano su cui giace l'anello è caratteristica per il saccarosio, ossia ogni molecola di saccarosio ha una precisa disposizione dei sostituenti "sopra o sotto" il piano di simmetria della molecola, comune a tutte le molecole di saccarosio. Nel caso l'orientamento di uno di questi sostituenti fosse invertito, la molecola non si potrebbe più considerare propriamente saccarosio.[4]
Dalla struttura molecolare del composto (immagine in verde a destra) si può notare che i legami fra i carbonii dei due cicli ed i loro sostituenti sono segnati con dei cunei, alcuni neri pieni, altri grigi tratteggiati. Questa notazione indica la posizione del sostituente rispetto al piano su cui giace la molecola (si confronti la formula di struttura con il modellino tridimensionale): nero pieno significa che il sostituente sporge verso l'osservatore, tratteggiato significa che è dietro rispetto al piano su cui giace l'anello, mentre i legami grigi continui appartengono al piano della molecola.

Questa caratteristica dei carboni legati a quattro sostituenti diversi, chiamata stereoisomeria, influisce poco sulle proprietà chimiche della molecola.[5] Tuttavia le sue caratteristiche biochimiche sono molto diverse: l'interazione con molecole piccole di un gruppo -OH o di un qualsiasi altro sostituente posto "dietro" rispetto al piano su cui giace la molecola saranno praticamente uguali a quelle di uno stesso sostituente che invece sporge verso l'osservatore. Nell'organismo tuttavia le molecole sono intercettate da proteine ed enzimi, molecole molto grandi e complesse, per le quali è molto importante la geometria delle molecole che vanno a interagire con loro, compreso l'orientamento dei loro sostituenti. Gli enzimi contengono infatti delle "nicchie" chiamate siti attivi nei quali le molecole vanno ad incastrarsi, legandosi chimicamente. Se la loro conformazione fosse diversa, le interazioni molecola-sito enzimatico cambierebbero poiché i legami formati non sarebbero gli stessi, e dunque produrrebbero un effetto diverso sull'organismo.[6] Tuttavia, poiché negli esseri viventi sono sempre degli enzimi che producono le sostanze biologicamente attive, il saccarosio è biosintetizzato e presente nell'organismo quasi tutto nella conformazione più comune.[7]
La conformazione dei centri chirali del saccarosio può tuttavia cambiare attraverso un processo chiamato racemizzazione, il quale avviene ad alte temperature, a livelli molto alti o bassi di pH ed in presenza di altre specie chimiche.[8]
Estrazione
[modifica | modifica sorgente]Reazioni
[modifica | modifica sorgente]Il saccarosio reagisce a temperatura ambiente con acido solforico concentrato deidratandosi a carbonio. Tale reazione è esotermica ed il prodotto spesso fuoriesce dal contenitore, formando un cilindro di schiuma di carbonio.[9]

Cristallizzazione
[modifica | modifica sorgente]Sicurezza
[modifica | modifica sorgente]Video
[modifica | modifica sorgente]Note
[modifica | modifica sorgente]- ↑ Nelle immagini del saccarosio, la sua formula di struttura potrebbe essere rappresentata da prospettive diverse: a sinistra la molecola è rappresentata "vista dall'alto" ma spesso viene rappresentata anche in prospettiva.
- ↑ A livelli base di chimica organica di laboratorio, aldeidi e chetoni sono più comuni di acetali ed emiacetali, che sono invece molto comuni in biochimica. Altri esempi di un'aldeide e di un chetone sono la vanillina e l'acetone.
- ↑ Oltre ai gruppi idrocarburici (legami C-H) la cui chimica è quella in parte simile a quella degli alcani.
- ↑ Molecole che hanno la stessa struttura chimica ma un orientamento dei sostituenti diverso si chiamano stereoisomeri
- ↑ Un gruppo -OH che sporge verso l'osservatore subirà un attacco acido o una sostituzione nella stessa maniera in cui si comporterebbe un -OH posto dietro al piano della molecola nelle reazioni più comuni. Tuttavia questo accade per la maggior parte delle reazioni ma non per tutte.
- ↑ Per esempio glucosio e galattosio hanno la stessa struttura chimica, ma il gruppo -OH del carbonio anomerico è speculare ne due zuccheri. Questa lievissima differenza rende il galattosio meno dolce rispetto al glucosio ed al fruttosio, appunto perché interagisce con minor efficacia con gli enzimi della saliva.
- ↑ Il cui nome sistematico è (2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-diidrossi-2,5-bis(idrossimetil)ossolan-2-il]ossi-6-(idrossimetil)ossan-3,4,5-triolo o α-D-glucopiranosil-(1→2)-β-D-fruttofuranoside.
- ↑ La reazione di Lobry de Bruyn–van Ekenstein, l'idrolisi e la [[w:reazione di Maillard|]] sono esempi di reazioni in cui può avvenire l'isomerizzazione.
- ↑ Royal Society of Chemistry