Chimica organica/Aromatici
Descrizione generale delle molecole aromatiche attraverso il caso del benzene
[modifica | modifica sorgente]Una mole di cicloesene, se ridotta a cicloesano per addizione di una molecola di idrogeno, libera 28.6 kilocalorie. Una mole di 1,3-cicloesadiene, se ridotta a cicloesano per addizione di due molecoli di idrogeno, non libera il doppio dell'energia, ma 2 kilocalorie in meno, 55.2. Questa discrepanza non è inattesa, dato che i doppi legami sono coniugati, conferendo stabilità alla molecola, come già descritto in questa sezione. Una mole di 1,3,5-cicloesatriene, se ridotta allo stesso modo, dovrebbe liberare il triplo di 28.6 kilocalorie, alle quali vanno sottratte diciamo 4 o 5 kilocalorie per tenere conto della stabilità data dalla totale coniugazione tra i legami. In realtà questa reazione libera appena 46 kilocalorie, 40 in meno delle attese e addirittura 2 in meno del diene. Oggi si sa che nelle molecole
- cicliche
- planari
- caratterizzate da un sistema completamente coniugato di doppi legami composto da un numero di elettroni pari a 4n+2, dove n è un numero intero
si ha una sovrapposizione completa degli orbitali π, che porta ad un unico grande orbitale circolare che copre l'intera molecola, come illustrato dalla figura 2. All'interno di tale orbitale si genera un flusso di elettroni, che viene definito corrente d'anello, in grado di donare particolare stabilità alla molecola. Tali molecole vengono cumulativamente definite aromatiche.
La corrente d'anello rende la delocalizzazione degli elettroni di tipo π perfetta a tal punto che non ha senso parlare di legami semplici o doppi. Il nome 1,3,5-cicloesatriene, che presuppone la localizzazione dei doppi legami tra carboni ben precisi, non ha senso. La molecola aromatica a 6 carboni e 6 idrogeni viene chiamata benzene. È bene sottolineare che la molecola 1,3,5-cicloesatriene, benché possa essere disegnata, non esiste, esiste il benzene! per rappresentare dunque il benzene è opportuno indicare i doppi legami sotto forma di cerchio, come riportato in figura 3, così che appaia chiara la perfetta delocalizzazione degli elettroni. Le strutture di figura 4, dette di Kekulé per i motivi riportati nella seguente scheda di approfondimento, sono scorrette, ma comode e dunque accettate perché consentono di visualizzare dove si spostino gli elettroni in particolari circostanze, delle quali parleremo più diffusamente nel prossimo capitolo.
Il benzene è stato scoperto da Michael Faraday (1791-1867) nel 1825. Faraday è più famoso per i suoi studi su elettricità e magnetismo, ma è stato anche il primo ad identificare il benzene e a determinarne i costituenti, 6 carboni e 6 idrogeni, sebbene non abbia compreso come questi nuclei fossero uniti. Le persone che per prime descrissero la struttura del benzene così come oggi la conosciamo furono il chimico scozzese Archibald Scott Couper (1831-1892) e il tedesco Josef Loschmidt (1821-1895), senza tuttavia portare nessuna evidenza di tipo empirico, cioè scientifico. Chi fece il passo decisivo in tal senso fu Friedrich August Kekulé (1829-1896), nel 1865. Ecco le parole con le quali Kekulé descrive il momento in cui capì come i nuclei del benzene fossero legati
La regoletta del "4n+2" è invece dovuta a Huckel, sul quale, quando avrò tempo, scriverò qualcosa di più ...
Nomenclatura delle molecole contenenti un anello benzenico
[modifica | modifica sorgente]Se l'anello benzenico è l'unico gruppo funzionale presente su una catena alchilica, la molecola è considerata come un benzene sostituito. Se l'anello benzenico è considerato come sostituente viene definito gruppo fenilico. Ad alcuni gruppi caratterizzati da un anello benzenico sono stati attribuiti nomi di fantasia, ancora molto comuni e, dunque, da ricordare. Tra questi è bene fin da subito focalizzare l'attenzione sul gruppo nitro, ed in particolare sulla disposizione dei suoi legami e cariche, a causa della difficoltà che gli studenti di solito incontrano nel ricordarli.

|

| ||||
| Nomi comuni di alcune molecole con anelli benzenici sostituiti. Da sinistra a destra: Fenolo; Toluene; Anilina; Nitrobenzene; Acido benzoico | |||||
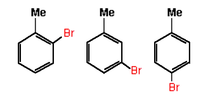
Orto - Meta - Para: Se ci sono due sostituenti il gruppo a priorità inferiore si dice in orto a quello a priorità superiore se unito al carbonio 2 dell'anello benzenico, in meta se unito al carbonio 3, in para se al carbonio 4.

|
|
| A sinistra: Impiego della nomenclatura orto,meta e para A destra: Orto,meta e para bromotoluene | |
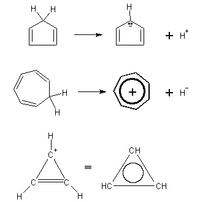
Molecole aromatiche policicliche o NON neutre
[modifica | modifica sorgente]È necessario che la caratteristica della ciclicità di una molecola aromatica vada intesa in senso esteso. Le molecole policicliche possono essere aromatiche, purché il loro perimetro rispetti le regolette della risonanza (compreso il numero 4n+2). Ecco alcune molecole aromatiche:
Molecole aromatiche con atomi diversi dal carbonio
[modifica | modifica sorgente]
|

|

|
Sinistra: Furano Centro: Tiofene Centro: 2H-Pirano | |
Perché una molecola sia aromatica non è obbligatorio sia caratterizzata solo da carboni e idrogeni. Il furano, ad esempio, è una molecola aromatica benché l'anello che la caratterizza sia costituito anche da un ossigeno. Gli atomi diversi dal carbonio e dall'idrogeno vengono indicati col termine di eteroatomi e le molecole vengono dette eterocicliche. Le molecole eterocicliche rivestono un ruolo particolare nelle molecole del DNA e del RNA. Ecco perché le descriverò estesamente in questo capitolo, immediatamente precedente a quello dedicato a DNA ed RNA.
Approfondimenti
[modifica | modifica sorgente]Come misurare la lunghezza del legame carbonio-carbonio del naftalene col righello