Chimica organica/Aromatici Proprieta
Punto di ebollizione degli alogenuri arilici[modifica]
|
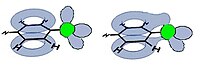
| ||||||
| Punto di ebollizione di alcuni alogenuri arilici e rappresentazione qualitativa degli orbitali del clorobenzene | |||||||
Tutti gli alogenuri arilici hanno una consistenza oleosa a temperatura ambiente. Per intuire quali interazioni attraggano le molecole le une alle altre è opportuno considerare che il punto di ebollizione cresce con la diminuzione dell'elettronegatività dell'alogeno. Questo esclude che le forze attrative di maggior intensità siano di tipo dipolo-dipolo. Per rafforzare questa ipotesi si può inoltre considerare che lo iodio ha una elettronegatività simile a quella del carbonio, quindi nel caso di questa molecola di dipolo permanente non ha quasi senso parlare. Lo schema a destra mostra come esista una sovrapposizione tra gli orbitali di tipo π dell'anello benzenico e uno dell'alogeno, che ospita una delle sue coppie di non legame. Benché questa sovrapposizione sia solo parziale, rende la molecola maggiormente polarizzabile rispetto ad un semplice benzene. Le forze intermolecolari più significative tra queste molecole sono dunque quelle di dispersione di London. La scala delle temperature di ebollizione degli alogenuri arilici è dunque legata al numero di elettroni della molecola, che cresce passando da cloro a bromo a iodio. Una ulteriore conseguenza notevole della sovrapposizione tra orbitali sopra descritta è che il legame carbonio-alogeno è più forte rispetto ad un semplice legame σ. Questo ha effetti rilevanti sulla reattività di queste molecole, che verrà descritta in un prossimo capitolo.
Acidità e basicità dei gruppi legati ad un anello aromatico[modifica]
Un anello aromatico rende possibile una estesa delocalizzazione di cariche positive o negative cedute da gruppi ad esso legati. Questo può acuire le caratteristiche tipiche di tali gruppi, ad esempio l'acidità o la basicità.
Acidità del fenolo vs acidità del cicloesanolo[modifica]
La molecola del fenolo è più acida del corrispondente alcano non aromatico, il cicloesanolo (pKa ≅ 10 contro 18 ). Per ricercare una interpretazione a questa osservazione è opportuno seguire i passi indicati in questa sezione a proposito degli equilibri acido-base delle molecole alifatiche.
- Si scrivono le reazioni
- Si nota come nel cicloesanato la carica negativa non possa essere stabilizzata né per effetto induttivo, né per effetto coniugativo dal gruppo alchilico.
- Al contrario la carica negativa del fenato può essere efficacemente delocalizzata per risonanza sull'anello benzenico, come si evince dalle strutture limite di risonanza

- Si può concludere che la specie più acida è quella che da origine alla base coniugata dalla minore energia potenziale. In questo caso si tratta dello ione fenato.
Acidità del fenolo vs acidità del fenolo sostituito[modifica]
Nel fenato la coppia di elettroni che dall'ossigeno si sposta sull'anello è ospitata dai carboni in orto e in para al carbonio che lega l'ossigeno. Se in tali posizioni l'idrogeno è sostituito da un gruppo a maggior attrazione elettronica rispetto ad un idrogeno, la molecola risulta più acida del fenolo. Per capire se un gruppo sia complessivamente a rilascio o ad attrazione elettronica rispetto ad un idrogeno è prudente, come primo passaggio, prendere in considerazione l'effetto induttivo e quello coniugativo in modo separato e solo in un secondo momento giudicare come questi due effetti si combinino. Questa procedura "prudente" risulta utile in particolare quando i due effetti siano opposti, cioè l'uno ad attrazione e l'altro a repulsione. Per quest'ultimo caso è possibile dividere in due categorie i gruppi che normalmente si incontrano negli studi di base di chimica organica:
- Negli alogeni, come vedremo nel dettaglio tra poco, l'effetto coniugativo è meno intenso rispetto a quello induttivo.
- Tutti gli altri gruppi hanno un effetto coniugativo che tende a prevalere rispetto a quello induttivo.
- p-nitrofenolo - gruppo nitro in para ad attrazione elettronica sia per effetto induttivo che per effetto coniugativo
Per confrontare l'acidità di fenolo e p-nitrofenolo è conveniente, come già visto per il confronto precedente, comparare la stabilità delle due basi coniugate.
Il gruppo nitro del p-nitrofenato è, per effetto induttivo, a maggior attrazione elettronica rispetto ad un idrogeno, poiché costituito da nuclei più elettronegativi. Per effetto coniugativo risulta pure a maggiore attrazione elettronica. Per convincersene è necessario, come al solito, disegnare tutte le strutture di risonanza possibili
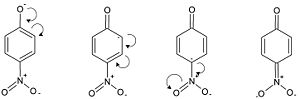
Le prime tre strutture di risonanza sono le stesse che possono essere scritte per il fenato. La quarta, che prevede la carica negativa sul gruppo nitro, è in più. Quest'ultima stabilizza particolarmente la carica negativa, poiché prevede la sua localizzazione su un ossigeno, in grado di sostenerla grazie alla sua elettronegatività. Nel caso del p-nitrofenolo, dunque, effetto induttivo e coniugativo agiscono in sinergia e attraggono la carica negativa della base coniugata, stabilizzandola di più della carica negativa del semplice fenolo. Non stupisce, dunque che il p-nitrofenolo abbia una Ka ≅ 7 e-8, superiore a quella del fenolo.
Le stesse considerazioni fatte per il p-nitrofenolo valgono per l'o-nitrofenolo, dal momento che anche per la base coniugata a questo è possibile scrivere una struttura limite di risonanza che prevede la carica negativa localizzata sul gruppo nitro
- m-nitrofenolo - gruppo nitro in meta ad attrazione elettronica solo per effetto induttivo
Nessuna strutture limite di risonanza del fenato prevede la carica negativa localizzata sul carbonio in meta all'ossigeno. Non stupisce pertanto che non possa essere scritta nessuna struttura limite che preveda la carica negativa sul gruppo nitro. Rimane il solo effetto induttivo, che rende il m-nitrofenolo comunque più acido del fenolo, ma meno di o- e p-nitrofenolo.
- o-clorofenolo - cloro in orto ad attrazione elettronica per effetto induttivo, a rilascio per effetto coniugativo
Il cloro per effetto coniugativo rilascia carica sui carboni in orto e para rispetto a quello cui è legato. É, viceversa, ad attrazione per effetto induttivo. Il p-cloro-fenolo ha una Kadi 6.3 e-10, superiore dunque a quella del fenolo. Questo ci dice che l'effetto coniugativo perde rispetto a quello induttivo. Il motivo della scarsa efficacia dell'effetto coniugativo è da ricercare nel fatto che i legami tra l'alogeno e il carbonio non sono molto forti o, detto con altre parole, abbassano poco l'energia potenziale della molecola. Questi legami sono deboli perché si stabiliscono tra nuclei di periodi diversi, quindi nascono dalla sovrapposizione, poco estesa, tra orbitali di diversa dimensione. La stessa considerazione può essere fatta per tutti gli alogeni, anche per il fluoro. Benché quest'ultimo sia dello stesso periodo del carbonio, infatti, presenta una elettronegatività sensibilmente maggiore che fa vincere ancora una volta l'effetto induttivo rispetto al coniugativo.

- o-difenolo - gruppo idrossilico in orto ad attrazione elettronica per effetto induttivo, a rilascio per effetto coniugativo
Le formule di risonanza che possono essere scritte per il gruppo -OH sono identiche a quelle che possono essere scritte per gli alogeni, grazie alle coppie di elettroni di non legame che possono essere delocalizzate sull'anello. L'efficacia di tali formule, tuttavia, è superiore, dato che ossigeno e carbonio fanno parte dello stesso periodo e il legame tra loro è più forte rispetto al corrispettivo tra carbonio e alogeno.
Basicità dell'anilina vs basicità della cicloesilammina[modifica]
La disponibilità della coppia di elettroni di non legame localizzata sull'azoto della anilina può essere confrontata con quella della cicloesilammina impostando un ragionamento analogo a quanto visto per il fenolo e il cicloesanolo. Naturalmente opposta è la caratteristica osservata, opposta è quindi la conclusione che si trae dal confronto.
La coppia di elettroni di non legame della cicloesilammina non può essere delocalizzata sull'anello né per effetto coniugativo, né per effetto induttivo; l'omolaga coppia della anilina, al contrario, può essere delocalizzata sull'anello per effetto coniugativo. Le strutture limite di risonanza che possono essere scritte sono analoghe a quelle già viste per il fenolo, per cui non è il caso di riproporle. Si può concludere dunque che la basicità dell'anilina è inferiore rispetto a quella della cicloesilammina.
Tutti i gruppi che sostituiscano formalmente un idrogeno dell'anello che rendano peggiore la delocalizzazione innalzano la basicità della anilina. Un esempio in tal senso è dato dai gruppi alchilici, a rilascio elettronico, in orto o para al gruppo amminico. Un altro esempio è dato dal gruppo OMe della o-anisidina, a rilascio elettronico poiché l'effetto coniugativo, a rilascio, prevale su quello induttivo, ad attrazione.

Proprietà fisiche legate all'acidità delle molecole aromatiche[modifica]
Le molecole in forma ionica sono decisamente più solubili in solventi polari, tipicamente l'acqua, rispetto alle corrispondente forma neutra. Una prova della superiore acidità del fenolo rispetto al cicloesanolo può essere ottenuta sfruttando questo principio. In ambiente basico, infatti, il fenolo risulta solubile, il cicloesanolo no.




