Chimica organica/Eterociclici
Composti eterociclici che si incontrano frequentemente in Chimica Organica[modifica]
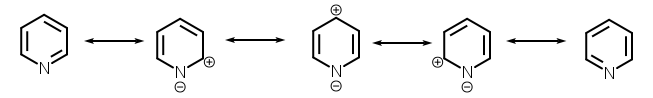
In chimica organica gli atomi che formalmente sostituiscono il carbonio nelle molecole etero-aromatiche sono, solitamente, ossigeno, azoto e zolfo. Perché in tali molecole si possa stabilire la corrente d'anello questi atomi devono partecipare con i propri orbitali alla formazione del sistema di orbitali π. Nella Pridina, ad esempio, l'azoto, così come i 5 carboni, è ibridato sp2. 2 degli orbitali sp2 dell'azoto sono sovrapposti ai corrispettivi dei carboni, dando origine ad altrettanti legami σ. La coppia di elettroni di non legame dell'azoto occupa l'orbitale sp2 rimanente e non entra dunque nel computo degli elettroni π. L'orbitale p non ibridato dell'azoto è sovrapposto ai corrispettivi dei carboni, dando vita al sistema di legami π. La molecola, dunque, possiede complessivamente 6 elettroni π ed è pertanto aromatica.
La presenza di un eteroatomo porta ad una distribuzione disomogenea della carica, cioè fa sì che la molecola assuma le caratteristiche tipiche di un dipolo elettrico permanente. Per alcune delle molecole descritte sotto è possibile predire qualitativamente la direzione e la grandezza del momento dipolare. Nella piridina la coppia di non legame dell'azoto fa intuire che il momento dipolare sia orientato dall'azoto verso il carbonio 3. Nel furano, nel pirrolo e nel tiofene l'eteroatomo è più elettronegativo dei carboni che completano l'anello. Questo fa intuire che il vettore che rappresenta il momento dipolare sia diretto verso l'eteroatomo stesso. Il momento dipolare è maggiore nel furano, rispetto al pirrolo, perché l'ossigeno è più elettronegativo dell'azoto. Tra pirrolo e tiofene, ad avere il momento dipolare maggiore è il tiofene, benché l'azoto sia più elettronegativo dello zolfo. Per comprendere il motivo di questa apparente contraddizione è necessario ricordare che il momento dipolare è il prodotto delle cariche per la distanza che le separa. La distanza tra i carboni e lo zolfo del tiofene è superiore a quella tra carboni ed azoto nel pirrolo, poiché lo zolfo appartiene al periodo successivo a quello dell'azoto.
| Alcuni eterociclici a 4 atomi | Eterociclici a 5 atomi. Quelli insaturi sono aromatici. | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| ||||||||||||||||||||
Gli eterociclici la cui struttura è alla base del DNA
| Purina | Pirimidina | Imidazolo |
|---|---|---|

|

|

|
La purina è una molecola organica eterociclica aromatica, composta da un anello pirimidinico fuso con un anello di imidazolo.
Reattività dei composti eterocicli aromatici[modifica]
La distorsione del sistema π negli eterocicli fa sì che l'energia di coniugazione sia minore (come riferimento, quella del benzene è 36 kcal/mol) e corrispondentemente la reattività è fortemente influenzata
| Composto | Eteroatomo | Energia di coniugazione kcal/mol |
|---|---|---|
| Piridina | N | 23 |
| Pirrolo | N | 21 |
| Furano | O | 16 |
| Tiofene | S | 29 |
L'eteroatomo contribuisce al sestetto aromatico con un suo doppietto solitario: le forme di risonanza avranno dunque una carica formale positiva sull'eteroatomo e una negativa sugli atomi di carbonio in α
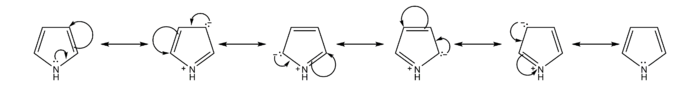
Gli eterocicli aromatici sono quindi più reattivi del benzene nelle reazioni di sostituzione elettrofila aromatica, e la posizione più attiva è in α all'eteroatomo. Il tiofene si trova come impurezza nel benzene commerciale e può essere eliminato lavando il benzene con acido solforico a temperatura ambiente: in tali condizioni solo il tiofene viene solfonato ed tale prodotto è separato grazie a successivi lavaggi alcalini acquosi[2]. I politiofeni trovano recente applicazione nei LED organici (OLED) e come polimero conduttore.
Nel caso del furano, la sua bassa energia di coniugazione lo rende così reattivo da rendere difficile il controllo del numero di sostituenti, e permette all'anello di comportarsi anche come un diene, dando per esempio reazioni di Diels-Alder. Il furano dà reazioni di polimerizzazione in presenza di acidi.
Nella piridina, il doppietto solitario non è condiviso nel sistema aromatico e le forme di risonanza mostrano gli atoni di carbonio in posizione 2 e 4 con una carica positiva
La piridina è disattivata nelle reazioni di sostituzione elettrofila aromatica e reagisce in posizione 3 e 5 solo in condizioni piuttosto drastiche.
Polifenoli dell'uva[modifica]
Flavonoidi[modifica]

I composti flavonoidi devono il loro nome al catione flavilio (o 2-fenil-benzopirillio, se considerato come derivato fenilico del benzopirillio). Tra di essi spiccano gli antocianidine, poiché uniche ad essere cariche positivamente. Quando le antocianidine sono glicosilate, cosa che spesso accade all'altezza del carbonio 3, prendono il nome di antocianine. Come mostrato nello schema sotto il gruppo fenilico può reggere diversi sostituenti.
Fino al 2003 sono state contate più di 400 antocianine diverse[3] L'attacco elettrofilo da parte di protoni, regolato come intuibile dal pH, modula la lunghezza del sistema di doppi legami coniugati, e dunque il colore, come mostrato qui. Ecco perché alcune antocianine possono essere usate come indicatori acido-base.
| Flavonoli | R1 | R2 | R3 | 
|
| Quercetina | -OH | -OH | -H | |
| Camferolo | -H | -OH | -H | |
| Miricetina | -OH | -OH | -OH | |
| Isoramnetina | -H | -OH | -OCH3 |
| Antocianidine | R1 | R2 | R3 | R4 | R5 | R6 | R7 | 
|
| Aurantinidina | -H | -OH | -H | -OH | -OH | -OH | -OH | |
| Cianidina | -OH | -OH | -H | -OH | -OH | -H | -OH | |
| Delfinidina | -OH | -OH | -OH | -OH | -OH | -H | -OH | |
| Europinidina | -OCH3 | -OH | -OH | -OH | -OCH3 | -H | -OH | |
| Luteolinidina | -OH | -OH | -H | -H | -OH | -H | -OH | |
| Pelargonidina | -H | -OH | -H | -OH | -OH | -H | -OH | |
| Malvidina | -OCH3 | -OH | -OCH3 | -OH | -OH | -H | -OH | |
| Peonidina | -OCH3 | -OH | -H | -OH | -OH | -H | -OH | |
| Petunidina | -OH | -OH | -OCH3 | -OH | -OH | -H | -OH | |
| Rosinidina | -OCH3 | -OH | -H | -OH | -OH | -H | -OCH3 |
| Flavanoli e Flavani | |
| Monomeri (Catechine) | Polimeri (Pro-antocianidine) |
 | |
Alcuni di questi composti mostrano attività antiossidante e possono pertanto avere un effetto positivo sull'organismo umano se introdotti con la dieta. Un primo passo verso la dimostrazione di un loro effetto consiste nel verificare che essi, se ingeriti, non vengano escreti tal quali. Recentemente questo è stato mostrato per alcuni antociani, sia sul topo che sull'uomo. Per un approfondimento si veda il riferimento in bibliografia.[4]
Non flavonoidi[modifica]
| Acidi Benzoici | R1 | R2 | R3 | R4 | 
|
| Acido para-idrossibenzoico | -H | -H | -OH | -H | |
| Acido protocatechico | -H | -OH | -OH | -H | |
| Acido vanillico | -H | -OCH3 | -OH | -H | |
| Acido gallico | -H | -OH | -OH | -OH | |
| Acido siringico | -H | -OCH3 | -OH | -OCH3 | |
| Acido salicilico | -OH | -H | -H | -H | |
| Acido gentisico | -OH | -H | -H | -OH |
| Acidi Cinnamici | R1 | R2 | 
|
| Acido cinnamico | -H | -H | |
| Acido p-cumarico | -OH | -H | |
| Acido ferulico | -OH | -OCH3 | |
| Acido caffeico | -OH | -OH |
Bibliografia e note[modifica]
- ↑ Paclitassolo, versione animata
- ↑ Beckert, R. (Ed), Organikum (22 ed.), Wiley-VCH, 2004. ISBN 3527311483
- ↑ J.M. Kong, L.S. Chia, N.K. Goh, T.F. Chia and R. Brouillard. Analysis and biological activities of anthocyanins. Phytochemistry. 64:923-33 (2003)
- ↑ T.K. McGhie, G.D. Ainge, L.E. Barnett, J.M. Cooney and D.J. Jensen. Anthocyanin Glycosides from Berry Fruit Are Absorbed and Excreted Unmetabolized by Both Humans and Rats. J. Agric. Food Chem., 51:4539 -4548 (2003)