Chimica organica/Carboidrati
Considerazioni generali
[modifica | modifica sorgente]I carboidrati, detti anche zuccheri o saccaridi, sono poliidrossi aldeidi o poliidrossichetoni. Si dicono monosaccaridi se caratterizzati da una sola unità contenente un gruppo carbonilico, disaccaridi e polisaccaridi se costituiti da 2 o molte unita' monosaccaridiche rispettivamente.
Nomenclatura non sistematica dei monosaccaridi
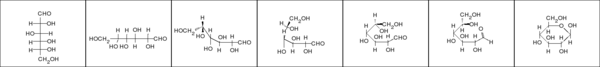
[modifica | modifica sorgente]| Due chetotetrosi | D-glucosio | D-fruttosio | D-galattosio | |
|---|---|---|---|---|
 |
 |
 |
 | |
| gliceraldeide (L - D) | ||||

| ||||
- Ai monosaccaridi è attribuita una elevata serie di nomi di fantasia, probabilmente a causa della loro importanza e diffusione. Tale nomenclatura è tutt'ora ampiamente in uso e va pertanto conosciuta, almeno in alcuni suoi aspetti. I nomi di fantasia dei monosaccaridi sono caratterizzati dal suffisso osio (o oso) e dal prefisso aldo o cheto che indica il gruppo funzionale. La parte centrale del nome indica il numero dei carboni. A destra sono mostrati due chetotetrosi: cheto = gruppo chetonico, tetr = 4 carboni, osi = zuccheri.
- Poiché i carboidrati sono "poliidrossi..."", essi reggono per definizione almeno 2 gruppi idrossilici, e dunque sono caratterizzati almeno da 3 carboni. La gliceraldeide (2,3-diidrossi-propanale) è dunque lo zucchero più semplice. Il carbonio centrale, chirale, fa sì che della gliceraldeide esista una coppia di enantiomeri. La chiralità dei rispettivi centri chirali può essere specificata secondo le regole proposte da Cahn, Ingold e Prelog. È tuttavia ancora diffusissima l'abitudine di identificare con le lettere D e L gli enantiomeri che fanno ruotare il piano della luce polarizzata in senso rispettivamente destrogiro e levogiro. In sintonia con questa definizione, tutti gli zuccheri a catena più lunga sono identificati come D o L in base alla chiralità del carbonio più lontano dal gruppo funzionale. Se la chiralità di tale carbonio è la medesima di quello della D gliceraldeide, lo zucchero è definito D. L in caso contrario. È implicito, ma bene sottolineare, che per tali zuccheri D ed L indicano la disposizione nello spazio dei gruppi legati all'ultimo carbonio, non indicano affatto la rotazione del piano della luce polarizzata. In blu, nella tabella, sono mostrati tre zuccheri i cui nomi di fantasia sono particolarmente noti.
Struttura lineare - struttura ciclica
[modifica | modifica sorgente]| Da catena aperta ad anello a 6 termini (piranosico) del D-Glucosio |
|---|
|
La presenza negli zuccheri di un gruppo carbonilico e di gruppi idrossilici rende possibile una addizione nucleofila dei secondi sul primo, che comporta la chiusura ad anello della molecola. Tale reazione non richiede catalisi acida per avvenire in modo quantitativamente cospicuo. In questo differisce profondamente dalla addizione nucleofila di un alcol ad una aldeide, descritta in questa pagina. Questa differenza può essere interpretata osservando separatamente i contributi entropico ed entalpico alla reazione.
- L'addizione nucleofila è intramolecolare nel caso degli zuccheri, intermolecolare nel caso dell'addizione di un alcol ad una aldeide. Nel primo caso da una molecola se ne ottiente una, e dunque il contributo entropico è pari a zero, nel secondo caso da due molecole se ne ottiene una, e dunque il contributo entropico è sfavorevole.
- Il contributo entalpico è uguale in entrambi i casi, dato che in ciascuno si rompe un legame π e se ne forma uno σ.
- Nel primo caso ΔG è determinato dunque solo dal contributo entalpico. Nel secondo caso prevale il contributo entropico, sfavorevole, sul favorevole contributo entalpico. In effetti in soluzione acquosa gli zuccheri si trovano prevalentemente in forma emiacetalica.
Questa reazione riveste un ruolo così importante nella chimica degli zuccheri che risulta opportuno seguirla passo-passo, prendendo ad esempio il glucosio, ed in particolare il suo gruppo carbonilico e l'OH legato al carbonio 4.
| β-D-glucopiranosio | α-D-glucopiranosio |
|---|---|
 |
 |
- Passo 1: Spesso disegnare la molecola in modo opportuno rappresenta una fonte di difficoltà. Può aiutare a tal fine notare come l'emiacetale possa assumere due conformazioni a sedia, una delle quali risulta molto più stabile dell'altra, come vedremo tra breve. La rotazione di 90 gradi in senso orario della molecola a catena aperta predispone alla disegno della conformazione a sedia più stabile ed è pertanto da preferire.
- Passi 3-6: I passaggi 3-6 servono solo ad avvicinare il cabonio carbonilico all'OH giusto.
- Passo 6:Il passaggio che conta è il sesto. Poiché il carbonio del gruppo carbonilico è ibridato sp2, i gruppi cui è legato identificano un piano. L'OH può attaccare il carbonio carbonilico sia da sopra che da sotto rispetto ad esso. Poiché il carbonio al termine dell'attacco è ibridato sp3, questo dà origine a due diastereomeri. La lettera α identifica quello originato dall'attacco dall'alto (così che il nuovo gruppo OH si trovi in basso). La lettera β identifica l'altro diastereomero. L'anello che si forma è a 6 termini (5 carboni ed un ossigeno) e viene definito piranosico, per la somiglianza alla molecola del pirano.
I diastereomeri degli zuccheri che differiscono per la chiralità del carbonio emiacetalico o emichetalico, sono definiti anomeri. Ad essi ci si riferisce anche col termine di epimeri, poiché differiscono per la chiralità di uno di molti centri chirali.
Nominare le due sedie di un isomero piranosico
[modifica | modifica sorgente]Da completare con http://www.ub.uib.no/elpub/2001/h/415001/Hovedoppgave.pdf
Mutarotazione
[modifica | modifica sorgente]
Esattamente come la formazione degli acetali per addizione intramolecolare è spontanea in ambiente acquoso, così lo è la sua reazione inversa. È intuibile pertanto come siano in equilibrio tra loro tutti gli emiacetali che si possono formare per attacco nucleofilo da parte di ciascuno gruppo idrossido dello zucchero. La percentuale relativa di ciascuno dipende dalla sua stabilità.
- Nel caso del D-Glucosio la forma a catena aperta è poco stabile rispetto a quelle a catena chiusa, ma comunque importante poiché passaggio obbligato per la conversione di ciascuna nelle altre.
- I due isomeri piranosici, dei quali è rappresentata solo la conformazione a sedia più stabile, la 4C1, sono caratterizzati dalla stabilità maggiore, poiché gli anelli a 6 termini risentono meno della tensione d'anello. Tra i due anomeri è più stabile il β, poiché tutti i gruppi ingombranti stericamente sono rivolti in direzione equatoriale. Ecco perché in una soluzione acquosa è possibile identificare il 65% del glucosio in configurazione β e solo il 35% in α.[1]
- Gli isomeri chiusi ad anello a 5 elementi, detto furanosico per la somiglianza al furano, hanno una certa stabilità, ma inferiore a quella dei piranosici, per cui sono presenti in soluzione acquosa solo in tracce.
- Anche altri isomeri sono rintracciabili in soluzione, ma pure loro in tracce.
- NOTA BENE: È ovvio ma bene sottolineare che ciascuna delle configurazioni illustrate (piranosica, furanosica etc...) può assumere la tipica serie di conformazioni viste per il cicloesano e ciclopentano nei capitoli precedenti. Gli anelli piranosici, in particolare, possono dare origine a 2 conformazioni a sedia. In realtà in ogni libro di testo non vengono considerate altre conformazioni che la più stabile, poiché nella maggioranza dei casi troppo ricche di energia rispetto a questa.
Visualizzare la mutarotazione
[modifica | modifica sorgente]| β-D-fruttofuranosio | α-D-fruttofuranosio |
|---|---|
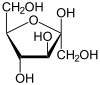 |
 |
Gli anomeri α e β di un monosaccaride sono tra loro diastereomeri, poiché non sovrapponibili e non speculari ma caratterizzati da medesima formula molecolare e medesima connettività tra atomi. In quanto diastereomeri sono caratterizzati da diverse proprietà chimico-fisiche e sono pertanto separabili e ottenibili allo stato solido. Se si preparano una soluzione 1 molare di α-D-glucopiranosio e una soluzione 1 molare di β-D-glucopiranosio e si misura la loro capacità di fare ruotare il piano della luce polarizzata a 25 °C, si ottengono rispettivamente i valori di +112° e +18.7°. Se si attende che le due forme emiacetaliche entrino in equilibrio con la comune forma aperta e, attraverso di questa, tra loro, si ottiene per entrambe le soluzioni un valore di +52.7, media pesata dei rispettivi poteri rotatori e delle percentuali relative in soluzione.
Ciascuno zucchero fa storia a se per quanto riguarda la stabilità tra i vari isomeri, poiché tra di essi varia il numero e l'orientamento dei diversi gruppi ingombranti. Per quanto riguarda alcuni aldosi si vedano le references riportate negli approfondimenti.
Nel caso del fruttosio, ad esempio, l'isomero più stabile in soluzione acquosa è quello β-piranosico[2] (70-75%), ma il β-furanosico rappresenta ben il 20-23%, l'α-furanosico il 5%, l'α-piranosico lo 0-2% e la forma a catena aperta lo 0-0.7%.
Glicosidi
[modifica | modifica sorgente]In presenza di un alcol e di un acido forte le aldeidi e i chetoni, come mostrato nel capitolo loro dedicato, possono dare origine ad emiacetali (o emichetali) e, se la concentrazione di alcol lo permette, ad acetali (o chetali). In presenza di un acido forte e di un alcol anche gli zuccheri in configurazione ciclica (ovvero emiacetalica o emichetalica) possono dare origine ad acetali o chetali i quali, ma guarda un po', sono definiti nel caso degli zuccheri con nomi di fantasia: glicosidi. La formazione dei glicosidi prevede un carbocatione (ibridato sp2!) come intermedio. L'attacco nucleofilo a questo può avvenire dalle due parti del piano identificato dai 3 gruppi legati al carbonio. Ecco perché l'addizione nucleofila del metanolo al β-D-glucopiraosio mostrata nell'esempio da origine al metil-α-D-glucopiranoside e al metil-β-D-glucopiranoside Come nel caso di qualunque altro alcol e molecola caratterizzata da un gruppo carbonilico la reazione inversa, ovvero la formazione degli zuccheri a catena aperta a partire da quelli in forma acetalica e chetalica, è vincolata alla presenza di acido, che funge da catalizzatore.
| Emiacetale + alcol + catalisi acida = acetale |
|---|
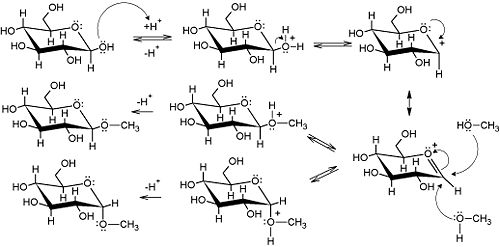
|
In natura esistono molti casi in cui gli zuccheri danno origine ad acetali per attacco nucleofilo da parte di carotenoidi. Per chi voglia approfondire l'argomento ecco un riferimento.[3]
Disaccaridi
[modifica | modifica sorgente]Un disaccaride è dato dal legame tra due monosaccaridi. Il legame che li unisce è un legame glicosidico. Il nome di tale legame deriva dal fatto che si può considerare originato da un attacco nucleofilo al carbonio emiacetalico di un monosacaride da parte di una qualunque funzione alcolica che caratterizza un secondo monosaccaride. Ad esempio il maltosio, al centro sotto, si può considerare formato per addizione nucleofila all'α-D-glucopiranosio (a sinistra) da parte di β-D-glucopiranosio (a destra). Poiché la funzione alcolica che ha donato la necessaria coppia di elettroni è quella legata al carbonio 4, la molecola di maltosio può essere chiamata 4-O-(α-D-glucopiranosil)-β-D-glucopiranosio.
Nella molecola di saccarosio il legame glicosidico lega i due carboni anomerici. Si può dunque immaginare come originato dall'attacco del β-D-fruttosio all'α-D-glucosio, dando origine al nome di 1-O-(α-D-glucopiranosil)-β-D-fruttofuranosio; si può considerare originato dall'attacco del α-D-glucosio al β-D-fruttosio, dando origine al nome di 1-O-(β-D-fruttofuranosil)- α-D-glucopiranosio.
Nomenclatura monosaccaride (carbonio → carbonio) monosaccaride: una maniera più semplice per nominare i polisaccaridi consiste nell'indicare i monosaccaridi che lo costituiscono inframmezzati dall'indicazione dei carboni interessati al legame secondo la simbologia (carbonio -> carbonio). Sfruttando il lattosio disegnato sotto per un semplice (e poco comune, trattandosi di un disaccaride) esempio, lo si può definire β-D-galattopiranosil (1->4) β-D-glucopiranosio. Occhio: il secondo anello è in forma emiacetalica e dunque il suo carbonio anomerico può andare incontro ad inversione della chiralità.
Come tutti gli acetali e i chetali, anche i glicosidi, se posti in ambiente acido, entrano in equilibrio con i rispettivi zuccheri a catena aperta. Per un esempio specifico si veda il capitolo sulla addizione e sostituzione nucleofila ai gruppi carbonilico e carbossilico delle molecole naturali.
| Saccarosio | Maltosio | Lattosio |

|

|
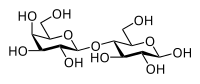
|
Zuccheri riducenti
[modifica | modifica sorgente]| Saggio di Tollens | Saggio di Fehling |

|
Sono detti riducenti gli zuccheri che possono essere ossidati da deboli reagenti ossidanti come il reattivo di Tollens o di Fehling. Ad effettuare la riduzione è il gruppo aldeidico libero. Troviamo il gruppo aldeidico
- nei monosaccaridi aldosi
- nei di e poli saccaridi che siano caratterizzati da uno o più monomeri aldosici che non siano in forma acetalica
- negli α-idrossichetoni
Per comprendere perché anche nelle soluzioni di α-idrossichetoni siano presenti tracce di monomeri caratterizzati da un gruppo aldeidico è necessario notare che i reattivi di Tollens e Fehling, che verranno descritto in dettaglio sotto, sono basici. In ambiente basico gli α-idrossichetoni sono caratterizzati dai seguenti equilibri tra tautomeri:

Saggio di Tollens
[modifica | modifica sorgente]Quando una aldeide o un chetone sono posti in una soluzione ammoniacale di nitrato di argento ( Ag(NH3)2+ ) essi possono ossidarsi riducendo l'argento(+1) ad argento(0), che si deposita sul recipiente di reazione dando quello che assomiglia ad uno specchio. Non fanno eccezione gli zuccheri a catena aperta, essendo poiidrossialdeidi o poliidrossichetoni.
Gli zuccheri in forma emiacetalica e emichetalica sono in equilibrio con le rispettive forme aperte e sono pertanto in grado di ridurre l'argento. L'ossidazione trasforma il gruppo funzionale carbonilico in carbossilico. Il nome dell'acido carbossilico si ottiene cambiandone la desinenza da oso a onico (ad esempio dal glucosio si ottiene l'acido gluconico). Date una occhiata in merito al Video indicato negli approfondimenti.
Gli zuccheri in forma acetalica o chetalica in ambiente neutro o basico NON sono in equilibrio con le rispettive forme aperte. Tutti gli zuccheri che si possono trovare in forma aperta o emiacetalica/emichetalica sono pertanto riducenti. Gli altri sono NON riducenti.
Alcuni casi specifici: Il saccarosio è NON riducente poiché entrambi i monomeri sono in forma acetalica/chetalica. Il maltosio è riducente poiché uno dei due monomeri è in forma emiacetalica. E la cellulosa? La possibilità che uno zucchero riduca l'argento dimostra che esiste, sebbene in minima percentuale, sotto forma di catena aperta. Solo in questa forma infatti è riducente. Da notare che man mano che la forma aperta si consuma per ossidazione, la sua scomparsa fa si che la catena chiusa di altre molecole di zucchero presenti in soluzione si apra. La trasformazione degli emiacetali in aldeidi è reversibile.
Saggio di Fehling
[modifica | modifica sorgente]Da ossido rameico a ossido rameoso
Bibliografia
[modifica | modifica sorgente]- ↑ F. Franks and P.J. Lillford and G. Robinson. J. Chem. soc. Faraday. Trans. I 85:2417 (1989)
- ↑ CHEMnetBASE CAS 30237-26-4
- ↑ H. Pfander. Carotenoids Glycosides. Pure & Appl. Chem., 47:121-128 (1976)
Approfondimenti
[modifica | modifica sorgente]- Come reperire sul web informazioni approfondite sui carboidrati?
- O. Bertau and R. Stenutz. Web resources for the carbohydrate chemist. Carbohydr. Res. 339:929-936 (2004)
- Per una "Chimica più ecologica", catalizzare l'idrolisi dei carboidrati con gli ultrasuoni
- N. Kardos and J-L. Luche. Sonochemistry of carbohydrate compounds. Carbohydr. Res. 332:115-131 (2001)
- Come si degrada la cellulosa in presenza di basi
- C.J. knill and J.F.Kennedy. Degradation of cellulore under alkaline conditions. Carbohydr. Polym. 51:281-300 (2003)
- Stabilità dei diversi isomeri di alcuni aldosi
- S.J. Angyal and V.A. Pickles Aust.J.Chem.. 25:1695 (1972)
- S.J. Angyal Angew.Chem. 81:172 (1969)
- M. Rudrum J.Chem.Soc. 1:52 (1965)
- Video di alcune reazioni descritte fino ad ora
 Saggio di Tollens dello specchio d'argento
Saggio di Tollens dello specchio d'argento Saggio di Fehling
Saggio di Fehling

