Chimica organica/Stereochimica
Introduzione
[modifica | modifica sorgente]Quando due o più molecole organiche diverse sono caratterizzate da una medesima formula bruta, esse sono identificate con il termine di isomeri. Una nomenclatura specifica per tali molecole è importante poiché esse sono caratterizzate da proprietà chimiche e fisiche diverse (a meno di coincidenze fortuite). Poiché l'argomento della isomeria è vasto e complesso, esso viene di solito discusso nei testi di base sulla Chimica Organica in modo semplificato e spesso, purtroppo, un po' disorganizzato. Questo testo, al fine della brevità, probabilmente non farà eccezione.
La suddivisione degli isomeri
[modifica | modifica sorgente]| Isomeri di Struttura | Stereoisomeri | Oggetti Enantiomeri | |
| n-pentano e iso-pentano | Enantiomeri | Diastereomeri | |

|

|
 
|
 |
Molecole diverse ma caratterizzate dalla medesima formula bruta sono isomeri di struttura quando i nuclei che le costituiscono sono legati in modo diverso, come capita in n-pentano e iso-pentano. Due isomeri i cui nuclei siano uniti in modo analogo sono stereoisomeri. Data una coppia di stereoisomeri, essi sono definiti in modo più specifico come enantiomeri quando siano l'uno l'immagine speculare dell'altro; diastereomeri quando non lo sono. Nota come i gruppi di molecole citati fino ad ora siano sottoinsiemi gli uni degli altri. Ad esempio due molecole diverse che siano l'una l'immagine speculare dell'altra sono isomeri ed in particolare stereoisomeri e ancora più nel dettaglio enantiomeri. Benché i termini fino ad ora introdotti siano stati attribuiti alle molecole, essi sono validi per ogni oggetto. Le mani, ad esempio, sono diverse e speculari. Dal parallelismo tra le mani e gli enantiomeri, questi ultimi sono anche detti molecole chirali (dal greco chiròs, mano).
Correlazione tra numero di carboni e numero massimo di possibili isomeri
[modifica | modifica sorgente]Quanti isomeri di struttura di un alcano caratterizzato da "n" carboni esistono al massimo? Il numero di isomeri possibili vengono calcolati secondo la teoria dei grafici di Arthur Cayley [1].
| Numero Carboni | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 15 | 20 | 30 |
| Numero isomeri | 2 | 3 | 5 | 9 | 18 | 35 | 75 | ~4750 | ~366000 | circa 4 miliardi |
Identificazione degli stereoisomeri 1
[modifica | modifica sorgente]- Molecole diverse = non sovrapponibili = con elementi di asimmetria
Per comprendere se due molecole speculari siano diverse, il criterio più spesso indicato nei libri di testo è la non sovrapponibilità. La definizione più spesso fornita di enantiomeri è dunque quella di molecole non sovrapponibili e speculari. Il criterio della sovrapponibilità è chiaramente poco pratico, specialmente quando non si possiedano dei modelli tridimensionali da confrontare, ma solo dei disegni. Un metodo alternativo si basa sulla constatazione che tutti gli oggetti (e dunque anche le molecole) non sovrapponibili alla propria immagine speculare sono caratterizzati da elementi di asimmetria, ovvero elementi rispetto ai quali la molecola è asimmetrica. Gli elementi di asimmetria sono centri, assi oppure piani di chiralità.
- Centri di chiralità
Il più comune centro di chiralità è rappresentato da un carbonio che leghi 4 gruppi diversi. Il Cloro-Fluoro-Bromo metano rappresentato sopra è un esempio. Tale immagine ribadisce inoltre il concetto che esistono due modi diversi in cui i 4 gruppi ad esso legati possano disporsi spazialmente.
- Assi di chiralità
Gli alcheni a doppi legami condensati sono chiamati alleni. Se i due carboni uniti con doppio legame al carbonio centrale reggono gruppi a due a due uguali (cloro e idrogeno nell'esempio a destra), la molecola non presenta elementi di simmetria e rappresenta pertanto uno di due enantiomeri.
- Piano di chiralità
Il doppio legame genera un piano ai due lati del quale si sviluppa la molecola del trans cicloottene
| Propil allene | Disposizione 3D degli orbitali p in un allene | Enantiomeri di un allene |

|

|

|
| Due esempi di molecole naturali con gruppi allenici | ||
 esa-4,5-dienoico |
 | |
| Esempio di piano di chiralità: R e S trans-cicloottene | Chiralità ottaedrica | |

|
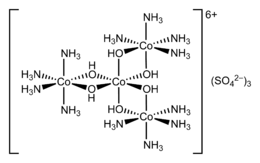
| |
Identificazione degli stereoisomeri 2
[modifica | modifica sorgente]- Molecole diverse = non sovrapponibili = senza elementi di simmetria
Benché tutte le molecole non sovrapponibili alla propria immagine speculare possiedano elementi di chiralità, non tutte le molecole che possiedono elementi di chiralità sono asimmetriche. Un caso specifico è dato dai composti meso, cioè molecole sovrapponibili pur caratterizzate da centri di chiralità.
L'isomero dell'acido tartarico a sinistra è sovrappobibile a quello a destra pur essendo caratterizzato da due centri chirali. Il criterio della presenza di elementi di chiralità è in questo caso fuorviante. Per delineare un criterio universale per dirimere ogni dubbio è opportuno definire le operazioni di simmetria di tipo S[2].
Una operazione di simmetria è una operazione geometrica effettuata sulla molecola, considerata come fosse un corpo rigido, che porti ciascun suo gruppo a coincidere con un altro identico.
Una operazione di tipo S prevede che tale sovrapposizione sia ottenuta per rotazione attorno ad un asse + successiva riflessione rispetto ad un piano perpendicolare all'asse stesso.
L'entità della rotazione è indicata, mediante un pedice, sotto forma di frazione di 360°. Una rotazione S1 si riduce ad un piano di simmetria (rotazione di 360°+riflessione); una rotazione S2 è un centro di simmetria ...
Dunque una molecola non è sovrapponibile alla propria immagine speculare quando non è caratterizzata da elementi di simmetria di tipo S, come negli esempi sotto a destra
| Acido D e L tartarico | Molecole non chirali a causa di ... | |
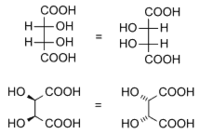
|
... simmetria S1 | ... simmetria S4 |

|
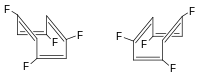
| |
Nomenclatura dei centri chirali
[modifica | modifica sorgente]Gli stereoisomeri non possono essere distinti sulla base delle regole per la nomenclatura fino a qui descritte, poiché presentano una identica connettività tra gli atomi che li costituiscono. Per descrivere la geometria degli elementi di asimmetria vengono applicate le convenzioni messe a punto da Cahn, Ingold e Prelog. Descriviamo tali convenzioni prendendo ad esempio il caso di un centro di chiralità rappresentato da un carbonio.
Per specificare in quale dei 2 modi possibili i gruppi legati ad un carbonio sono disposti, la IUPAC utilizza i prefissi (R) (dal latino rectus, destro) ed (S) (dal latino sinister, sinistro); per stabilire quale dei due sia (R) e quale (S) è sufficiente seguire alcun passi:
- Modo poco pratico
Questo modo è descritto in molti libri di Chimica Organica di livello universitario, nella versione "fondamenti". Il limite è il passaggio 2, che richiede parecchia immaginazione.
- Primo step: Si attribuisce la priorità ai 4 gruppi legati al carbonio. Il gruppo legato al carbonio chirale mediante l'atomo dal numero atomico maggiore ha priorità più alta. Se due gruppi sono legati all'atomo di carbonio chirale con atomi uguali si considerano i due successivi, se anche questi sono uguali si continua lungo le catene fino a quando viene individuata una differenza. I legami tripli e doppi si considerano come 3 e 2 legami semplici rispettivamente. Un carbonio legato ad un ossigeno mediante un doppio legame, ad esempio, si considera come legato a due ossigeni mediante legami semplici.
- Nel bromo cloro fluoro metano la priorità è Br>Cl>F>H
- Secondo step: Si immagina la molecola orientata nello spazio in modo che il gruppo a priorità più bassa sia dietro al carbonio chirale e gli altri protesi verso di noi.
- Terzo step: Si osservano i tre gruppi passando con lo sguardo dal gruppo a priorità più alta a quello a più bassa.
- se la rotazione dello sguardo è oraria si assegna il prefisso (R)
- se la rotazione dello sguardo è antioraria si assegna il prefisso (S)
I due modelli riportati in figura sono quindi, rispettivamente, dell'(R)-butanolo e dell'(S)-butanolo.
- Modo più pratico
Nel caso di molecole più complesse di quella mostrata risulta difficile immaginare la rotazione nello spazio necessaria a porre dietro al carbonio chirale il gruppo a più bassa priorità. Manipolare la molecola rappresentata mediante proiezione di Fisher risulta molto più pratico.
- Consideriamo l'enantionero a sinistra del butan-2-olo, rappresentato secondo le convenzioni di Fisher mantentendo, per chiarezza, l'indicazione dei legami rivolti verso l'osservatore e di quelli in direzione opposta.
- La priorità dei gruppi legati al centro chirale è H<CH3<CH2CH3<OH. Per porre l'idrogeno lontano dall'osservatore è sufficiente spostarlo in basso. Tale spostamento si ottiene in modo corretto immaginando di staccare ed invertire la posizione di 2 coppie di gruppi per volta, come indicato dalle frecce.
- Eseguire un numero dispari di spostamenti equivale a passare da un enantiomero all'altro! Ruotare la molecola di 90 gradi, equivale ad eseguire un numero dispari di spostamenti.
- È infine necessario scorrere con lo sguardo sui tre gruppi a rimanenti, da quello a priorità più alta a quello a priorità più bassa, per comprendere che quello osservato è l'enantiomero con centro chirale R.
Se una molecola è caratterizzata da n centri chirali, di ciascuno deve essere indicato se sia un centro R oppure S
Considerazioni geometriche sui diastereomeri
[modifica | modifica sorgente]| Esempi di enantiomeri e diastereomeri | ||||
| Eritrosio | Treosio | cis decalina | ||
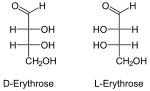
|

|

| ||
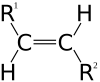
| Vista 3D del doppio legame di un alchene | Esempio di molecola cis | Esempio di molecola trans | trans decalina | |

|

|
|

| |
Mentre gli enantiomeri vanno a coppie, a parità di formula molecolare possono esistere più di due diastereoisomeri. A rendere possibile la presenza dei diastereomeri sono più centri chirali sulla stessa molecola, come nel caso di eritrosio e treosio, o la presenza di elementi che bloccano la molecola in una certa configurazione, come doppi legami o cicli. Solo in questo secondo caso esiste una nomenclatura specifica per distinguere i diastereomeri gli uni dagli altri.
Negli alcheni il doppio legame identifica un piano. Se a ciascuno dei due carboni sono legati gli stessi gruppi (nell'esempio un idrogeno e un fluoro) e i gruppi uguali si trovano dalla stessa parte rispetto al piano, l'alchene si dice di tipo cis. Se si trovano da parti opposte si dicono trans. Un alchene cis e uno trans sono ovviamente due diastereomeri, poiché non sovrapponibili e non speculari, ma di pari formula molecolare e connettività tra atomi. Come esercizio, notare che ciascuno dei due è caratterizzato da almeno un elemento di simmetria (il trans da un centro di simmetria), che lo rende sovrapponibile alla propria immagine speculare. Pertanto né l'isomero cis, né quello trans esistono come coppia di enantiomeri.
La nomenclatura cis-trans può essere impiegata anche nel caso di più doppi legami. In questo caso è necessario specificare la stereochimica di ciascuno. Ad esempio nella molecola 1,cis-3-pentadiene il legame che unisce il carbonio 3 al 4 è di tipo cis. La nomenclatura cis e trans è estensibile anche alle molecole cicliche, quali la decalina dell'esempio.
Nomenclatura E e Z
[modifica | modifica sorgente]
La nomenclatura E e Z è una estensione della cis trans, poiché si applica anche al caso in cui a stare dalla stessa parte o da parti opposte rispetto ad un elemento della molecola siano gruppi diversi. Si considera l'elemento che divide la molecola e i 4 gruppi che si trovano dalle due parti di tale elemento. Nel caso a destra, l'elemento che divide la molecola è la nuvola elettronica del legame π e i 4 gruppi sono Bromo, Cloro, Iodio e Idrogeno. Si considerano i 2 gruppi legati ad uno stesso carbonio e li si mette in ordine in base alle regole di Cahn, Ingold e Prelog. Si fa lo stesso con i gruppi legati al secondo carbonio. A destra, il cloro vince sull'idrogeno e lo iodio vince sul bromo. Se i gruppi a priorità più alta così determinati sono dalla stessa parte la molecola si dice Z (Zusammen - dal tedesco insieme), in caso contrario si dice E (Entgegen - dal tedesco opposti).
Tautomeria
[modifica | modifica sorgente]
Quando due molecole sono isomere ma possono convertirsi l'una nell'altra rapidamente, prendono il nome di tautomeri. Il loro equilibrio prende il nome di tautomeria. Il tipo di tautomeria più comunemente descritto dai libri di testo è la tautomeria cheto-enolica. Gli idrogeni in α a gruppi insaturi elettron-attrattori, per esempio un gruppo carbonilico, sono particolarmente acidi poiché il carbanione cui dà origine il distacco è stabilizzato per risonanza. Il carbanione può a propria volta essere ri-protonato all' atomo originario oppure all'altro atomo che porta la carica negativa. Nel primo caso si ottiene la molecola di partenza, mentre nell'altro si ottiene un'altra molecola che è in equilibrio con la prima.
I chetoni e le aldeidi con idrogeni in α danno vita alla tautomeria cheto-enolica, così detta perché il composto carbonilico è in equilibrio, grazie al distacco di un idrogeno in α, con un alcol vinilico (enolo). Un esempio è il metiletil chetone (1) e il 2-bunten-2-olo (2). Poiché il distacco degli idrogeni in α porta ad un enolo, questi vengono detti enolizzabili, oltre che acidi. I tautomeri sono molecole vere e proprie, non strutture limite di risonanza. Sono pertanto separabili, purché in completa assenza di acidi o basi (anche in tracce), per evitare la rapida interconversione. Tra un chetone e il corrisettivo enolo, la molecola più stabile dal punto di vista termodinamico è il chetone. Il rapporto enolo/chetone varia con la molecola e le condizioni sperimentali. In generale, più il gruppo insaturo è elettron-attrattore (ovvero più l'α-idrogeno è acido e l'anione stabilizzato per risonanza) e più le condizioni sono acide, maggiore è la frazione di enolo. Altri fattori che entrano in gioco sono l'ingombro sterico, che è alleviato nella forma enolica ove l'angolo di legame è 120°, e la possibilità di legami idrogeno intramolecolari in una delle forme.
| Equilibri tra forme cheto ed enolica | Altre coppie tautomeriche | ||||||||||||||||||||||||||||||
|
|
Proprietà degli enantiomeri
[modifica | modifica sorgente]La suddivisione degli stereoisomeri in diastereomeri e enantiomeri è motivata dal fatto che i diastereomeri presentano caratteristiche chimiche e fisiche diverse, a meno di coincidenze fortuite, mentre gli enantiomeri presentano nella maggior parte dei casi un comportamento analogo. Due enantiomeri differiscono nell'interazione con la luce polarizzata, causandone una rotazione di una medesima entità ma in direzione opposta. Per avere una idea di che cosa significhi polarizzare un fascio luminoso, due figure possono essere di aiuto. L'immagine a sinistra mostra come la luce sia dovuta a fotoni, ciascuno dei quali oscilla lungo un piano. Esistono filtri trasparenti a tutti i fotoni che si muovono lungo un singolo piano. La luce filtrata in questo modo si dice polarizzata. L'animazione a destra mostra un fascio di luce polarizzata filtrato da un vetro polarizzante. Quando le linee del filtro divengono perpendicolari al piano della luce polarizzata, nessun fotone è più in grado di passare.
| Onda elettromagnetica | Luce polarizzata da un filtro |

|

|
Il polarimetro è lo strumento solitamente impiegato per rilevare come una soluzione di una moleocola chirale interagisca con la luce polarizzata facendone ruotare il piano. Date un'occhiata alle belle immagini riportate in tale pagina. La voce polarizzatore di wikipedia spiega succintamente come sia possibile generare luce polarizzata e la voce polarimetro indica, in modo troppo coinciso, il funzionamento dello strumento.
Molecole prochirali
[modifica | modifica sorgente]
Alcune molecole che non hanno in sé centri chirali possono diventare chirali per reazione su un gruppo funzionale planare. Tali molecole ed il loro centro reattivo si dicono prochirali Un esempio classico è l'addizione al carbonile di un chetone od un'aldeide. A seconda che il nuovo gruppo si aggiunga su una faccia o l'altra, si ottengono i due enantiomeri della stessa molecola.
Si identificano le due facce prochirali con le sigle re e si (in analogia con R/S) a seconda che l'ordine di priorità dei gruppi siano visti in senso orario od antiorario, rispettivamente. Questa nomenclatura non implica che —per esempio— la reazione sulla faccia re dia l'enantiomero R, dipendendo l'esatta configurazione del prodotto dalla priorità del gruppo aggiunto.
Approfondimenti
[modifica | modifica sorgente]- Approfondimenti sugli elementi stereogenici o di chiralità
- Voce di wikipedia su simmetria degli oggetti per rotazione
- IUPAC: Terminologia base di stereochimica



