Biologia per il liceo/Le biotecnologie
La biotecnologia è l'uso di agenti biologici per il progresso tecnologico. La biotecnologia è stata utilizzata per l'allevamento di bestiame e colture molto prima che le persone comprendessero le basi scientifiche di queste tecniche. Dalla scoperta della struttura del DNA nel 1953, il campo della biotecnologia è cresciuto rapidamente sia attraverso la ricerca accademica che attraverso aziende private. Le applicazioni principali di questa tecnologia sono in medicina (produzione di vaccini e antibiotici) e in agricoltura (modifica genetica delle colture per aumentare le rese). La biotecnologia ha anche molte applicazioni industriali, come la fermentazione, il trattamento delle fuoriuscite di petrolio e la produzione di biocarburanti.
Le prime applicazioni delle biotecnologie
[modifica | modifica sorgente]
Le più antiche applicazioni della biotecnologia, conosciute da oltre 5.000 anni, sono la produzione di pane , vino o birra ( fermentazione alcolica ) utilizzando il lievito, che appartiene ai funghi . L'uso di batteri lattici ha permesso anche di produrre pasta madre (pane lievitato) e prodotti a base di latte acido come formaggio , yogurt , latte acido o kefir . Uno dei primi usi della bioingegneria, oltre alla nutrizione, fu la concia e il decapaggio delle pelli utilizzando feci e altri materiali contenenti enzimi per produrre pelle. Gran parte della biotecnologia si basava su questi processi produttivi fino al Medioevo, intorno al 1650, quando apparve il primo processo biotecnico per la produzione dell'aceto.
La biotecnologia moderna si basa essenzialmente sulla microbiologia , emersa nella seconda metà del XIX secolo. Soprattutto, lo sviluppo di metodi di coltivazione , coltura pura e sterilizzazione da parte di Louis Pasteur gettò le basi per lo studio e l'applicazione ( microbiologia applicata ) dei microrganismi . Nel 1867 Pasteur riuscì a isolare i batteri dell'acido acetico e il lievito di birra utilizzando questi metodi . Intorno al 1890 lui e Robert Koch svilupparono le prime vaccinazioni basate su agenti patogeni isolati , gettando così le basi per la biotecnologia medica . Il giapponese Jōkichi Takamine fu il primo a isolare un unico enzima per uso tecnico, l'alfa-amilasi . Alcuni anni dopo, il chimico tedesco Otto Röhm utilizzò le proteasi animali (enzimi di degradazione delle proteine) provenienti dagli scarti della macellazione come detergenti e additivi per la produzione della pelle.
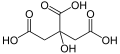
La produzione su larga scala di butanolo e acetone attraverso la fermentazione del batterio Clostridium acetobutylicum fu descritta e sviluppata nel 1916 dal chimico e poi presidente israeliano Charles Weizmann . È stato il primo sviluppo della biotecnologia bianca . Il processo fu utilizzato fino alla metà del XX secolo, ma fu poi sostituito dalla più economica sintesi petrolchimica dalla frazione propene del petrolio . A partire dal 1920, l'acido citrico fu prodotto dalla fermentazione superficiale del fungo Aspergillus niger . Nel 1957, l' amminoacido acido glutammico fu prodotto per la prima volta utilizzando il batterio del suolo Corynebacterium glutamicum. Nel 1928/29 Alexander Fleming scoprì la prima penicillina antibiotica per uso medico nel fungo Penicillium chrysogenum . Questo fu seguito nel 1943 dall'antibiotico streptomicina di Selman Waksman , Albert Schatz ed Elizabeth Bugie . Nel 1949 la produzione di steroidi fu implementata su scala industriale. All'inizio degli anni '60, le proteasi di derivazione biotecnologica furono aggiunte per la prima volta ai detersivi per rimuovere le macchie proteiche . Nella produzione del formaggio , dal 1965, il caglio di vitello può essere sostituito dalla rennina prodotta da microrganismi . Dal 1970 in poi è stato possibile produrre biotecnicamente amilasi e altri enzimi che scindono l'amido, con i quali ad es. B. L'amido di mais viene convertito nel cosiddetto “sciroppo di mais ad alto contenuto di fruttosio” e utilizzato come sostituto dello zucchero di canna ( saccarosio ), ad es. B. potrebbe essere utilizzato nella produzione di bevande.
-
Pane
-
Vino
-
Birra
-
Formaggio
-
Yogurt
-
Aceto
-
Acido citrico
-
Penicillina
-
Amilasi
Le biotecnologie rosse
[modifica | modifica sorgente]In medicina, le moderne biotecnologie hanno molte applicazioni in vari settori quali:
- la scoperta e la produzione di farmaci
- la produzione di vaccini efficaci e a basso rischio
- la terapia genica
- la terapia con cellule staminali
- l'editing genetico con CISPR/Cas9 a scopi terapeutici
- la farmacogenomica
- i test genetici (o screening genetici ). Nel 2021, quasi il 40% del valore aziendale totale delle aziende biotecnologiche farmaceutiche in tutto il mondo era attivo in oncologia , con neurologia e malattie rare come altre due grandi applicazioni.
La scoperta e produzione di farmaci
[modifica | modifica sorgente]La biotecnologia ha contribuito alla scoperta e alla produzione di farmaci tradizionali a piccole molecole , nonché di farmaci che sono il prodotto della biotecnologia, la biofarmaceutica . La moderna biotecnologia può essere utilizzata per produrre medicinali esistenti in modo relativamente semplice ed economico. I primi prodotti geneticamente modificati sono stati medicinali progettati per curare malattie umane. Per citare un esempio, nel 1978 Genentech ha sviluppato l'insulina sintetica umana unendo il suo gene con un vettore plasmidico inserito nel batterio Escherichia coli. L'insulina, ampiamente utilizzata per il trattamento del diabete, era precedentemente estratta dal pancreas di animali da macello (bovini o maiali).
La biotecnologia utilizzata è quella del DNA ricombinante, ovverosia si usano principalmente batteri geneticamente modificati in grado di produrre grandi quantità di proteine sintetiche a costi relativamente bassi. Molti farmaci vengono prodotti con la tecnologia del DNA ricombinante, ad esempio:
- ormoni di natura proteica come l'ormone della crescita (GH), l'eritropoietina (Epo) e l'insulina.
- fattori di coagulazione del sangue (fattore VIII e fattore IX)
- anticorpi monoclonali. Sono simili agli anticorpi che il sistema immunitario umano usa per combattere batteri e virus, ma sono "progettati su misura" (usando la tecnologia degli ibridomi o altri metodi) e possono quindi essere realizzati specificamente per contrastare o bloccare qualsiasi sostanza nel corpo, o per colpire qualsiasi tipo di cellula specifica;
- proteine di fusione: le proteine di fusione o proteine chimeriche sono proteine formate a partire dalla traduzione di due o più geni originariamente indipendenti e successivamente fusi insieme, a causa di un processo naturale o di opportune modificazioni in laboratorio. Ciascuno di questi geni avrebbe dato origine a una proteina indipendente, se non fosse stato associato all'altro o agli altri geni. Un esempio di proteina di fusione ottenuta in laboratorio è l'abatacept: si tratta di un farmaco utilizzato nella terapia dell'artrite reumatoide ed è costituito da un'immunoglobulina fusa insieme all'antigene citotossico della popolazione CTLA-4 dei linfociti T.
La produzione di vaccini
[modifica | modifica sorgente]Il vaccino è un preparato biologico prodotto allo scopo di conferire l'immunità acquisita attiva contro un particolare tipo di infezione ai soggetti a cui è somministrato.
I vaccini possono essere prodotti in vario modo. Esistono vaccini che contengono:
- organismi vivi attenuati, come i vaccini contro la poliomielite di Sabin (OPV), febbre gialla, morbillo, parotite, rosolia, varicella, rotavirus e vaiolo. I vaccini di questo tipo sono composti da organismi intatti, resi non patogenici trattandoli per attenuarne la capacità di causare la malattia oppure uccidendoli senza perderne l'immunogenicità. In generale, il maggior difetto dei vaccini attenuati è che possono regredire nella forma virulenta, cosa che non accade nei vaccini inattivati. Nonostante i ceppi selezionati abbiano una bassa patogenicità, la grande capacità di mutare dei virus può portare in rari casi ad un loro riacquisto di azione patogena. L'unico caso effettivamente documentato a riguardo è quello del vaccino attenuato antipolio (vaccino orale di Sabin)
- organismi inattivati o uccisi, come i vaccini contro la poliomielite di Salk (IPV), rabbia, influenza, pertosse, colera, epatite A, febbre tifoide e peste. I vaccini inattivati si ottengono trattando i patogeni in modo da rendere impossibile loro di replicarsi. Per ottenere l'obiettivo prefissato in linea teorica basta trattare il composto con del calore, il quale però causa la denaturazione delle proteine (e conseguentemente la loro inattivazione a fini immunogenici); in genere si preferisce quindi un'inattivazione chimica con formaldeide o altre sostanze. A differenza dei vaccini attenuati, richiedono ripetuti richiami per mantenere lo stato di immunità nell'organismo e sono molto più sicuri dal momento che non mantengono la capacità di replicarsi e di regredire alla forma nativa.
- antigeni purificati (o vaccini a subunità), come i vaccini (costituiti da anatossine) contro il tetano o la difterite. I vaccini a subunità sono composti da antigeni purificati, cioè antigeni o pezzi di essi ricavati da un microrganismo o dalle sue tossine. Molti organismi, come ad esempio il tetano e la difterite, esprimono la loro virulenza tramite delle esotossine.
- antigeni ricombinanti e peptidi sintetici, come il vaccino contro l'epatite B. I peptidi sintetici e gli antigeni ricombinanti sono di interesse recente e prevedono la produzione degli antigeni voluti per formare il vaccino usando varie tecnologie, tra cui il DNA ricombinante.
- DNA o RNA, come diversi vaccini contro il SARS-CoV2. Queste due tecniche si basano sulla possibilità di far produrre alle cellule dell'organismo da immunizzare gli antigeni che devono scatenare la risposta immunitaria. Questo può avvenire in due modi: infettando le cellule con un virus non citopatico (cioè che non le uccide) oppure inoculando un plasmide contenente un cDNA: in entrambi i casi si introduce un acido nucleico codificante per l'antigene. Questi approcci hanno il vantaggio di essere gli unici capaci di generare una risposta dei linfociti citotossici. Un vaccino a RNA agisce mediante l'ingresso di frammenti di mRNA nelle cellule del soggetto vaccinato, inducendole a produrre antigeni dei microrganismi patogeni (ad esempio spike virali) o antigeni tumorali al fine di indurre una risposta immunitaria adattativa contro tali bersagli
- vaccini coniugati, che consentono una maggiore risposta immunitaria e vengono spesso utilizzati nei vaccini contenenti antigeni polisaccaridici (più difficili da riconoscere per i linfociti) quali quelli contro meningococchi, pneumococchi ed Haemophilus influenzae di tipo B. Si tratta di raggruppamenti di vaccini diversi, ottenuti da microrganismi attenuati
- Vaccini ottenuti da piante OGM. L'idea di produrre vaccini tramite piante transgeniche è stata identificata già nel 2003. Piante come il tabacco, la patata, il pomodoro e la banana possono avere geni inseriti che le inducono a produrre vaccini utilizzabili per gli esseri umani. Ad es. nel 2005, sono state sviluppate banane che producono un vaccino umano contro l' epatite B. Il vaccino può essere estratto e purificato dalla pianta, oppure somministrato direttamente col consumo della pianta stessa. Rappresenta un modo economico per produrre, conservare e somministrare un vaccino. Ad oggi, nelle piante si sono ottenuti con notevole successo un farmaco per il morbo di Gaucher, un anticorpo monoclonale contro Ebola, vaccini contro l’influenza aviaria e quella stagionale, epatite B e papilloma.
-
Questo manifesto del 1963 mostra il simbolo nazionale CDC di salute pubblica, la "Wellbee", incoraggiando il pubblico a ricevere un vaccino orale antipolio
-
Somministrazione del vaccino antipolio Sabin
-
Somministrazione della vaccinazione antipolio di tipo Salk, nel 1957
-
Preparazione di virus attenuati coltivati in uova di gallina. Alcuni tipi di vaccini antinfluenzali sono esempi di vaccini preparati con tale metodo.
-
Esotossina della difterite
-
Vaccino per la difterite del 1925
-
Il tetano si presenta come una paralisi spastica in tutto il corpo
-
Virus dell'epatite B
-
Come funziona un vaccino a RNA
-
infografica sul vaccino a MRNA
-
Come funziona il vaccino a mRNA
-
Vaccino Moderna a RNA
La terapia genica
[modifica | modifica sorgente]
Con terapia genica si intende la modifica del materiale genetico (DNA) all'interno delle cellule al fine di poter curare delle patologie (es. malattie genetiche). La terapia genica si propone di curare una patologia causata dall'assenza o dal difetto di uno o più geni (mutati) con la sostituzione con una variante "sana". Dunque, è necessario in primo luogo identificare il singolo gene o i diversi geni responsabili della malattia genetica. Sebbene le terapie siano generalmente sperimentali, si può tentare in secondo luogo - almeno per alcune malattie - la sostituzione dei geni malati sfruttando, ad esempio, come vettore un virus reso inattivo, svuotato preventivamente del suo corredo genetico. Con un meccanismo piuttosto complesso, che richiede l'uso di 'forbici' molecolari enzimatiche, enzimi di restrizione (con cui si preleva il gene "sano") si può poi 'correggere' il DNA, rimpiazzando le sequenze difettose, in modo tale che la cellula sintetizzi correttamente le proteine necessarie al corretto funzionamento metabolico.
Esistono due tipologie di terapia genica: quella delle cellule germinali e quella delle cellule somatiche. La prima si propone di trasfettare le cellule della linea germinale come spermatozoi ed ovociti o le cellule staminali totipotenti dei primissimi stadi dello sviluppo dell'embrione (alla fase di 4-8 cellule), ma attualmente essa non viene messa in pratica sia per ragioni tecniche e, soprattutto, per i grandissimi dilemmi etici che solleva. La seconda tipologia, invece, si propone di modificare solamente le cellule somatiche, senza intaccare, quindi, la linea germinale; oggigiorno è la via più studiata e tentata. La terapia genica delle cellule somatiche, a sua volta, viene suddivisa in due gruppi: la terapia genica ex vivo e quella in vivo. Di recente interesse è la possibilità dell'editing genico terapeutico con CRISPR/Cas9.
La terapia genica ex vivo
[modifica | modifica sorgente]È la tipologia che venne messa in pratica per prima e consiste nel prelievo delle cellule somatiche della persona interessata. Esse, successivamente, vengono messe in coltura in laboratorio. Durante questo tempo vengono anche trasdotte con il gene d'interesse, inserito tramite un apposito vettore (spesso vengono usati vettori virali), e successivamente vengono reinfuse o reimpiantate nel corpo del soggetto. Tale procedura è sicuramente la più lunga e la più costosa delle due ma permette di selezionare ed amplificare le cellule d'interesse ed inoltre gode d'una maggior efficienza. È attualmente la modalità più utilizzata ma è riservata solamente a quei casi in cui sia possibile prelevare, mettere le cellule in cultura e reinserirle nell'organismo.
La terapia genica in vivo
[modifica | modifica sorgente]Viene attuata in tutti quei casi in cui le cellule non possono essere messe in coltura, o prelevate e reimpiantate, come quelle del cervello o del cuore e della maggior parte degli organi interni; inoltre, rappresenta un modello terapeutico con elevata ottemperanza e molto economico ma, attualmente, di più difficile applicazione. In questo caso il gene, o l'oligonucleotide d'interesse viene inserito nell'organismo, tramite un opportuno vettore, direttamente per via locale o sistemica.
L'editing genetico
[modifica | modifica sorgente]L'introduzione dell'editing genetico CRISPR ha aperto nuove porte alla sua applicazione e utilizzo nella terapia genica, poiché invece della semplice sostituzione di un gene, consente la correzione del particolare difetto genetico. Soluzioni agli ostacoli medici, come l'eradicazione dei serbatoi latenti del virus dell'immunodeficienza umana ( HIV ) e la correzione della mutazione che causa l'anemia falciforme, potrebbero essere disponibili come opzione terapeutica in futuro. In vivo, i sistemi di editing genetico che utilizzano CRISPR sono stati utilizzati in studi sui topi per trattare il cancro e sono stati efficaci nel ridurre i tumori.
Applicazioni
[modifica | modifica sorgente]Nel 1990 William French Anderson realizzò con successo la prima terapia genica applicata a un essere umano, una bambina affetta da ADA-SCID. Da allora sono molteplici le applicazioni, anche se molto costose, ad esempio:
- Malattie ereditarie come:
- Terapia della SCID (costo ~ 600.000 €)
- Deficit di Ornitina-Transcarbamilasi
- Atrofia muscolare spinale (~ 2.000.000 €)
- β -talassemia (~ 1.600.000 €)
- Carenza di lipoproteina lipasi
- Adrenoleucodistrofia cerebrale
- Carenza di L-aminoacido decarbossilasi aromatica (AADC)
- Emofilia
- Amaurosi congenita di Leber (~ 720.000 €)
- Neuropatia ottica ereditaria di Leber (LHON)
- Terapie del cancro
- Leucemia linfocitica acuta
- Linfoma diffuso a grandi cellule B
- Melanoma maligno (~ 50.000 €)
- Linfoma a cellule mantellari
- Mieloma multiplo
- Terapia dell'infezione da HIV-1 (in fase di sperimentazione)
-
Schema della terapia genica ex vivo
-
Schema della terapia genica In vivo
-
Globuli rossi anomali per la beta talassemia
-
Albero genealogico della discendenza della Regina Vittoria, con indicati i casi accertati di omozigosi ed eterozigosi per l'emofilia
-
Una donna affetta da emofilia, con incapacità di formare coaguli di sangue
-
Sviluppo di un melanoma maligno
-
Il virus dell'HIV
La terapia con cellule staminali
[modifica | modifica sorgente]Le cellule staminali possono essere distinte in base al loro potenziale di differenziazione:
- cellule staminali totipotenti: capaci di dare origine a qualsiasi tipo di cellula, e quindi a un intero organismo;
- cellule staminali pluripotenti: capaci di produrre tutti i tipi cellulari tranne le appendici embrionali ;
- cellule staminali multipotenti: capaci di dare origine a diversi tipi di cellule ma non appartenenti a tutti gli strati (ad esempio, le cellule della cresta neurale danno origine a cellule ectodermiche e mesodermiche ma non endodermiche )
- cellule staminali unipotenti: che possono produrre un solo tipo di cellula (possono però, come ogni cellula staminale, autorinnovarsi, da qui l'importanza di distinguerle dai precursori). Ad esempio, possiamo citare le cellule satelliti dei muscoli striati scheletrici.

La terapia con cellule staminali è l'uso di cellule staminali per trattare o prevenire una malattia o una condizione. Il trapianto di midollo osseo è una forma di terapia con cellule staminali che è stata utilizzata per molti anni perché ha dimostrato di essere efficace negli studi clinici. L'impianto di cellule staminali può aiutare a rafforzare il ventricolo sinistro del cuore, nonché a trattenere il tessuto cardiaco nei pazienti che hanno sofferto di infarti in passato.
Per oltre 90 anni, il trapianto di cellule staminali emopoietiche (HSCT) è stato utilizzato per curare persone con condizioni come la leucemia e il linfoma; questa è l'unica forma di terapia con cellule staminali ampiamente praticata. A partire dal 2016 , l'unica terapia consolidata che utilizza le cellule staminali è il trapianto di cellule staminali emopoietiche. Questo di solito assume la forma di un trapianto di midollo osseo, ma le cellule possono anche essere derivate dal sangue del cordone ombelicale. Sono in corso ricerche per sviluppare varie fonti di cellule staminali e per applicare trattamenti con cellule staminali per malattie neurodegenerative e condizioni come il diabete e le malattie cardiache.
Una cellula staminale pluripotente indotta (conosciuta anche come iPS o iPSC dall'inglese Induced Pluripotent Stem Cell) è un tipo di cellula staminale generata artificialmente a partire da una terminalmente differenziata (in genere una cellula somatica adulta), mediante l'introduzione di quattro geni specifici codificanti determinati fattori di trascrizione che ne inducono la conversione in cellula staminale di una specifica linea cellulare, che a sua volta potrà svilupparsi in cellula differenziata. Sulla base di tali proprietà, le iPSC offrono grandi speranze nel campo della medicina rigenerativa: la possibilità di indurne la differenziazione nella maggior parte dei tipi cellulari di un organismo (come ad esempio cellule neuronali, pancreatiche, cardiache ed epatiche), può essere sfruttata nella rigenerazione di tessuti o organi danneggiati.
Le cellule staminali pluripotenti meglio caratterizzate sono quelle embrionali ma il loro utilizzo comporta problemi etici associati alla manipolazione e/o alla distruzione dell'embrione nella fase di preimpianto. Tali problemi possono essere evitati utilizzando cellule staminali derivate da quelle adulte indotte alla pluripotenza. Ciò permette la loro applicazione in trapianti autologhi, che riducono il rischio di rigetto, anche se tale tecnologia non è ritenuta del tutto sicura. Le iPSC vengono anche utilizzate per lo sviluppo di cure personalizzate sulla base della loro risposta a trattamenti farmacologici.
-
Malattie e condizioni in cui il trattamento con cellule staminali è promettente o emergente
-
Tipi di cellule staminali
-
Rappresentazione schematica della conversione delle cellule somatiche in cellule pluripotenti e differenziazione delle iPSC in un'ampia gamma di singole cellule
L'editing genetico con CRISPR/Cas9
[modifica | modifica sorgente]La tecnica CRISPR è una tecnica di editing genomico. Non è l'unica, in passato sono state messe a punto altre tecniche meno efficaci come la ZFN e la TALEN. L'acronimo CRISPR sta per "Clustered Regularly Interspaced Short Palindromic Repeats" e identifica una tecnica di ingegneria genetica usata in biologia molecolare. Si basa su una versione semplificata di un sistema di difesa contro i virsus che si trova nei batteri (CRISPR-Cas9). Fornendo la nucleasi Cas9 complessata con un RNA guida sintetico (gRNA) in una cellula, il genoma della cellula può essere tagliato nella posizione desiderata, consentendo la rimozione dei geni esistenti e/o l'aggiunta di nuovi in vivo.
La tecnica è considerata molto significativa nel campo della biotecnologia e della medicina poiché consente di modificare i genomi in vivo in modo molto preciso, economico e semplice. Può essere utilizzato nella creazione di nuovi medicinali, prodotti agricoli e organismi geneticamente modificati o come mezzo per controllare agenti patogeni e parassiti. Ha anche possibilità di uso nel trattamento delle malattie genetiche ereditarie e delle malattie derivanti da mutazioni somatiche come il cancro. Sebbene ampiamente accettata in ambito agrario e biotecnologico, il suo utilizzo nella modificazione genetica della linea germinale umana è ad oggi molto controverso.

Il sistema CRISPR/Cas può essere utilizzato, tra l'altro, per l'editing del genoma (delezioni/ eliminazioni di geni e inserimenti) e quindi anche per la terapia genica. Tuttavia, ciò che potrebbe essere problematico per le applicazioni umane è che il sistema immunitario riconosce l’endonucleasi Cas9, che è di origine batterica, come antigene.
Possibili applicazioni dell'editing genomico sono:
- la rimozione dei genomi di agenti patogeni di malattie infettive croniche come il virus dell'epatite B e l'HIV
- correggere le mutazioni nella generazione di cellule staminali pluripotenti indotte e di cellule staminali embrionali
- trattamento delle malattie genetiche ereditarie
- trattamento dei tumori
La farmacogenomica
[modifica | modifica sorgente]La farmacogenomica (una combinazione di farmacologia e genomica ) è la tecnologia che analizza come il patrimonio genetico influenza la risposta di un individuo ai farmaci. I ricercatori nel campo studiano l'influenza della variazione genetica sulle risposte ai farmaci nei pazienti correlando l'espressione genica o i polimorfismi a singolo nucleotide con l'efficacia o la tossicità di un farmaco . Lo scopo della farmacogenomica è quello di sviluppare farmaci che, rispetto al genotipo dei pazienti, garantiscono la massima efficacia con effetti avversi minimi. Tali approcci promettono l'avvento della "medicina personalizzata"; in cui i farmaci e le combinazioni di farmaci sono ottimizzati per il patrimonio genetico unico di ogni individuo.
I test genetici
[modifica | modifica sorgente]
I test genetici consentono la diagnosi genetica delle vulnerabilità alle malattie ereditarie e possono anche essere utilizzati per determinare la parentela di un bambino (madre e padre genetici) o in generale l'ascendenza di una persona . Oltre a studiare i cromosomi a livello di singoli geni, i test genetici in senso più ampio includono test biochimici per la possibile presenza di malattie genetiche o forme mutanti di geni associate a un rischio aumentato di sviluppare disturbi genetici. I test genetici identificano cambiamenti nei cromosomi , nei geni o nelle proteine. Nella maggior parte dei casi, i test vengono utilizzati per trovare cambiamenti associati a disturbi ereditari. I risultati di un test genetico possono confermare o escludere una sospetta condizione genetica o aiutare a determinare la possibilità di una persona di sviluppare o trasmettere un disturbo genetico . Nel 2011 erano in uso diverse centinaia di test genetici. Poiché i test genetici possono aprire problemi etici o psicologici, i test genetici sono spesso accompagnati da consulenza genetica.
Le biotecnologie verdi
[modifica | modifica sorgente]Biotecnologie verdi con transgenesi (con geni estranei all'organismo GM)
[modifica | modifica sorgente]Le colture geneticamente modificate ("colture GM" o "colture biotech") sono piante utilizzate in agricoltura , il cui DNA è stato modificato con tecniche di ingegneria genetica . Nella maggior parte dei casi, l'obiettivo principale è introdurre una nuova caratteristica che non si verifica naturalmente nella specie. Le aziende biotecnologiche possono contribuire alla futura sicurezza alimentare migliorando la nutrizione e la vitalità dell'agricoltura urbana. Inoltre, la protezione dei diritti di proprietà intellettuale incoraggia gli investimenti del settore privato nell'agrobiotecnologia.
Esempi nelle colture alimentari includono la resistenza a certi parassiti, malattie, condizioni ambientali stressanti, resistenza ai trattamenti chimici (ad esempio resistenza a un erbicida ), riduzione del deterioramento, o miglioramento del profilo nutrizionale della coltura. Esempi nelle colture non alimentari includono la produzione di agenti farmaceutici , biocarburanti , e altri beni utili all'industria, così come per la biorisanamento .
Gli agricoltori hanno ampiamente adottato la tecnologia GM. Tra il 1996 e il 2011, la superficie totale di terra coltivata con colture GM è aumentata di un fattore 94, da 17.000 a 1.600.000 chilometri quadrati (da 4.200.000 a 395.400.000 acri). Nel 2010, il 10% delle terre coltivate del mondo è stato piantato con colture GM. Nel 2011, 11 diverse colture transgeniche sono state coltivate commercialmente su 395 milioni di acri (160 milioni di ettari) in 29 paesi come Stati Uniti, Brasile , Argentina , India , Canada, Cina, Paraguay, Pakistan, Sud Africa, Uruguay, Bolivia, Australia, Filippine, Myanmar, Burkina Faso, Messico e Spagna.

Gli alimenti geneticamente modificati sono alimenti prodotti da organismi che hanno subito modifiche specifiche nel loro DNA con metodi di ingegneria genetica . Queste tecniche hanno consentito l'introduzione di nuove caratteristiche delle colture e un controllo molto maggiore sulla struttura genetica di un alimento rispetto a quanto precedentemente consentito da metodi quali l'allevamento selettivo e l'allevamento per mutazione . La vendita commerciale di alimenti geneticamente modificati è iniziata nel 1994, quando la Calgene ha commercializzato per la prima volta il suo pomodoro a maturazione ritardata Flavr Savr . Ad oggi la maggior parte delle modifiche genetiche degli alimenti si è concentrata principalmente su colture commerciali molto richieste dagli agricoltori come soia , mais , canola (una varietà di colza) e olio di semi di cotone . Questi sono stati progettati per resistere a patogeni ed erbicidi e per profili nutrizionali migliori. Anche il bestiame GM è stato sviluppato sperimentalmente; nel novembre 2013 nessuno era disponibile sul mercato, ma nel 2015 la FDA ha approvato il primo salmone GM per la produzione e il consumo commerciale.
Il mais Bt: si tratta di una modifica genetica che permette alla pianta di difendersi dagli attacchi degli insetti, dovuta a un gene inserito nel suo DNA, che gli permette di produrre una proteina che danneggia gli insetti che cercano di nutrirsene. Il gene inserito, tratto dal Bacillus thuringiensis, produce la Delta-endotossina (o tossina Bt), sostanza innocua per l'uomo ma velenosa per gli insetti dell'ordine dei Lepidotteri, tra cui la Piralide del mais europea. Per queste ragioni, le piante geneticamente modificate con la delta-endotossina vengono coltivate su larga scala in tutto il mondo.

Si dicono Roundup ready (trad. pronto per il Roundup, abbreviato RR) quelle colture geneticamente modificate al fine di tollerare erbicidi a base di glifosato. Si tratta di un marchio registrato dalla multinazionale Monsanto il cui nome (Roundup) deriva da quello commerciale del principio attivo distribuito dalla stessa Monsanto; la prima coltura RR è stata la soia, seguita da altre come cotone, mais, colza. I vantaggi delle colture Roundup ready consistono essenzialmente in un controllo delle piante infestanti assai semplificato, che non sarebbe possibile in colture tradizionali, basato solo sul diserbo chimico con glifosato anche in "copertura" (cioè in presenza della vegetazione della coltura, che per l'appunto è resa tollerante all'erbicida grazie all'inserimento di un transgene). La soia Roundup Ready è in assoluto il prodotto transgenico maggiormente coltivato nel mondo, rappresentando l'87% della soia coltivata negli Stati Uniti, e il 60% a livello globale (nel 2005). Recentemente è stata sviluppata la seconda generazione di soia Roundup Ready, che associa al gene per la resistenza agli erbicidi una produttività del 4-7% superiore alle altre varietà. Tuttavia il principio base secondo molti studiosi sarebbe pericoloso per l'uomo e per gli animali che si nutrono di mangimi a base di soia e altri mangimi trattati con il Glifosato in relazione alla possibilità che quest'ultimo residui nei prodotti alimentari. La reale pericolosità del Glifosato è oggetto di accesi dibattiti.

Il Golden Rice o Riso dorato è una varietà di riso prodotta attraverso una modifica genetica che introduce la via di biosintesi del precursore beta-carotene della provitamina nelle parti commestibili del riso. In particolare sono stati introdotti i geni psy (fitoene sintasi) del Narciso e del Mais e il gene crtI (carotene desaturasi) di un batterio del suolo, Erwinia uredovora. La pro-vitamina A, che il metabolismo umano trasforma in vitamina A, è presente naturalmente in molti alimenti come le carote, il fegato, le uova e il burro, che risultano tuttavia inaccessibili a molti milioni di famiglie che si nutrono quasi esclusivamente di riso. Allo scopo di introdurre vitamina A nella dieta di queste popolazioni, è stata creata una pianta di riso ricca in beta-carotene. Secondo l'Organizzazione mondiale della sanità (OMS) oltre 100 milioni di bambini poveri nel mondo hanno una dieta carente di vitamina A e, per questa ragione, migliaia di bambini diventano ciechi ogni anno. Al fine di evitare patologie oculari, sarebbe sufficiente che queste popolazioni assumessero un quantitativo maggiore di vitamina. Il progetto è andato più lento del previsto e solo nel 2008 sono stati seminati i primi campi di Golden Rice nelle Filippine. I ritardi non sono dovuti soltanto a opposizione di molte organizzazioni anti-biotech responsabili della distruzione di diversi campi sperimentali ma anche per problemi legali in quanto la distribuzione, anche gratuita, del Golden Rice avrebbe causato una violazione dei diritti intellettuali di almeno una settantina di brevetti detenuti da multinazionali e università. Attualmente il Golden rice viene prodotto e distribuito unicamente in Bangladesh a causa dei rallentamenti provocati dallo scetticismo da parte della popolazione nei confronti dei possibili benefici dell’ingegneria genetica.
Esiste un consenso scientifico sul fatto che gli alimenti attualmente disponibili derivati da colture geneticamente modificate non presentano rischi maggiori per la salute umana rispetto agli alimenti convenzionali, ma che ogni alimento geneticamente modificato deve essere testato caso per caso prima di essere introdotto. Tuttavia, i membri del pubblico sono molto meno propensi degli scienziati a percepire gli alimenti geneticamente modificati come sicuri. Lo status legale e normativo degli alimenti geneticamente modificati varia a seconda del paese, con alcune nazioni che li vietano o li limitano, e altre che li consentono con gradi di regolamentazione molto diversi.
Le colture geneticamente modificate offrono anche una serie di benefici ecologici, se non utilizzate in eccesso. Le colture resistenti agli insetti hanno dimostrato di ridurre l’uso di pesticidi, riducendo quindi l’impatto ambientale dei pesticidi nel loro complesso. Tuttavia, gli oppositori hanno sollevato obiezioni alle colture geneticamente modificate in sé per diversi motivi, tra cui preoccupazioni ambientali, se il cibo prodotto da colture geneticamente modificate sia sicuro, se le colture geneticamente modificate siano necessarie per soddisfare le esigenze alimentari mondiali e preoccupazioni economiche sollevate dal fatto che questi organismi sono soggetti alla legge sulla proprietà intellettuale.
La biotecnologia ha diverse applicazioni nel campo della sicurezza alimentare. Colture come il riso dorato sono progettate per avere un contenuto nutrizionale più elevato e c'è il potenziale per prodotti alimentari con una durata di conservazione più lunga. Sebbene non siano una forma di biotecnologia agricola, i vaccini possono aiutare a prevenire le malattie riscontrate nell'agricoltura animale. Inoltre, la biotecnologia agricola può accelerare i processi di allevamento per ottenere risultati più rapidi e fornire maggiori quantità di cibo. La biofortificazione transgenica nei cereali è stata considerata un metodo promettente per combattere la malnutrizione in India e in altri paesi.
-
Cristalli di tossina da Bacillus thuringiensis
-
Bruco della piralide del mais
-
Adulto della piralide del mais
-
Il marchio Roundup della Monsanto
-
Glifosato
-
Coltivazione di mais trattata con glifosato
-
Narciso
-
Uso del glifosato negli Stati Uniti
Biotecnologie verdi con cisgenesi (con geni della stessa specie)
[modifica | modifica sorgente]
Cisgenesi (etimologia: cis = stesso lato; e genesi = origine) è un termine per organismi che sono stati progettati utilizzando un processo in cui i geni vengono trasferiti artificialmente tra organismi che altrimenti potrebbero essere allevati in modo convenzionale. I geni vengono trasferiti solo tra organismi strettamente correlati. Le sequenze di acidi nucleici devono essere isolate e introdotte utilizzando le stesse tecnologie utilizzate per produrre organismi transgenici, rendendo la cisgenesi simile per natura alla transgenesi.
La cisgenesi è stata applicata al trasferimento di geni di resistenza naturale alla devastante malattia Phytophthora infestans nella patata e alla ticchiolatura ( Venturia inaequalis ) nella mela.
Alcune persone credono che la cisgenesi non debba affrontare la stessa supervisione normativa della modifica genetica creata tramite transgenesi, poiché è possibile, se non pratico, trasferire alleli tra specie strettamente correlate anche tramite incrocio tradizionale. In Europa , attualmente, questo processo è regolato dalle stesse leggi della transgenesi. Mentre i ricercatori dell'Università di Wageningen nei Paesi Bassi ritengono che questo dovrebbe essere cambiato.
Biotecnologie verdi con editing genomico
[modifica | modifica sorgente]L'editing del genoma fornisce una nuova strategia per la manipolazione genetica nelle piante e probabilmente aiuterà nell'ingegneria dei tratti vegetali desiderati modificando i geni endogeni.
Un esempio potenzialmente riuscito dell'applicazione delle tecniche di editing del genoma nel miglioramento delle colture può essere trovato nella banana, dove gli scienziati hanno utilizzato l'editing CRISPR/Cas9 per inattivare il virus endogeno della striatura della banana nel genoma B della banana ( Musa spp. ) per superare una sfida importante nell'allevamento delle banane.
Altre biotecnologie
[modifica | modifica sorgente]La biotecnologia industriale
[modifica | modifica sorgente]La biotecnologia industriale (conosciuta principalmente in Europa come biotecnologia bianca) è l'applicazione della biotecnologia a scopi industriali, inclusa la fermentazione industriale . Include la pratica di utilizzare cellule come microrganismi , o componenti di cellule come enzimi , per generare prodotti utili a livello industriale in settori quali prodotti chimici, alimenti e mangimi, detersivi, carta e cellulosa, tessili e biocarburanti . Negli ultimi decenni, sono stati compiuti progressi significativi nella creazione di organismi geneticamente modificati (OGM) che migliorano la diversità delle applicazioni e la redditività economica della biotecnologia industriale. Utilizzando materie prime rinnovabili per produrre una varietà di prodotti chimici e combustibili, la biotecnologia industriale sta attivamente avanzando verso la riduzione delle emissioni di gas serra e l'allontanamento da un'economia basata sulla petrolchimica.
La biologia sintetica è considerata uno dei cardini essenziali della biotecnologia industriale per il suo contributo finanziario e sostenibile al settore manifatturiero. Insieme, la biotecnologia e la biologia sintetica svolgono un ruolo cruciale nella generazione di prodotti convenienti con caratteristiche rispettose della natura, utilizzando la produzione basata su biotecnologie anziché quella basata sui fossili. La biologia sintetica può essere utilizzata per progettare microrganismi modello , come l'Escherichia coli , mediante strumenti di editing del genoma per migliorare la loro capacità di produrre prodotti basati su biotecnologie, come la bioproduzione di medicinali e biocarburanti . Ad esempio, l'E. coli e il Saccharomyces cerevisiae in un consorzio potrebbero essere utilizzati come microbi industriali per produrre precursori dell'agente chemioterapico paclitaxel (taxolo) applicando l' ingegneria metabolica in un approccio di co-coltura per sfruttare i benefici dei due microbi.
Un altro esempio di applicazioni della biologia sintetica nella biotecnologia industriale è la riprogettazione dei percorsi metabolici di E. coli mediante sistemi CRISPR e CRISPRi verso la produzione di una sostanza chimica nota come 1,4-butandiolo , che viene utilizzata nella produzione di fibre. Per produrre 1,4-butandiolo, gli autori alterano la regolazione metabolica di Escherichia coli mediante CRISPR per indurre una mutazione puntiforme nel gene glt A, il knockout del gene sad e il knock-in di sei geni ( cat 1, suc D, 4hbd , cat 2, bld e bdh ). Mentre il sistema CRISPRi era utilizzato per abbattere i tre geni concorrenti ( gab D, ybg C e tes B) che influenzano il percorso di biosintesi di 1,4-butandiolo. Di conseguenza, la resa di 1,4-butandiolo è aumentata significativamente da 0,9 a 1,8 g/L.
-
Taxolo (farmaco chemioterapico)
-
1,4-butandiolo
-
L'elastane (Lycra) è prodotto col butandiolo
La produzione di biocarburanti
[modifica | modifica sorgente]Il biocarburante è un carburante ricavato da materiale biologico. È diverso dai combustibili fossili ricavati da materiale biologico fossilizzato. Il biocarburante può essere in forma solida , liquida o gassosa
Esistono due modi comuni per convertire le piante in combustibili gassosi e liquidi. Uno è coltivare colture ad alto contenuto di zucchero (ad esempio canna da zucchero ) o amido (ad esempio mais ), e quindi utilizzare il lievito per fermentare alcol etilico ( etanolo ). Il secondo è coltivare piante che contengono elevate quantità di olio vegetale , come olio di palma , soia e alghe . Quando questi oli vengono riscaldati, la loro viscosità si riduce e possono essere bruciati direttamente in un motore diesel o trattati chimicamente per produrre combustibili come il biodiesel . Per migliaia di anni, il legno e i suoi sottoprodotti sono stati convertiti in biocarburanti come carbone di legna, gas di legna, metanolo o combustibile di etanolo.
I biocarburanti di prima generazione (chiamati anche "biocarburanti convenzionali") sono ricavati da colture alimentari coltivate su terreni arabili. Il contenuto di zucchero, amido o olio della coltura viene convertito in biodiesel o etanolo , mediante transesterificazione o fermentazione del lievito. La produzione di questi carburanti però sottraggono terreni agricoli utili per l'alimentazione umana e questo può creare dei problemi.
I biocarburanti di seconda generazione risolvono il problema del " cibo contro carburante ", (chiamati anche biocarburanti avanzati o biocarburanti sostenibili o biocarburanti drop-in) sono realizzati da materie prime che non competono direttamente con le colture alimentari o foraggere, come i prodotti di scarto e le colture energetiche. Un'ampia gamma di materie prime di scarto, come quelle derivate da attività agricole e forestali come paglia di riso, lolla di riso, trucioli di legno e segatura, può essere utilizzata per produrre biocarburanti avanzati attraverso processi biochimici e termochimici.

Le biotecnologie aiutano la produzione di biocarburanti di seconda generazione creando microorganismi (batteri e lieviti) che riescono ad avere una elevata resa dalla fermentazione della cellulosa di scarto.
Il biodiesel è un tipo di carburante preparato elaborando olio vegetale , grasso animale, particolari tipi di alghe e forse anche liquami . È considerato un tipo di energia rinnovabile , poiché proviene tutto da piante e animali viventi. Può essere utilizzato per alimentare un motore, solitamente per veicoli , compresi gli aerei . Sostituisce il diesel che deriva dal petrolio, un tipo di combustibile fossile. La maggior parte del biodiesel è ricavata da semi oleosi . I semi oleosi sono qualsiasi tipo di seme che contenga abbastanza olio da essere utile per produrre olio vegetale. Un giorno le alghe potrebbero essere utilizzate per produrre più biodiesel di quanto non se ne produca oggi con l'olio vegetale. Le alghe possono essere coltivate in luoghi in cui non si può coltivare cibo, quindi non sottrarrebbero cibo alle persone. Ma al momento è ancora troppo costoso, ma gli scienziati stanno cercando modi per migliorare il processo

Il bioetanolo di seconda generazione viene ottenuto idrolizzando grandi quantità di cellulosa che tramite l'uso di funghi o batteri trasformano la cellulosa in glucosio e altri zuccheri, poi avviene la fermentazione mediante lieviti o altri microbi. Ricerche innovative mirano a modificare geneticamente sia i batteri che i lieviti come Saccharomyces cerevisiae modificato in modo da produrre il doppio di etanolo. Altro filone di ricerca è quello di combinare le caratteristiche di scindere la cellulosa in glucosio con quella di trasformare gli zuccheri in etanolo mediante un unico organismo. Il bioetanolo da cellulosa è molto più costoso di quello ottenuto dalla canna da zucchero e solo importanti progressi scientifici possono renderlo conveniente. Si noti che il costo non è dovuto alla materia prima (cellulosa) ma alla sua trasformazione in bioetanolo. I processi industriali attuali fanno costare il bioetanolo da cellulosa tre volte quello ottenuto da canna da zucchero.
La biotecnologia ambientale comprende varie discipline che svolgono un ruolo essenziale nella riduzione dei rifiuti ambientali e nella fornitura di processi sicuri per l'ambiente , come la biofiltrazione e la biodegradazione. La bonifica dei rifiuti ambientali è un esempio di applicazione della biotecnologia ambientale; mentre la perdita di biodiversità o la perdita di contenimento di un microbo dannoso sono esempi di implicazioni ambientali della biotecnologia.
Molte città hanno installato CityTrees , che utilizzano la biotecnologia per filtrare gli inquinanti dall'atmosfera urbana.
-
Filtro urbano CityTrees
La genomica e le sue applicazioni
[modifica | modifica sorgente]Lo studio degli acidi nucleici è iniziato con la scoperta del DNA, è progredito verso lo studio dei geni e dei piccoli frammenti, e ora è esploso nel campo della genomica. La genomica è lo studio di interi genomi, incluso il set completo di geni, la loro sequenza e organizzazione dei nucleotidi e le loro interazioni all'interno di una specie e con altre specie. La tecnologia di sequenziamento del DNA ha contribuito ai progressi della genomica. Proprio come la tecnologia informatica ha portato a Google Maps che consente alle persone di ottenere informazioni dettagliate sulle posizioni in tutto il mondo, i ricercatori utilizzano le informazioni genomiche per creare mappe del DNA simili di diversi organismi. Queste scoperte hanno aiutato gli antropologi a comprendere meglio la migrazione umana e hanno aiutato il campo medico attraverso la mappatura delle malattie genetiche umane. Le informazioni genomiche possono contribuire alla comprensione scientifica in vari modi e la conoscenza in questo campo sta crescendo rapidamente.
L'introduzione di progetti di sequenziamento del DNA e di sequenziamento dell'intero genoma, in particolare il progetto Genoma Umano, ha ampliato l'applicabilità delle informazioni sulla sequenza del DNA. Molti campi, come la metagenomica, la farmacogenomica e la genomica mitocondriale, utilizzano la genomica. La comprensione e la ricerca di cure per le malattie è l'applicazione più comune della genomica.
Prevedere il rischio di malattia a livello individuale
[modifica | modifica sorgente]La previsione del rischio di malattia comporta lo screening di individui attualmente sani tramite analisi del genoma a livello individuale. I professionisti sanitari possono raccomandare un intervento con cambiamenti nello stile di vita e farmaci prima dell'insorgenza della malattia. Tuttavia, questo approccio è più applicabile quando il problema risiede in un singolo difetto genetico. Tali difetti rappresentano solo circa il 5 percento delle malattie nei paesi sviluppati. La maggior parte delle malattie comuni, come le malattie cardiache, sono multifattoriali o poligeniche , ovvero una caratteristica fenotipica che coinvolge due o più geni e coinvolge anche fattori ambientali come la dieta. Nell'aprile 2010, gli scienziati della Stanford University hanno pubblicato l'analisi del genoma di un individuo sano (Stephen Quake, uno scienziato della Stanford University, il cui genoma è stato sequenziato). L'analisi ha previsto la sua propensione ad acquisire varie malattie. Il team medico ha eseguito una valutazione del rischio per analizzare la percentuale di rischio di Quake per 55 diverse condizioni mediche. Il team ha trovato una rara mutazione genetica, che ha mostrato che era a rischio di infarto improvviso. I risultati hanno anche previsto che Quake aveva un rischio del 23 percento di sviluppare un cancro alla prostata e un rischio dell'1,4 percento di sviluppare l'Alzheimer. Gli scienziati hanno utilizzato database e diverse pubblicazioni per analizzare i dati genomici. Anche se il sequenziamento genomico sta diventando più conveniente e gli strumenti analitici stanno diventando più affidabili, i ricercatori devono ancora affrontare le questioni etiche che circondano l'analisi genomica a livello di popolazione.
Farmacogenomica e Tossicogenomica
[modifica | modifica sorgente]La farmacogenomica , o tossicogenomica, comporta la valutazione dell'efficacia e della sicurezza dei farmaci sulla base delle informazioni provenienti dalla sequenza genomica di un individuo. Possiamo studiare le risposte genomiche ai farmaci utilizzando animali da esperimento (come ratti o topi da laboratorio) o cellule vive in laboratorio prima di intraprendere studi sugli esseri umani. Studiare i cambiamenti nell'espressione genica potrebbe fornire informazioni sul profilo di trascrizione in presenza del farmaco, che possiamo utilizzare come indicatore precoce del potenziale di effetti tossici. Ad esempio, i geni coinvolti nella crescita cellulare e nella morte cellulare controllata, se disturbati, potrebbero portare alla crescita di cellule cancerose. Gli studi sull'intero genoma possono anche aiutare a trovare nuovi geni coinvolti nella tossicità dei farmaci. I professionisti medici possono utilizzare le informazioni personali sulla sequenza del genoma per prescrivere farmaci che saranno più efficaci e meno tossici sulla base del genotipo del singolo paziente. Le firme genetiche potrebbero non essere completamente accurate, ma i professionisti medici possono testarle ulteriormente prima che si manifestino sintomi patologici.
Genomica microbica: Metagenomica
[modifica | modifica sorgente]Tradizionalmente, gli studiosi hanno insegnato microbiologia con la convinzione che sia meglio studiare i microrganismi in condizioni di coltura pura . Ciò comporta l'isolamento di un singolo tipo di cellula e la sua coltura in laboratorio. Poiché i microrganismi possono attraversare diverse generazioni nel giro di poche ore, i loro profili di espressione genica si adattano molto rapidamente al nuovo ambiente di laboratorio. Inoltre, la stragrande maggioranza delle specie batteriche resiste alla coltura in isolamento. La maggior parte dei microrganismi non vive come entità isolate, ma in comunità microbiche o biofilm. Per tutti questi motivi, la coltura pura non è sempre il modo migliore per studiare i microrganismi. La metagenomica è lo studio dei genomi collettivi di più specie che crescono e interagiscono in una nicchia ambientale. La metagenomica può essere utilizzata per identificare nuove specie più rapidamente e per analizzare l'effetto degli inquinanti sull'ambiente.
Genomica microbica: creazione di nuovi biocarburanti
[modifica | modifica sorgente]La conoscenza della genomica dei microrganismi viene utilizzata per trovare modi migliori per sfruttare i biocarburanti da alghe e cianobatteri. Le principali fonti di carburante oggi sono carbone, petrolio, legno e altri prodotti vegetali, come l'etanolo. Sebbene le piante siano risorse rinnovabili, c'è ancora bisogno di trovare più fonti alternative di energia rinnovabile per soddisfare la domanda energetica della nostra popolazione. Il mondo microbico è una delle più grandi risorse di geni che codificano nuovi enzimi e producono nuovi composti organici, e rimane in gran parte inutilizzato. I microrganismi vengono utilizzati per creare prodotti, come enzimi utilizzati nella ricerca, antibiotici e altri meccanismi antimicrobici. La genomica microbica sta aiutando a sviluppare strumenti diagnostici, vaccini migliorati, nuovi trattamenti per le malattie e tecniche avanzate di bonifica ambientale.
Genomica mitocondriale
[modifica | modifica sorgente]I mitocondri sono organelli intracellulari che contengono il proprio DNA. Il DNA mitocondriale muta a un ritmo rapido e gli scienziati spesso lo usano per studiare le relazioni evolutive. Un'altra caratteristica che rende interessante lo studio del genoma mitocondriale è che il DNA mitocondriale nella maggior parte degli organismi multicellulari passa dalla madre durante il processo di fecondazione. Per questo motivo, gli scienziati spesso usano la genomica mitocondriale per tracciare la genealogia.
Genomica in ambito forense
[modifica | modifica sorgente]Gli esperti hanno utilizzato informazioni e indizi tratti da campioni di DNA sulle scene del crimine come prove nei casi giudiziari e hanno utilizzato marcatori genetici nell'analisi forense. Anche l'analisi genomica è diventata utile in questo campo. La prima pubblicazione che mostrava il primo utilizzo della genomica in ambito forense è uscita nel 2001. Si è trattato di un tentativo collaborativo tra istituti di ricerca accademica e l'FBI per risolvere i misteriosi casi di antrace comunicati tramite il servizio postale statunitense. Utilizzando la genomica microbica, i ricercatori hanno determinato che il colpevole ha utilizzato uno specifico ceppo di antrace in tutte le spedizioni.
Genomica in agricoltura
[modifica | modifica sorgente]La genomica può ridurre in una certa misura le prove e gli insuccessi coinvolti nella ricerca scientifica, il che potrebbe migliorare la qualità e la quantità della resa delle colture agricole. Collegare i tratti ai geni o alle firme genetiche aiuta a migliorare la selezione delle colture per generare ibridi con le qualità più desiderabili. Gli scienziati utilizzano i dati genomici per identificare i tratti desiderabili e quindi trasferirli a un organismo diverso. I ricercatori stanno scoprendo come la genomica può migliorare la qualità e la quantità della produzione agricola. Ad esempio, gli scienziati potrebbero utilizzare i tratti desiderabili per creare un prodotto utile o migliorare un prodotto esistente, come rendere una coltura sensibile alla siccità più tollerante alla stagione secca.
La genomica e la proteomica
[modifica | modifica sorgente]Le proteine sono i prodotti finali dei geni, che aiutano a svolgere la funzione codificata dal gene. Gli amminoacidi comprendono le proteine e svolgono ruoli importanti nella cellula. Tutti gli enzimi (tranne i ribozimi) sono proteine che agiscono come catalizzatori per influenzare la velocità delle reazioni. Le proteine sono anche molecole regolatrici e alcune sono ormoni. Le proteine di trasporto, come l'emoglobina, aiutano a trasportare l'ossigeno a vari organi. Anche gli anticorpi che difendono dalle particelle estranee sono proteine. Nello stato di malattia, la funzione delle proteine può essere compromessa a causa di cambiamenti a livello genetico o a causa dell'impatto diretto su una proteina specifica.
Un proteoma è l'intero set di proteine prodotto da un tipo di cellula. Possiamo studiare i proteomi usando la conoscenza dei genomi perché i geni codificano per gli mRNA e gli mRNA codificano le proteine. Sebbene l'analisi degli mRNA sia un passo nella giusta direzione, non tutti gli mRNA vengono tradotti in proteine. La proteomica è lo studio della funzione dei proteomi. La proteomica integra la genomica ed è utile quando gli scienziati vogliono testare le loro ipotesi basate sui geni. Sebbene tutte le cellule degli organismi multicellulari abbiano lo stesso set di geni, il set di proteine prodotte in tessuti diversi è diverso e dipende dall'espressione genica. Pertanto, il genoma è costante, ma il proteoma varia ed è dinamico all'interno di un organismo. Inoltre, gli RNA possono essere alternativamente giuntati (tagliati e incollati per creare nuove combinazioni e nuove proteine) e molte proteine si modificano dopo la traduzione tramite processi come scissione proteolitica, fosforilazione, glicosilazione e ubiquitinazione. Esistono anche interazioni proteina-proteina, che complicano lo studio dei proteomi. Sebbene il genoma fornisca un modello, l'architettura finale dipende da diversi fattori che possono modificare la progressione degli eventi che generano il proteoma.
La metabolomica è correlata alla genomica e alla proteomica. La metabolomica implica lo studio dei metaboliti di piccole molecole in un organismo. Il metaboloma è l'insieme completo di metaboliti che sono correlati al corredo genetico di un organismo. La metabolomica offre un'opportunità di confrontare il corredo genetico e le caratteristiche fisiche, così come il corredo genetico e i fattori ambientali. L'obiettivo della ricerca sul metaboloma è identificare, quantificare e catalogare tutti i metaboliti nei tessuti e nei fluidi degli organismi viventi.
Tecniche di base nell'analisi delle proteine
[modifica | modifica sorgente]L'obiettivo finale della proteomica è identificare o confrontare le proteine espresse da un dato genoma in condizioni specifiche, studiare le interazioni tra le proteine e utilizzare le informazioni per prevedere il comportamento cellulare o sviluppare bersagli farmacologici. Proprio come gli scienziati analizzano il genoma utilizzando la tecnica di base del sequenziamento del DNA, la proteomica richiede tecniche per l'analisi delle proteine. La tecnica di base per l'analisi delle proteine, analoga al sequenziamento del DNA, è la spettrometria di massa. La spettrometria di massa identifica e determina le caratteristiche di una molecola. I progressi nella spettrometria hanno consentito ai ricercatori di analizzare campioni di proteine molto piccoli. La cristallografia a raggi X, ad esempio, consente agli scienziati di determinare la struttura tridimensionale di un cristallo proteico a risoluzione atomica. Un'altra tecnica di imaging proteico, la risonanza magnetica nucleare (NMR), utilizza le proprietà magnetiche degli atomi per determinare la struttura tridimensionale della proteina in soluzione acquosa. Gli scienziati hanno anche utilizzato i microarray proteici per studiare le interazioni proteiche. Adattamenti su larga scala dello schermo di base a due ibridi ( Figura 17.17 ) hanno fornito la base per i microarray proteici. Gli scienziati utilizzano software per computer per analizzare l'enorme quantità di dati per l'analisi proteomica.
Le analisi su scala genomica e proteomica fanno parte della biologia dei sistemi , che è lo studio di interi sistemi biologici (genomi e proteomi) in base alle interazioni all'interno del sistema. L'Istituto europeo di bioinformatica e l'Organizzazione del proteoma umano (HUPO) stanno sviluppando e stabilendo strumenti efficaci per esaminare l'enorme pila di dati della biologia dei sistemi. Poiché le proteine sono prodotti diretti dei geni e riflettono l'attività a livello genomico, è naturale usare i proteomi per confrontare i profili proteici di diverse cellule per identificare proteine e geni coinvolti nei processi patologici. La maggior parte delle sperimentazioni sui farmaci farmaceutici ha come target le proteine. I ricercatori usano le informazioni che ottengono dalla proteomica per identificare nuovi farmaci e comprenderne i meccanismi d'azione.
Proteomica del cancro
[modifica | modifica sorgente]I ricercatori stanno studiando i genomi e i proteomi dei pazienti per comprendere la base genetica delle malattie. La malattia più importante che i ricercatori stanno studiando con approcci proteomici è il cancro. Questi approcci migliorano lo screening e la diagnosi precoce del cancro. I ricercatori sono in grado di identificare proteine la cui espressione indica il processo della malattia. Una singola proteina è un biomarcatore; mentre un insieme di proteine con livelli di espressione alterati è una firma proteica . Affinché un biomarcatore o una firma proteica siano utili come candidati per lo screening e la diagnosi precoce del cancro, devono essere secreti nei fluidi corporei, come sudore, sangue o urina, in modo che gli operatori sanitari possano eseguire screening su larga scala in modo non invasivo. L'attuale problema con l'uso di biomarcatori per la diagnosi precoce del cancro è l'alto tasso di risultati falsi negativi. Un falso negativo è un risultato del test errato che avrebbe dovuto essere positivo. In altre parole, molti casi di cancro non vengono rilevati, il che rende i biomarcatori inaffidabili. Alcuni esempi di biomarcatori proteici nella diagnosi del cancro sono CA-125 per il cancro ovarico e PSA per il cancro alla prostata. Le firme proteiche potrebbero essere più affidabili dei biomarcatori per rilevare le cellule tumorali. I ricercatori stanno anche utilizzando la proteomica per sviluppare piani di trattamento personalizzati, che implicano la previsione se un individuo risponderà o meno a farmaci specifici e gli effetti collaterali che l'individuo potrebbe sperimentare. I ricercatori utilizzano anche la proteomica per prevedere la possibilità di recidiva della malattia.
Il National Cancer Institute ha sviluppato programmi per migliorare la diagnosi e il trattamento del cancro. Le Clinical Proteomic Technologies for Cancer e l'Early Detection Research Network sono sforzi per identificare le firme proteiche specifiche per diversi tipi di cancro. Il Biomedical Proteomics Program identifica le firme proteiche e progetta terapie efficaci per i pazienti oncologici.
Fonti
[modifica | modifica sorgente]https://en.wikipedia.org/wiki/Outline_of_biotechnology
https://en.wikipedia.org/wiki/Biotechnology
https://it.wikipedia.org/wiki/Biotecnologia