Biologia per il liceo/Le biomolecole
Gli esseri viventi sono formati soprattutto da acqua e biomolecole, e piccole quantità di metalli e sali minerali.
L'acqua
[modifica | modifica sorgente]L'acqua è una delle molecole più abbondanti e quella più critica per la vita sulla Terra. L'acqua comprende circa il 60-70 percento del corpo umano. Senza di essa, la vita come la conosciamo semplicemente non esisterebbe.
L'acqua allo stato liquido dunque è alla base della vita. La polarità della molecola d'acqua e il conseguente legame idrogeno rendono l'acqua una sostanza unica con proprietà speciali che sono intimamente legate ai processi della vita. La vita si è evoluta originariamente in un ambiente acquoso e la maggior parte della chimica cellulare e del metabolismo di un organismo si verificano all'interno del contenuto acquoso del citoplasma della cellula. Le proprietà speciali dell'acqua sono la sua elevata capacità termica e il calore di vaporizzazione, la sua capacità di dissolvere molecole polari, le sue proprietà coesive e adesive e la sua dissociazione in ioni che porta alla generazione di pH. Comprendere queste caratteristiche dell'acqua aiuta a chiarire la sua importanza nel mantenimento della vita.
Per approfondire le proprietà dell'acqua vai alla relativa pagina su Chimica per il liceo
Il carbonio
[modifica | modifica sorgente]Molte molecole complesse chiamate macromolecole, come proteine, acidi nucleici (RNA e DNA), carboidrati e lipidi compongono le cellule. Le macromolecole (biomolecole) sono un sottoinsieme di molecole organiche (qualsiasi liquido, solido o gas contenente carbonio) che sono particolarmente importanti per la vita. Il componente fondamentale per tutte queste macromolecole è il carbonio. L'atomo di carbonio ha proprietà uniche che gli consentono di formare legami covalenti con ben quattro atomi diversi, rendendo questo elemento versatile ideale per fungere da componente strutturale di base, o "spina dorsale", delle macromolecole.
I singoli atomi di carbonio hanno un guscio elettronico più esterno incompleto. Con un numero atomico di 6 (sei elettroni e sei protoni), i primi due elettroni riempiono il guscio interno, lasciandone quattro nel secondo guscio. Pertanto, gli atomi di carbonio in genere formano quattro legami covalenti abbastanza forti e stabili con altri atomi per soddisfare la regola dell'ottetto. La molecola di metano fornisce un esempio: ha la formula chimica CH4 . Ognuno dei suoi quattro atomi di idrogeno forma un singolo legame covalente con l'atomo di carbonio condividendo una coppia di elettroni. Ciò si traduce in un guscio esterno riempito.
Grazie a questi legami stabili, esso forma facilmente strutture lineari, ramificate e cicliche(vedi galleria sotto).
Carbonio e idrogeno formano gli idrocarburi (come il metano e il pentano) che assieme a gruppi chimici particolari chiamati gruppi funzionali (che contengono altri tipi di elementi come ossigeno, azoto, fosforo, ecc.) formano le biomolecole come il glucosio.
-
metano
-
pentano lineare
-
pentano "ramificato"
-
Glucosio in forma lineare
-
glucosio e galattosio
-
glucosio in forma ciclica
-
acidi grassi, importanti componenti dei lipidi e delle membrane
Legami tra molecole
[modifica | modifica sorgente]Nei viventi spesso le piccole molecole biologiche si uniscono tra loro per formare molecole più grandi. Oppure grandi molecole vengono demolite in molecole più piccole.
Condensazione (o disidratazione)
[modifica | modifica sorgente]La maggior parte delle macromolecole è composta da singole subunità, o blocchi di costruzione, chiamati monomeri . I monomeri si combinano tra loro tramite legami covalenti per formare molecole più grandi note come polimeri . Così facendo, i monomeri rilasciano molecole d'acqua come sottoprodotti. Questo tipo di reazione è la sintesi per disidratazione , che significa "mettere insieme perdendo acqua".

In una reazione di sintesi per disidratazione, l'idrogeno di un monomero si combina con il gruppo idrossilico di un altro monomero, rilasciando una molecola d'acqua. Allo stesso tempo, i monomeri condividono elettroni e formano legami covalenti. Quando si uniscono altri monomeri, questa catena di monomeri ripetuti forma un polimero. Diversi tipi di monomeri possono combinarsi in molte configurazioni, dando origine a un gruppo eterogeneo di macromolecole. Anche un solo tipo di monomero può combinarsi in vari modi per formare diversi polimeri. Ad esempio, i monomeri di glucosio sono i costituenti di amido, glicogeno e cellulosa.
Idrolisi
[modifica | modifica sorgente]I polimeri si scompongono in monomeri durante l'idrolisi. Si verifica una reazione chimica quando si inserisce una molecola d'acqua attraverso il legame. Durante queste reazioni, il polimero si scompone in due componenti: una parte guadagna un atomo di idrogeno (H+) e l'altra guadagna una molecola di idrossile (OH–) da una molecola d'acqua divisa.

Nella reazione di idrolisi qui, il disaccaride maltosio si scompone per formare due monomeri di glucosio aggiungendo una molecola d'acqua. Si noti che questa reazione è l'inverso della reazione di sintesi.
Le reazioni di disidratazione e idrolisi sono catalizzate o "accelerate" da enzimi specifici; le reazioni di disidratazione comportano la formazione di nuovi legami, che richiedono energia, mentre le reazioni di idrolisi rompono i legami e rilasciano energia. Queste reazioni sono simili per la maggior parte delle macromolecole, ma ogni reazione di monomero e polimero è specifica per la sua classe. Ad esempio, gli enzimi catalitici nell'apparato digerente idrolizzano o scompongono il cibo che ingeriamo in molecole più piccole. Ciò consente alle cellule del nostro corpo di assorbire facilmente i nutrienti nell'intestino. Un enzima specifico scompone ogni macromolecola. Ad esempio, amilasi, saccarasi, lattasi o maltasi scompongono i carboidrati. Enzimi chiamati proteasi, come pepsina e peptidasi, e acido cloridrico scompongono le proteine. Le lipasi scompongono i lipidi. Queste macromolecole scomposte forniscono energia per le attività cellulari.
Le biomolecole
[modifica | modifica sorgente]Le macromolecole biologiche o biomolecole sono molecole di grandi dimensioni, necessarie per la vita, che sono costruite da molecole organiche più piccole. Esistono quattro principali classi di macromolecole biologiche: carboidrati, lipidi, proteine e acidi nucleici. Queste categorie verranno trattate in apposite pagine. Ognuna è un componente cellulare importante e svolge una vasta gamma di funzioni. Insieme, queste molecole costituiscono la maggior parte della massa secca di una cellula (ricorda che l'acqua costituisce la maggior parte della sua massa completa). Le macromolecole biologiche sono organiche, il che significa che contengono carbonio e sono legate all'idrogeno e possono contenere ossigeno, azoto e altri elementi minori.
Carboidrati
[modifica | modifica sorgente]La maggior parte delle persone ha familiarità con i carboidrati, un tipo di macromolecola, soprattutto quando si tratta di ciò che mangiamo. Per perdere peso, alcuni individui aderiscono a diete "low-carb". Gli atleti, al contrario, spesso "caricano di carboidrati" prima di competizioni importanti per assicurarsi di avere abbastanza energia per competere ad alto livello. I carboidrati sono, infatti, una parte essenziale della nostra dieta. Cereali, frutta e verdura sono tutte fonti naturali di carboidrati che forniscono energia al corpo, in particolare attraverso il glucosio, uno zucchero semplice che è un componente dell'amido e un ingrediente in molti alimenti di base. I carboidrati hanno anche altre funzioni importanti negli esseri umani, negli animali e nelle piante.
Strutture molecolari
[modifica | modifica sorgente]La formula stechiometrica (CH2O)n , dove n è il numero di atomi di carbonio nella molecola, rappresenta i carboidrati . In altre parole, il rapporto tra carbonio, idrogeno e ossigeno è 1:2:1 nelle molecole di carboidrati. Questa formula spiega anche l'origine del termine "carboidrati": i componenti sono carbonio ("carbo") e i componenti di acqua (da qui, "idrato"). Gli scienziati classificano i carboidrati in tre sottotipi: monosaccaridi, disaccaridi e polisaccaridi.
Monosaccaridi
[modifica | modifica sorgente]I monosaccaridi (mono- = "uno"; sacchar- = "dolce") sono zuccheri semplici, il più comune dei quali è il glucosio. Nei monosaccaridi, il numero di atomi di carbonio varia solitamente da tre a sette. La maggior parte dei nomi dei monosaccaridi termina con il suffisso -osio. Se lo zucchero ha un gruppo aldeidico (il gruppo funzionale con la struttura R-CHO), è un aldoso, e se ha un gruppo chetonico (il gruppo funzionale con la struttura RC(=O)R'), è un chetoso. A seconda del numero di atomi di carbonio nello zucchero, possono essere triosi (tre atomi di carbonio), pentosi (cinque atomi di carbonio) e/o esosi (sei atomi di carbonio). La Figura sotto illustra i monosaccaridi.

Gli scienziati classificano i monosaccaridi in base alla posizione del loro gruppo carbonilico e al numero di atomi di carbonio nella catena principale. Gli aldosi hanno un gruppo carbonilico (indicato in verde) alla fine della catena di atomi di carbonio, mentre i chetosi hanno un gruppo carbonilico al centro della catena di atomi di carbonio. I triosi, i pentosi e gli esosi hanno rispettivamente catene principali a tre, cinque e sei atomi di carbonio.
La formula chimica del glucosio è C6H12O6 . Negli esseri umani, il glucosio è un'importante fonte di energia. Durante la respirazione cellulare, l'energia viene rilasciata dal glucosio e quell'energia aiuta a produrre adenosina trifosfato (ATP). Le piante sintetizzano il glucosio usando anidride carbonica e acqua e il glucosio a sua volta fornisce il fabbisogno energetico della pianta. Gli esseri umani e altri animali che si nutrono di piante spesso ottengono il glucosio dall'amido catabolizzato (decomposizione cellulare di molecole più grandi).

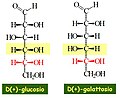
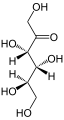
Il galattosio (parte del lattosio, o zucchero del latte) e il fruttosio (presente nel saccarosio, nella frutta) sono altri monosaccaridi comuni. Sebbene glucosio, galattosio e fruttosio abbiano tutti la stessa formula chimica C6H12O6, differiscono strutturalmente e chimicamente (e sono isomeri) a causa della diversa disposizione dei gruppi funzionali attorno al carbonio asimmetrico. Tutti questi monosaccaridi hanno più di un carbonio asimmetrico ( Figura accanto).
Glucosio, galattosio e fruttosio sono monosaccaridi isomerici (esosi), ovvero hanno la stessa formula chimica ma strutture leggermente diverse. Glucosio e galattosio sono aldosi e il fruttosio è un chetoso.
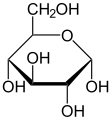
I monosaccaridi possono esistere come una catena lineare o come molecole a forma di anello. In soluzioni acquose sono solitamente in forma di anello ( Figura 3.6 ). Il glucosio in forma di anello può avere due diverse disposizioni del gruppo idrossilico (OH) attorno al carbonio anomerico (carbonio 1 che diventa asimmetrico nel processo di formazione dell'anello). Se il gruppo idrossilico è al di sotto del numero di carbonio 1 nello zucchero, è in posizione alfa ( α ), e se è al di sopra del piano, è in posizione beta ( β ).
I monosaccaridi a cinque e sei atomi di carbonio esistono in equilibrio tra forme lineari e ad anello. Quando si forma l'anello, la catena laterale su cui si chiude si blocca in una posizione α o β (vedi la seconda immagine della galleria qui sotto). Anche il fruttosio e il ribosio formano anelli (vedi disegno sotto), sebbene formino anelli a cinque elementi al contrario dell'anello a sei elementi del glucosio.
-
Ribosio e fruttosio nella forma ciclica
-
Conversione tra la struttura lineare e ciclica
-
alfa-glucosio
-
Il glucosio D è quello presente in natura
-
Diversi modi di rappresentare il fruttosio
-
D-fruttosio
-
alfa-D-fruttosio
Disaccaridi
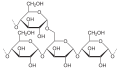
[modifica | modifica sorgente]I disaccaridi (di- = "due") si formano quando due monosaccaridi subiscono una reazione di disidratazione (o una reazione di condensazione o sintesi di disidratazione). Durante questo processo, il gruppo idrossilico di un monosaccaride si combina con l'idrogeno di un altro monosaccaride, rilasciando una molecola d'acqua e formando un legame covalente. Un legame covalente si forma tra una molecola di carboidrato e un'altra molecola (in questo caso, tra due monosaccaridi). Gli scienziati chiamano questo legame glicosidico ( Figura sotto ). I legami glicosidici (o legami glicosidici) possono essere di tipo alfa o beta. Un legame alfa si forma quando il gruppo OH sul carbonio-1 del primo glucosio è al di sotto del piano dell'anello e un legame beta si forma quando il gruppo OH sul carbonio-1 è al di sopra del piano dell'anello.

Il saccarosio (sucrose in inglese) si forma quando un monomero di glucosio e un monomero di fruttosio si uniscono in una reazione di disidratazione per formare un legame glicosidico. Nel processo, si perde una molecola d'acqua. Per convenzione, gli atomi di carbonio in un monosaccaride sono numerati a partire dal carbonio terminale più vicino al gruppo carbonilico. Nel saccarosio, si forma un legame glicosidico tra il carbonio 1 nel glucosio e il carbonio 2 nel fruttosio.

I disaccaridi comuni includono lattosio, maltosio e saccarosio (Figura accanto). Il lattosio è un disaccaride costituito dai monomeri glucosio e galattosio. È naturalmente presente nel latte. Il maltosio, o zucchero di malto, è un disaccaride formato da una reazione di disidratazione tra due molecole di glucosio. Il disaccaride più comune è il saccarosio, o zucchero da tavola, che è composto da monomeri di glucosio e fruttosio.
Polisaccaridi
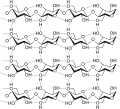
[modifica | modifica sorgente]Una lunga catena di monosaccaridi legati da legami glicosidici è un polisaccaride (poli- = "molti"). La catena può essere ramificata o non ramificata e può contenere diversi tipi di monosaccaridi. Il peso molecolare può essere di 100.000 dalton o più a seconda del numero di monomeri uniti. Amido, glicogeno, cellulosa e chitina sono esempi primari di polisaccaridi.
Le piante immagazzinano gli zuccheri sotto forma di amido. Nelle piante, una miscela di amilosio e amilopectina (entrambi polimeri di glucosio) comprende questi zuccheri. Le piante sono in grado di sintetizzare il glucosio e immagazzinano il glucosio in eccesso, oltre al loro immediato fabbisogno energetico, come amido in diverse parti della pianta, tra cui radici e semi. L'amido nei semi fornisce cibo all'embrione mentre germina e può anche fungere da fonte di cibo per esseri umani e animali. Gli enzimi scompongono l'amido che gli esseri umani consumano. Ad esempio, un'amilasi presente nella saliva catalizza o scompone questo amido in molecole più piccole, come maltosio e glucosio. Le cellule possono quindi assorbire il glucosio.
L'amido di glucosio comprende monomeri che sono uniti da legami glicosidici α 1-4 o α 1-6. I numeri 1-4 e 1-6 si riferiscono al numero di atomi di carbonio dei due residui che si sono uniti per formare il legame. Come illustrato nella Figura sotto , le catene monomeriche di glucosio non ramificate (solo legami α 1-4) formano l'amido; mentre l'amilopectina è un polisaccaride ramificato ( legami α 1-6 nei punti di ramificazione).

Il glicogeno è la forma di riserva del glucosio negli esseri umani e in altri vertebrati ed è composto da monomeri di glucosio. Il glicogeno è l'equivalente animale dell'amido ed è una molecola altamente ramificata solitamente immagazzinata nel fegato e nelle cellule muscolari. Ogni volta che i livelli di glucosio nel sangue diminuiscono, il glicogeno si scompone per rilasciare glucosio in un processo che gli scienziati chiamano glicogenolisi.
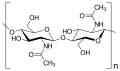
La cellulosa è il biopolimero naturale più abbondante. La cellulosa è composta principalmente dalla parete cellulare di una pianta. Questa fornisce il supporto strutturale della cellula. Il legno e la carta sono per lo più cellulosici in natura. I monomeri di glucosio comprendono la cellulosa che i legami glicosidici β 1-4 collegano ( Figura sotto ).

Come mostra la figura, ogni altro monomero di glucosio nella cellulosa è capovolto e i monomeri sono impacchettati strettamente come lunghe catene estese. Ciò conferisce alla cellulosa la sua rigidità e l'elevata resistenza alla trazione, che è così importante per le cellule vegetali. Mentre gli enzimi digestivi umani non possono scomporre il legame β 1-4, gli erbivori come mucche, koala e bufali sono in grado, con l'aiuto della flora specializzata nel loro stomaco, di digerire materiale vegetale ricco di cellulosa e di utilizzarlo come fonte di cibo. In alcuni di questi animali, alcune specie di batteri e protisti risiedono nel rumine (parte dell'apparato digerente dell'erbivoro) e secernono l'enzima cellulasi. L'appendice degli animali al pascolo contiene anche batteri che digeriscono la cellulosa, conferendole un ruolo importante nell'apparato digerente dei ruminanti. Le cellulasi possono scomporre la cellulosa in monomeri di glucosio che gli animali utilizzano come fonte di energia. Le termiti sono in grado di scomporre la cellulosa anche grazie alla presenza nel loro corpo di altri organismi che secernono cellulasi.
I carboidrati svolgono varie funzioni in diversi animali. Gli artropodi (insetti, crostacei e altri) hanno uno scheletro esterno, l'esoscheletro, che protegge le parti interne del loro corpo. Questo esoscheletro è costituito dalla macromolecola biologica chitina , che è un polisaccaride contenente azoto. È costituito da unità ripetute di N-acetil- β -d-glucosamina, che sono uno zucchero modificato. La chitina è anche un componente principale delle pareti cellulari fungine. I funghi non sono né animali né piante e formano un regno a sé stante nel dominio Eukarya.
-
Struttura dell'amido amilosio
-
Amilopectina, caratterizzata da una struttura più ramificata
-
Amido in polvere
-
L'amido è la riserva di glucosio per le piante
-
Struttura altamente ramificata del glicogeno; si accumula nel fegato e nei muscoli come riserva di glucosio negli animali
-
Cellulosa
-
struttura della cellulosa
-
Filamenti di cellulosa, sono evidenziati i legami idrogeno (tratteggiati) all'interno e tra le molecole di cellulosa.
-
legami a idrogeno (inter e intramolecolari) nella cellulosa
-
La cellulosa viene sintetizzata per fare la parete delle cellule vegetali
-
Il cotone è fatto di cellulosa
-
Jeans e t-shirt sono fatti di cotone
-
La chitina ha la stessa formula della cellulosa, con l'aggiunta del gruppo N-acetile
-
L'esoscheletro degli insetti è fatto di chitina
-
Le pareti cellulari dei funghi sono fatte di chitina
Benefici dei carboidrati
[modifica | modifica sorgente]I carboidrati fanno bene? Alcune persone credono che i carboidrati facciano male e che dovrebbero evitarli. Alcune diete proibiscono completamente il consumo di carboidrati, sostenendo che una dieta a basso contenuto di carboidrati aiuta le persone a perdere peso più velocemente. Tuttavia, i carboidrati sono stati una parte importante della dieta umana per migliaia di anni. Reperti di antiche civiltà mostrano la presenza di grano, riso e mais nelle aree di stoccaggio dei nostri antenati.
Come parte di una dieta ben bilanciata, dovremmo integrare i carboidrati con proteine, vitamine e grassi. In termini di calorie, un grammo di carboidrati fornisce 4,3 Kcal. Per fare un confronto, i grassi forniscono 9 Kcal/g, un rapporto meno desiderabile. I carboidrati contengono elementi solubili e insolubili. La parte insolubile, la fibra, è per lo più cellulosa. La fibra ha molti usi. Favorisce il movimento intestinale regolare aggiungendo massa e regola il tasso di consumo di glucosio nel sangue. La fibra aiuta anche a rimuovere il colesterolo in eccesso dal corpo. La fibra si lega al colesterolo nell'intestino tenue, quindi si attacca al colesterolo e impedisce alle particelle di colesterolo di entrare nel flusso sanguigno. Il colesterolo quindi esce dal corpo attraverso le feci. Le diete ricche di fibre hanno anche un ruolo protettivo nel ridurre l'insorgenza del cancro al colon. Inoltre, un pasto contenente cereali integrali e verdure dà una sensazione di pienezza. Come fonte immediata di energia, il glucosio si scompone durante il processo di respirazione cellulare, che produce ATP, la valuta energetica della cellula. Senza consumare carboidrati, riduciamo la disponibilità di “energia istantanea”. Eliminare i carboidrati dalla dieta può essere dunque dannoso se non si viene seguiti da un professionista.
Lipidi
[modifica | modifica sorgente]
I lipidi includono un gruppo eterogeneo di composti che sono in gran parte di natura non polare. Questo perché sono idrocarburi che includono principalmente legami carbonio-carbonio o carbonio-idrogeno non polari. Le molecole non polari sono idrofobiche ("temono l'acqua") o insolubili in acqua. I lipidi svolgono molte funzioni diverse in una cellula. Le cellule immagazzinano energia per un uso a lungo termine sotto forma di grassi. I lipidi forniscono anche isolamento dall'ambiente per piante e animali. Ad esempio, aiutano a mantenere asciutti uccelli e mammiferi acquatici quando formano uno strato protettivo su pelliccia o piume a causa della loro natura idrofobica idrorepellente. I lipidi sono anche i mattoni di molti ormoni e sono un importante costituente di tutte le membrane cellulari. I lipidi includono grassi, oli, cere, fosfolipidi e steroidi.
Grassi e oli
[modifica | modifica sorgente]Una molecola di grasso è composta da due componenti principali: glicerolo e acidi grassi. Il glicerolo è un composto organico (alcol) con tre atomi di carbonio, cinque idrogeni e tre gruppi idrossilici (OH). Gli acidi grassi hanno una lunga catena di idrocarburi a cui è attaccato un gruppo carbossilico, da cui il nome "acido grasso". Il numero di atomi di carbonio nell'acido grasso può variare da 4 a 36. I più comuni sono quelli contenenti 12-18 atomi di carbonio. In una molecola di grasso, gli acidi grassi si legano a ciascuno dei tre atomi di carbonio della molecola di glicerolo con un legame estereo attraverso un atomo di ossigeno ( Figura 3.13 ).

Durante la formazione di questo legame estereo, vengono rilasciate tre molecole d'acqua. I tre acidi grassi nel triacilglicerolo possono essere simili o dissimili. Chiamiamo anche grassi triacilgliceroli o trigliceridi a causa della loro struttura chimica. Alcuni acidi grassi hanno nomi comuni che specificano la loro origine. Ad esempio, l'acido palmitico, un acido grasso saturo , è derivato dalla palma. L'acido arachidico è derivato da Arachis hypogea, il nome scientifico delle arachidi.
Gli acidi grassi possono essere saturi o insaturi. In una catena di acidi grassi, se ci sono solo legami singoli tra atomi di carbonio adiacenti nella catena idrocarburica, l'acido grasso è saturo. Gli acidi grassi saturi sono saturi di idrogeno. In altre parole, il numero di atomi di idrogeno attaccati allo scheletro di carbonio è massimizzato. L'acido stearico è un esempio di acido grasso saturo ( vedi figura ).

Quando la catena idrocarburica contiene un doppio legame, l'acido grasso è insaturo . L'acido oleico è un esempio di acido grasso insaturo ( vedi figura).
La maggior parte dei grassi insaturi sono liquidi a temperatura ambiente. Li chiamiamo oli. Se c'è un doppio legame nella molecola, allora è un grasso monoinsaturo (ad esempio, olio d'oliva), e se c'è più di un doppio legame, allora è un grasso polinsaturo (ad esempio, olio di canola).
Quando un acido grasso non ha doppi legami, è un acido grasso saturo perché non è possibile aggiungere altro idrogeno agli atomi di carbonio della catena. Un grasso può contenere acidi grassi simili o diversi legati al glicerolo. Gli acidi grassi lunghi e dritti con legami singoli generalmente si compattano strettamente e sono solidi a temperatura ambiente. I grassi animali con acido stearico e acido palmitico (comuni nella carne) e il grasso con acido butirrico (comune nel burro) sono esempi di grassi saturi. I mammiferi immagazzinano i grassi in cellule specializzate, o adipociti, dove i globuli di grasso occupano la maggior parte del volume della cellula. Le piante immagazzinano grassi o oli in molti semi e li usano come fonte di energia durante lo sviluppo delle piantine. I grassi o gli oli insaturi sono solitamente di origine vegetale e contengono acidi grassi insaturi cis . Cis e trans indicano la configurazione della molecola attorno al doppio legame. Se gli idrogeni sono presenti sullo stesso piano, è un grasso cis. Se gli atomi di idrogeno sono su due piani diversi, è un grasso trans . Il doppio legame cis provoca una curvatura o un "attorcigliamento" che impedisce agli acidi grassi di compattarsi strettamente, mantenendoli liquidi a temperatura ambiente ( Figura sotto ). Olio d'oliva, olio di mais, olio di canola e olio di fegato di merluzzo sono esempi di grassi insaturi. I grassi insaturi aiutano ad abbassare i livelli di colesterolo nel sangue; mentre i grassi saturi potrebbero contribuire alla formazione di placche nelle arterie.

Grassi trans
[modifica | modifica sorgente]L'industria alimentare idrogena artificialmente gli oli per renderli semisolidi e di una consistenza desiderabile per molti prodotti alimentari trasformati. In parole povere, l'idrogeno gassoso viene fatto gorgogliare attraverso gli oli per solidificarli. Durante questo processo di idrogenazione, i doppi legami della conformazione cis nella catena idrocarburica possono convertirsi in doppi legami nella conformazione trans .
La margarina, alcuni tipi di burro di arachidi e lo strutto sono esempi di grassi trans idrogenati artificialmente. Studi recenti hanno dimostrato che un aumento dei grassi trans nella dieta umana può portare a livelli più elevati di lipoproteine a bassa densità (LDL), o colesterolo "cattivo", che a sua volta può portare alla deposizione di placca nelle arterie, con conseguente malattia cardiaca. Molti ristoranti fast food hanno recentemente vietato l'uso di grassi trans e le etichette alimentari sono tenute a indicare il contenuto di grassi trans.
Acidi grassi omega
[modifica | modifica sorgente]
Gli acidi grassi essenziali sono quelli di cui il corpo umano ha bisogno ma che non sintetizza. Di conseguenza, devono essere integrati tramite l'ingestione tramite la dieta. Gli acidi grassi Omega -3 (come quelli nella Figura accanto) rientrano in questa categoria e sono uno dei soli due noti per gli esseri umani (l'altro è l'acido grasso Omega-6). Questi sono acidi grassi polinsaturi e sono Omega-3 perché un doppio legame collega il terzo carbonio dall'estremità della catena idrocarburica al carbonio adiacente.
Il carbonio più lontano dal gruppo carbossilico è numerato come carbonio omega ( ω ) e se il doppio legame è tra il terzo e il quarto carbonio da quell'estremità, è un acido grasso omega-3. Nutrizionalmente importanti perché il corpo non li produce, gli acidi grassi omega-3 includono l'acido alfa-linoleico (ALA), l'acido eicosapentaenoico (EPA) e l'acido docosaesaenoico (DHA), tutti polinsaturi. Salmone, trota e tonno sono buone fonti di acidi grassi omega-3. La ricerca indica che gli acidi grassi omega-3 riducono il rischio di morte improvvisa per infarto, abbassano i trigliceridi nel sangue, diminuiscono la pressione sanguigna e prevengono la trombosi inibendo la coagulazione del sangue. Riducono anche l'infiammazione e possono aiutare ad abbassare il rischio di alcuni tumori negli animali.
Come i carboidrati, i grassi hanno ricevuto una pubblicità negativa considerevole. È vero che mangiare troppi cibi fritti e altri cibi "grassi" porta ad aumentare di peso. Tuttavia, i grassi hanno funzioni importanti. Molte vitamine sono liposolubili e i grassi servono come forma di riserva a lungo termine di acidi grassi: una fonte di energia. Forniscono anche isolamento per il corpo. Pertanto, dovremmo consumare grassi "sani" in quantità moderate su base regolare.
Cere
[modifica | modifica sorgente]
La cera ricopre le piume di alcuni uccelli acquatici e la superficie delle foglie di alcune piante. Grazie alla natura idrofobica delle cere, esse impediscono all'acqua di attaccarsi alla superficie ( Figura accanto). Le lunghe catene di acidi grassi esterificate in alcoli a catena lunga comprendono le cere.
Fosfolipidi
[modifica | modifica sorgente]I fosfolipidi sono i principali costituenti della membrana plasmatica che compongono lo strato più esterno delle cellule. Come i grassi, sono composti da catene di acidi grassi attaccate a uno scheletro di glicerolo o sfingosina. Tuttavia, invece di tre acidi grassi attaccati come nei trigliceridi, ci sono due acidi grassi che formano il diacilglicerolo e un gruppo fosfato modificato occupa il terzo atomo di carbonio dello scheletro di glicerolo ( Figura sotto). Un gruppo fosfato da solo attaccato a un diacilglicerolo non si qualifica come fosfolipide. È il fosfatidato (diacilglicerolo 3-fosfato), il precursore dei fosfolipidi. Un alcol modifica il gruppo fosfato. La fosfatidilcolina e la fosfatidilserina sono due importanti fosfolipidi che si trovano nelle membrane plasmatiche.

Un fosfolipide è una molecola anfipatica, ovvero ha una parte idrofobica e una idrofila. Le catene di acidi grassi sono idrofobiche e non possono interagire con l'acqua; mentre il gruppo contenente fosfato è idrofilo e interagisce con l'acqua ( Figura accanto).

Il doppio strato fosfolipidico è il componente principale di tutte le membrane cellulari. I gruppi di testa idrofilici dei fosfolipidi sono rivolti verso la soluzione acquosa. Le code idrofobiche sono sequestrate al centro del doppio strato.
La testa è la parte idrofila, e la coda contiene gli acidi grassi idrofobici. In una membrana, un doppio strato di fosfolipidi forma la matrice della struttura, le code degli acidi grassi dei fosfolipidi sono rivolte verso l'interno, lontano dall'acqua; mentre il gruppo fosfato è rivolto verso l'esterno, lato acquoso.
I fosfolipidi sono responsabili della natura dinamica della membrana plasmatica. Se una goccia di fosfolipidi viene messa in acqua, forma spontaneamente una struttura che gli scienziati chiamano micella, dove le teste idrofile dei fosfati sono rivolte verso l'esterno e gli acidi grassi sono rivolti verso l'interno della struttura.

Steroidi
[modifica | modifica sorgente]A differenza dei fosfolipidi e dei grassi di cui abbiamo parlato prima, gli steroidi hanno una struttura ad anello fuso. Sebbene non assomiglino agli altri lipidi, gli scienziati li raggruppano con loro perché sono anche idrofobici e insolubili in acqua. Tutti gli steroidi hanno quattro anelli di carbonio collegati e molti di loro, come il colesterolo, hanno una coda corta ( Figura accanto). Molti steroidi hanno anche il gruppo funzionale –OH, che li colloca nella classificazione degli alcolici (steroli).
Il colesterolo è lo steroide più comune. Il fegato sintetizza il colesterolo ed è il precursore di molti ormoni steroidei come il testosterone e l'estradiolo, che le gonadi e le ghiandole endocrine secernono. È anche il precursore della vitamina D. Il colesterolo è anche il precursore dei sali biliari, che aiutano a emulsionare i grassi e il loro successivo assorbimento da parte delle cellule. Sebbene i profani parlino spesso negativamente del colesterolo, è necessario per il corretto funzionamento del corpo. Gli steroli (colesterolo nelle cellule animali, fitosterolo nelle piante) sono componenti della membrana plasmatica delle cellule e si trovano all'interno del doppio strato fosfolipidico.
Proteine
[modifica | modifica sorgente]Le proteine sono una delle molecole organiche più abbondanti nei sistemi viventi e hanno la gamma di funzioni più diversificata di tutte le macromolecole. Le proteine possono essere strutturali, regolatrici, contrattili o protettive. Possono servire per il trasporto, l'immagazzinamento o le membrane; oppure possono essere tossine o enzimi. Ogni cellula in un sistema vivente può contenere migliaia di proteine, ciascuna con una funzione unica. Le loro strutture, come le loro funzioni, variano notevolmente. Sono tutte, tuttavia, polimeri di amminoacidi disposti in una sequenza lineare. In genere non hanno funzioni energetiche (se l'organismo ha a disposizione carboidrati e lipidi).
Tipi e funzioni delle proteine
[modifica | modifica sorgente]Gli enzimi, prodotti dalle cellule viventi, sono catalizzatori nelle reazioni biochimiche (come la digestione) e sono solitamente proteine complesse o coniugate. Ogni enzima è specifico per il substrato (un reagente che si lega a un enzima) su cui agisce. L'enzima può aiutare nelle reazioni di degradazione, riarrangiamento o sintesi. Chiamiamo gli enzimi che degradano i loro substrati enzimi catabolici. Quelli che costruiscono molecole più complesse dai loro substrati sono enzimi anabolici e gli enzimi che influenzano la velocità di reazione sono enzimi catalitici. Nota che tutti gli enzimi aumentano la velocità di reazione e, pertanto, sono catalizzatori organici. Un esempio di enzima è l'amilasi salivare, che idrolizza il suo substrato amilosio, un componente dell'amido.
Gli ormoni sono molecole di segnalazione chimica, solitamente piccole proteine o steroidi, secrete dalle cellule endocrine che agiscono per controllare o regolare specifici processi fisiologici, tra cui crescita, sviluppo, metabolismo e riproduzione. Ad esempio, l'insulina è un ormone proteico che aiuta a regolare il livello di glucosio nel sangue. La Tabella sotto elenca i principali tipi e funzioni delle proteine.
Tipi e funzioni delle proteine
| Tipo | Esempi | Funzioni |
|---|---|---|
| Enzimi digestivi | Amilasi, lipasi, pepsina, tripsina | Aiutano nel cibo catabolizzando i nutrienti in unità monomeriche |
| Trasporto | Emoglobina, albumina | Trasportano sostanze nel sangue o nella linfa in tutto il corpo |
| Strutturale | Actina, tubulina, cheratina | Costruire diverse strutture, come il citoscheletro |
| Ormoni | Insulina, tiroxina | Coordinare l'attività dei diversi sistemi corporei |
| Difesa | Immunoglobuline | Proteggere il corpo da agenti patogeni estranei |
| Contrattile | Actina, miosina | Effetto contrazione muscolare |
| Riserva | Proteine di riserva dei legumi, albume d'uovo (albumina) | Fornire nutrimento nello sviluppo precoce dell'embrione e della piantina |
Le proteine hanno forme e pesi molecolari diversi. Alcune proteine hanno forma globulare, mentre altre sono di natura fibrosa. Ad esempio, l'emoglobina è una proteina globulare, ma il collagene, presente nella nostra pelle, è una proteina fibrosa. La forma della proteina è fondamentale per la sua funzione e molti tipi diversi di legami chimici mantengono questa forma. Cambiamenti di temperatura, pH ed esposizione a sostanze chimiche possono portare a cambiamenti permanenti nella forma della proteina, con conseguente perdita di funzione o denaturazione . Diverse disposizioni degli stessi 20 tipi di amminoacidi comprendono tutte le proteine. Due nuovi amminoacidi rari sono stati scoperti di recente (selenocisteina e pirrolisina) e altre nuove scoperte potrebbero essere aggiunte all'elenco.
Aminoacidi
[modifica | modifica sorgente]Gli amminoacidi sono i monomeri che compongono le proteine. Ogni amminoacido ha la stessa struttura fondamentale, che consiste in un atomo di carbonio centrale, o carbonio alfa ( α ), legato a un gruppo amminico (NH2 ), un gruppo carbossilico (COOH) e a un atomo di idrogeno. Ogni amminoacido ha anche un altro atomo o gruppo di atomi legato all'atomo centrale noto come gruppo R ( Figura sotto).

Si usa il nome "amminoacido" perché questi acidi contengono sia il gruppo amminico che il gruppo carbossilico-acido nella loro struttura di base. Come abbiamo detto, ci sono 20 amminoacidi comuni presenti nelle proteine. Nove di questi sono amminoacidi essenziali negli esseri umani perché il corpo umano non può produrli e li otteniamo dalla nostra dieta. Per ogni amminoacido, il gruppo R (o catena laterale) è diverso. Esistono 20 amminoacidi comuni comunemente presenti nelle proteine, ognuno con un diverso gruppo R (gruppo variante) che ne determina la natura chimica

La natura chimica della catena laterale determina la natura dell'amminoacido (ovvero, se è acido, basico, polare o apolare). Ad esempio, l'amminoacido glicina ha un atomo di idrogeno come gruppo R. Amminoacidi come valina, metionina e alanina sono di natura apolare o idrofobica, mentre amminoacidi come serina, treonina e cisteina sono polari e hanno catene laterali idrofile. Le catene laterali di lisina e arginina sono caricate positivamente e quindi questi amminoacidi sono anche amminoacidi basici. La prolina ha un gruppo R che è legato al gruppo amminico, formando una struttura ad anello. La prolina è un'eccezione alla struttura standard dell'amminoacido poiché il suo gruppo amminico non è separato dalla catena laterale.
Una singola lettera maiuscola o un'abbreviazione di tre lettere rappresentano gli amminoacidi. Ad esempio, la lettera V o il simbolo di tre lettere val rappresentano la valina. Proprio come alcuni acidi grassi sono essenziali per una dieta, anche alcuni amminoacidi sono necessari. Questi amminoacidi essenziali negli esseri umani includono isoleucina, leucina e cisteina. Gli amminoacidi essenziali si riferiscono a quelli necessari per costruire proteine nel corpo, ma non a quelli che il corpo produce. Quali amminoacidi siano essenziali varia da organismo a organismo.
La sequenza e il numero di amminoacidi determinano in ultima analisi la forma, la dimensione e la funzione della proteina. Un legame covalente, o legame peptidico , si lega a ciascun amminoacido, che si forma tramite una reazione di disidratazione. Il gruppo carbossilico di un amminoacido e il gruppo amminico dell'amminoacido in arrivo si combinano, rilasciando una molecola d'acqua. Il legame risultante è il legame peptidico.

I prodotti che tali legami formano sono peptidi. Man mano che più amminoacidi si uniscono a questa catena in crescita, la catena risultante è un polipeptide. Ogni polipeptide ha un gruppo amminico libero a un'estremità. Questa estremità è chiamata terminale N, o terminale amminico, e l'altra estremità ha un gruppo carbossilico libero, chiamato anche terminale C o carbossilico. Mentre i termini polipeptide e proteina sono talvolta usati in modo intercambiabile, un polipeptide è tecnicamente un polimero di amminoacidi, mentre il termine proteina è usato per un polipeptide o polipeptidi che si sono combinati insieme, spesso hanno gruppi prostetici non peptidici legati, hanno una forma distinta e hanno una funzione unica. Dopo la sintesi proteica (traduzione), la maggior parte delle proteine viene modificata. Queste sono note come modifiche post-traduzionali. Possono subire scissione, fosforilazione o possono richiedere l'aggiunta di altri gruppi chimici. Solo dopo queste modifiche la proteina è completamente funzionale.
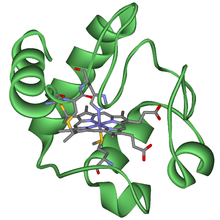
Il significato evolutivo del citocromo c
[modifica | modifica sorgente]Il citocromo c è un componente importante della catena di trasporto degli elettroni, una parte della respirazione cellulare, e si trova normalmente nell'organello cellulare, il mitocondrio. Questa proteina ha un gruppo prostetico eme, e lo ione centrale dell'eme si riduce e si ossida alternativamente durante il trasferimento degli elettroni. Poiché il ruolo di questa proteina essenziale nella produzione di energia cellulare è cruciale, è cambiata molto poco nel corso di milioni di anni. Il sequenziamento delle proteine ha dimostrato che esiste una notevole quantità di omologia di sequenza di amminoacidi del citocromo c tra specie diverse. In altre parole, possiamo valutare la parentela evolutiva misurando le somiglianze o le differenze tra le sequenze di DNA o proteine di varie specie.
Gli scienziati hanno determinato che il citocromo c umano contiene 104 amminoacidi. Per ogni molecola di citocromo c di organismi diversi che gli scienziati hanno sequenziato fino ad oggi, 37 di questi amminoacidi appaiono nella stessa posizione in tutti i campioni di citocromo c. Ciò indica che potrebbe esserci stato un antenato comune. Confrontando le sequenze proteiche umane e di scimpanzé, gli scienziati non hanno trovato una differenza di sequenza. Quando i ricercatori hanno confrontato le sequenze umane e di Macaco rhesus, l'unica differenza era in un amminoacido. In un altro confronto, il sequenziamento da umano a lievito mostra una differenza nella 44a posizione.
Struttura proteica
[modifica | modifica sorgente]Come abbiamo discusso in precedenza, la forma di una proteina è fondamentale per la sua funzione. Ad esempio, un enzima può legarsi a un substrato specifico in un sito attivo. Se questo sito attivo viene alterato a causa di cambiamenti locali o cambiamenti nella struttura proteica complessiva, l'enzima potrebbe non essere in grado di legarsi al substrato. Per capire come la proteina ottiene la sua forma o conformazione finale, dobbiamo comprendere i quattro livelli della struttura proteica: primaria, secondaria, terziaria e quaternaria.
Struttura primaria
[modifica | modifica sorgente]La sequenza unica degli amminoacidi in una catena polipeptidica è la sua struttura primaria . Ad esempio, l'ormone pancreatico insulina ha due catene polipeptidiche, A e B, e sono collegate tra loro da legami disolfuro. L'amminoacido N terminale della catena A è la glicina; mentre l'amminoacido C terminale è l'asparagina. Le sequenze di amminoacidi nelle catene A e B sono uniche per l'insulina.

Figura sopra. L'insulina sierica bovina è un ormone proteico composto da due catene peptidiche, A (lunga 21 aminoacidi) e B (lunga 30 aminoacidi). In ogni catena, le abbreviazioni di tre lettere che rappresentano i nomi degli aminoacidi nell'ordine in cui sono presenti indicano la struttura primaria. L'aminoacido cisteina (cys) ha un gruppo solfidrilico (SH) come catena laterale. Due gruppi solfidrilici possono reagire in presenza di ossigeno per formare un legame disolfuro (SS). Due legami disolfuro collegano le catene A e B insieme e un terzo aiuta la catena A a piegarsi nella forma corretta. Nota che tutti i legami disolfuro hanno la stessa lunghezza, ma li abbiamo disegnati in dimensioni diverse per chiarezza.
Il gene che codifica la proteina determina in ultima analisi la sequenza unica per ogni proteina. Un cambiamento nella sequenza nucleotidica della regione codificante del gene può portare all'aggiunta di un diverso amminoacido alla catena polipeptidica in crescita, causando un cambiamento nella struttura e nella funzione della proteina. Nell'anemia falciforme, la catena β dell'emoglobina (una piccola porzione della quale mostriamo nella Figura 3.26 ) ha una singola sostituzione di amminoacido, causando un cambiamento nella struttura e nella funzione della proteina. Nello specifico, la valina nella catena β sostituisce l'amminoacido glutammico. Ciò che è più notevole da considerare è che una molecola di emoglobina è composta da due catene alfa e due beta che sono ciascuna composta da circa 150 amminoacidi. La molecola, quindi, ha circa 600 amminoacidi. La differenza strutturale tra una molecola di emoglobina normale e una molecola di anemia falciforme, che riduce drasticamente l'aspettativa di vita, è un singolo amminoacido dei 600. Ciò che è ancora più notevole è che tre nucleotidi codificano ciascuno quei 600 amminoacidi e un singolo cambiamento di base (mutazione puntiforme), 1 su 1800 basi, causa la mutazione.


A causa di questo cambiamento di un amminoacido nella catena, le molecole di emoglobina formano lunghe fibre che distorcono i globuli rossi biconcavi, o a forma di disco, e fanno sì che assumano una forma a mezzaluna o "a falce", che ostruisce i vasi sanguigni ( Figura sopra). Ciò può portare a una miriade di gravi problemi di salute come mancanza di respiro, vertigini, mal di testa e dolori addominali per coloro che sono affetti da questa malattia. William Warrick Cardozo ha dimostrato che l'anemia falciforme è una malattia ereditaria, il che significa che la differenza nella regione di codifica del gene specifico viene trasmessa dai genitori ai figli. Come imparerai nell'unità di genetica, l'eredità di tali tratti è determinata da una combinazione di geni di entrambi i genitori e queste piccolissime differenze possono avere impatti significativi sugli organismi.
Esempio di rappresentazione di una struttura primaria della proteina C-FLIP (un inibitore cellulare). Ogni lettera rappresenta un tipo di amminoacido. La proteina c-FLIP è costituita da tre catene di aminoacidi:
| Stringa A | 0-KEQRLKEQLGAQQEPVKKSIQESEAFLPQSIPEERYKMKSKPLGICLIIDCIGNETELLRDTFTSLGYEV
70-QKFLHLSMHGISQILGQFACMPEHRDYDSFVCVLVSRGGSQSVYGVDQTHSGLPLHHIRRMFMGDSCPYL 140-AGKPKMFFIQNYVVSEGQLENSSLLEVDGPAMKNVEFKAQKRGLCTVHREADFFWSLCTADMSLLEQSHS 210-SPSLYLQCLSQKLRQERKRPLLDHIELDHYELNGYMYDWNSRVSAKEKYYVWLQHTLRKKLILSYT |
| Catena B | 0-SESQTLDKVYQMKSKPRGYCLIINNHNFAKAREKVPKLHSIRDRNGTHLDAGALTTTFEELHFEIKPHDD
70-CTVEQIYEILKIYQLMDHSNMDCFICCILSHGDKGIIYGTDGQEAPIYELTSQFTGLKCPSLAGKPKVFF 140-IQACQGDNYQKGIPVETASEEQPYLEMALSSPQTRYIPDEADFLLGMATVNNCVSYRNPAEGTWYIQSLC 210-QSLRERCPRGDDILTILTEVNYEVSNKDDKKNMGKQMPQPTFTLRKKLVFPSDVEHHHHHH |
| Stringa di C | 0-AIETX |
Struttura secondaria
[modifica | modifica sorgente]Il ripiegamento locale del polipeptide in alcune regioni dà origine alla struttura secondaria della proteina. Le più comuni sono le strutture a α -elica e a β -foglio pieghettato ( Figura sotto). Entrambe le strutture sono tenute in forma da legami a idrogeno. I legami a idrogeno si formano tra l'atomo di ossigeno nel gruppo carbonilico in un amminoacido e un altro amminoacido che si trova quattro amminoacidi più avanti lungo la catena.

Ogni giro elicoidale in un'elica alfa ha 3,6 residui di amminoacidi. I gruppi R del polipeptide (i gruppi varianti) sporgono dalla catena α -elica. Nel foglietto β -pieghettato, i legami idrogeno tra gli atomi sullo scheletro della catena polipeptidica formano le "pieghe". I gruppi R sono attaccati ai carboni e si estendono sopra e sotto le pieghe della piega. I segmenti pieghettati si allineano parallelamente o antiparalleli tra loro e si formano legami idrogeno tra l'atomo di idrogeno parzialmente positivo nel gruppo amminico e l'atomo di ossigeno parzialmente negativo nel gruppo carbonilico dello scheletro peptidico. Le strutture α -elica e β- pieghettato sono presenti nella maggior parte delle proteine globulari e fibrose e svolgono un importante ruolo strutturale.
Struttura terziaria
[modifica | modifica sorgente]La struttura tridimensionale unica del polipeptide è la sua struttura terziaria ( Figura sotto). Questa struttura è in parte dovuta alle interazioni chimiche che agiscono sulla catena polipeptidica. Principalmente, le interazioni tra i gruppi R creano la complessa struttura terziaria tridimensionale della proteina. La natura dei gruppi R negli amminoacidi coinvolti può contrastare la formazione dei legami idrogeno che abbiamo descritto per le strutture secondarie standard. Ad esempio, i gruppi R con cariche uguali si respingono e quelli con cariche diverse si attraggono (legami ionici). Quando avviene il ripiegamento proteico, i gruppi R idrofobici degli amminoacidi non polari si trovano all'interno della proteina; mentre i gruppi R idrofili si trovano all'esterno. Gli scienziati chiamano anche i primi tipi di interazione interazioni idrofobiche. L'interazione tra le catene laterali della cisteina forma legami disolfuro in presenza di ossigeno, l'unico legame covalente che si forma durante il ripiegamento proteico.

Tutte queste interazioni, deboli e forti, determinano la forma tridimensionale finale della proteina. Quando una proteina perde la sua forma tridimensionale, potrebbe non essere più funzionale.
Struttura quaternaria
[modifica | modifica sorgente]In natura, alcune proteine si formano da diversi polipeptidi, o subunità, e l'interazione di queste subunità forma la struttura quaternaria . Le interazioni deboli tra le subunità aiutano a stabilizzare la struttura complessiva. Ad esempio, l'insulina (una proteina globulare) ha una combinazione di legami idrogeno e disolfuro che la fanno aggregare principalmente in una forma sferica. L'insulina inizia come un singolo polipeptide e perde alcune sequenze interne in presenza di modificazioni post-traduzionali dopo aver formato i legami disolfuro che tengono insieme le catene rimanenti. La seta (una proteina fibrosa), tuttavia, ha una struttura a foglio β -pieghettato che è il risultato del legame idrogeno tra diverse catene.

La figura sopra illustra i quattro livelli della struttura proteica (primario, secondario, terziario e quaternario).
Denaturazione e ripiegamento delle proteine
[modifica | modifica sorgente]Ogni proteina ha la sua sequenza e forma uniche che le interazioni chimiche tengono insieme. Se la proteina è soggetta a cambiamenti di temperatura, pH o esposizione a sostanze chimiche, la struttura proteica può cambiare, perdendo la sua forma senza perdere la sua sequenza primaria in quella che gli scienziati chiamano denaturazione. La denaturazione è spesso reversibile perché la struttura primaria del polipeptide è conservata nel processo se l'agente denaturante viene rimosso, consentendo alla proteina di riprendere la sua funzione. A volte la denaturazione è irreversibile, portando alla perdita di funzione. Un esempio di denaturazione proteica irreversibile è la frittura di un uovo. La proteina albumina nell'albume liquido si denatura quando viene messa in una padella calda. Non tutte le proteine si denaturano ad alte temperature. Ad esempio, i batteri che sopravvivono nelle sorgenti termali hanno proteine che funzionano a temperature prossime all'ebollizione. Anche lo stomaco è molto acido, ha un pH basso e denatura le proteine come parte del processo di digestione; tuttavia, gli enzimi digestivi dello stomaco mantengono la loro attività in queste condizioni.
Il ripiegamento delle proteine è fondamentale per la sua funzione. In origine, gli scienziati pensavano che le proteine stesse fossero responsabili del processo di ripiegamento. Solo di recente i ricercatori hanno scoperto che spesso ricevono assistenza nel processo di ripiegamento da aiutanti proteici, o chaperoni (o chaperonine) che si associano alla proteina bersaglio durante il processo di ripiegamento. Agiscono impedendo l'aggregazione dei polipeptidi che compongono la struttura proteica completa e si dissociano dalla proteina una volta che la proteina bersaglio è ripiegata.
-
Struttura primaria di una proteina
-
I 4 livelli strutturali delle proteine. In questo caso si tratta della proteina PCNA che è di supporto alla DNA polimerasi.
-
Diagramma schematico del legame idrogeno antiparallelo del foglietto beta della proteina
-
Diagramma schematico del legame idrogeno parallelo del foglietto beta della proteina
-
Le strutture beta foglietto vengono schematizzate come delle fasce con la punta a freccia
-
Le strutture ad alfa elica vengono schematizzate come dei "riccioli"
-
Legami presenti nella struttura terziaria
-
La proteina C-FLIP, un esempio di proteina quaternaria
-
La proteina C-FLIP (inibitore cellulare)
-
vista 3d del complesso proteico c-FLIP con il centro attivo contrassegnato in giallo.
-
Struttura della proteina terziaria glucokinasi (un enzima)
Gli acidi nucleici
[modifica | modifica sorgente]Gli acidi nucleici sono le macromolecole più importanti per la continuità della vita. Portano il progetto genetico della cellula e le istruzioni per il suo funzionamento.
DNA e RNA
[modifica | modifica sorgente]I due principali tipi di acidi nucleici sono l'acido desossiribonucleico (DNA) e l'acido ribonucleico (RNA) . Il DNA è il materiale genetico di tutti gli organismi viventi, dai batteri unicellulari ai mammiferi multicellulari. Si trova nel nucleo degli eucarioti e negli organelli, nei cloroplasti e nei mitocondri. Nei procarioti, il DNA non è racchiuso in un involucro membranoso.
L'intero contenuto genetico della cellula è il suo genoma, e lo studio dei genomi è la genomica. Nelle cellule eucariotiche, ma non nei procarioti, il DNA forma un complesso con le proteine istoniche per formare la cromatina, la sostanza dei cromosomi eucariotici. Un cromosoma può contenere decine di migliaia di geni. Molti geni contengono le informazioni per creare prodotti proteici. Altri geni codificano per prodotti di RNA. Il DNA controlla tutte le attività cellulari attivando o disattivando i geni.
L'altro tipo di acido nucleico, l'RNA, è principalmente coinvolto nella sintesi proteica. Le molecole di DNA non lasciano mai il nucleo, ma utilizzano un intermediario per comunicare con il resto della cellula. Questo intermediario è l' RNA messaggero (mRNA) . Altri tipi di RNA, come rRNA, tRNA e microRNA, sono coinvolti nella sintesi proteica e nella sua regolazione.

Il DNA e l'RNA sono composti da monomeri che gli scienziati chiamano nucleotidi . I nucleotidi si combinano tra loro per formare un polinucleotide , DNA o RNA. Ogni nucleotide è composto da tre componenti: una base azotata, uno zucchero pentoso (a cinque atomi di carbonio) e un gruppo fosfato. Ogni base azotata in un nucleotide è legata a una molecola di zucchero, che è legata a uno o più gruppi fosfato.
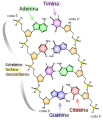
Le basi azotate, componenti importanti dei nucleotidi, sono molecole organiche e sono così chiamate perché contengono carbonio e azoto. Sono basi perché contengono un gruppo amminico che ha il potenziale di legare un idrogeno in più, e quindi diminuire la concentrazione di ioni idrogeno nel suo ambiente, rendendolo più basico. Ogni nucleotide nel DNA contiene una delle quattro possibili basi azotate: adenina (A), guanina (G), citosina (C) e timina (T).
Gli scienziati classificano l'adenina e la guanina come purine . La struttura primaria della purina è costituita da due anelli carbonio-azoto. Gli scienziati classificano la citosina, la timina e l'uracile come pirimidine che hanno un singolo anello carbonio-azoto come struttura primaria. Ognuno di questi anelli base carbonio-azoto ha diversi gruppi funzionali ad esso collegati. In abbreviazione di biologia molecolare, conosciamo le basi azotate tramite i loro simboli A, T, G, C e U. Il DNA contiene A, T, G e C; mentre l'RNA contiene A, U, G e C.
Lo zucchero pentoso nel DNA è il desossiribosio, e nell'RNA, lo zucchero è il ribosio. La differenza tra gli zuccheri è la presenza del gruppo idrossile sul secondo carbonio del ribosio e dell'idrogeno sul secondo carbonio del desossiribosio. Gli atomi di carbonio della molecola di zucchero sono numerati come 1′, 2′, 3′, 4′ e 5′ (1′ si legge come "un primo"). Il residuo di fosfato si lega al gruppo idrossile del carbonio 5′ di uno zucchero e al gruppo idrossile del carbonio 3′ dello zucchero del nucleotide successivo, che forma un legame fosfodiesterico 5′–3′ . Una semplice reazione di disidratazione come gli altri legami che collegano i monomeri nelle macromolecole non forma il legame fosfodiesterico. La sua formazione comporta la rimozione di due gruppi fosfato. Un polinucleotide può avere migliaia di tali legami fosfodiesterici.
Struttura a doppia elica del DNA
[modifica | modifica sorgente]Il DNA ha una struttura a doppia elica. Lo zucchero e il fosfato si trovano all'esterno dell'elica, formando la spina dorsale del DNA. Le basi azotate sono impilate all'interno, come una coppia di gradini di una scala. I legami idrogeno legano le coppie tra loro. Ogni coppia di basi nella doppia elica è separata dalla coppia di basi successiva di 0,34 nm. I due filamenti dell'elica corrono in direzioni opposte, il che significa che l'estremità di carbonio 5' di un filamento sarà rivolta verso l'estremità di carbonio 3' del suo filamento corrispondente. (Gli scienziati chiamano questo un orientamento antiparallelo ed è importante per la replicazione del DNA e in molte interazioni degli acidi nucleici.)
Sono consentiti solo alcuni tipi di appaiamento di basi. Ad esempio, una certa purina può appaiarsi solo con una certa pirimidina. Ciò significa che A può appaiarsi con T e G può appaiarsi con C, come mostra la Figura sotto. Questa è la regola della complementarietà delle basi. In altre parole, i filamenti di DNA sono complementari tra loro. Se la sequenza di un filamento è AATTGGCC, il filamento complementare avrebbe la sequenza TTAACCGG. Durante la replicazione del DNA, ogni filamento copia se stesso, con conseguente doppia elica del DNA figlio contenente un filamento di DNA parentale e un filamento appena sintetizzato.
-
Struttura del DNA
-
Schema del DNA
-
Lo scheletro fosfatico (indicato dalle linee curve) è all'esterno e le basi sono all'interno. Ogni base di un filamento interagisce tramite legame idrogeno con una base del filamento opposto.
-
DNA, i legami a idrogeno tra i due filamenti
RNA
[modifica | modifica sorgente]L'acido ribonucleico, o RNA, è principalmente coinvolto nel processo di sintesi proteica sotto la direzione del DNA. L'RNA è solitamente a singolo filamento ed è composto da ribonucleotidi che sono collegati da legami fosfodiesterici. Un ribonucleotide nella catena di RNA contiene ribosio (lo zucchero pentoso), una delle quattro basi azotate (A, U, G e C) e il gruppo fosfato.
Esistono quattro tipi principali di RNA: RNA messaggero (mRNA), RNA ribosomiale (rRNA), RNA di trasferimento (tRNA) e microRNA (miRNA). Il primo, l'mRNA, trasporta il messaggio dal DNA, che controlla tutte le attività cellulari in una cellula. Se una cellula richiede la sintesi di una certa proteina, il gene per questo prodotto si "accende" e l'RNA messaggero si sintetizza nel nucleo. La sequenza di basi dell'RNA è complementare alla sequenza codificante del DNA da cui è stata copiata. Tuttavia, nell'RNA, la base T è assente e al suo posto è presente U. Se il filamento di DNA ha una sequenza AATTGCGC, la sequenza dell'RNA complementare è UUAACGCG. Nel citoplasma, l'mRNA interagisce con i ribosomi e altri macchinari cellulari per la sintesi proteica ( vedi disegni nella galleria sotto ).
-
Struttura generica del RNA
-
Struttura di un generico ribonucleotide
-
L'RNA ha un ruolo importante nella formazione delle proteine (sintesi proteica)
-
L'RNA messaggero
-
L'RNA ribosomiale forma, assieme a proteine, la struttura dei ribosomi
-
Subunità grande del ribosoma di un archeobatterio. In blu le proteine, in giallo e rosa i due RNA
-
Subunità piccola del ribosoma dell'eubatterio Thermus thermophilus. In blu le proteine, in rosa l'RNA
-
confronto di rRNA di vari organismi
-
L'RNA di trasporto trasporta amminoacidi ai ribosomi
-
Struttura un po' più dettagliata del tRNA
-
Il micro-RNA ha una funzione di regolazione
Un ribosoma ha due parti: una subunità grande (in verde chiaro nella terza figura della galleria) e una subunità piccola (in verde scuro). L'mRNA si infila tra le due subunità. Le molecole di tRNA trasportano il corretto amminoacido da aggiungere alla catena polipeptidica in formazione.
L'mRNA viene letto in serie di tre basi note come codoni. Ogni codone codifica per un singolo amminoacido. In questo modo, l'mRNA viene letto e viene prodotto il prodotto proteico. L'RNA ribosomiale (rRNA) è un costituente principale dei ribosomi su cui si lega l'mRNA. L'rRNA assicura il corretto allineamento dell'mRNA e dei ribosomi. L'rRNA del ribosoma ha anche un'attività enzimatica (peptidil transferasi) e catalizza la formazione del legame peptidico tra due amminoacidi allineati. L'RNA di trasferimento (tRNA) è uno dei più piccoli dei quattro tipi di RNA, solitamente lungo 70-90 nucleotidi. Trasporta l'amminoacido corretto al sito di sintesi proteica. È l'appaiamento di basi tra tRNA e mRNA che consente all'amminoacido corretto di inserirsi nella catena polipeptidica. I microRNA sono le molecole di RNA più piccole e il loro ruolo comporta la regolazione dell'espressione genica interferendo con l'espressione di determinati messaggi di mRNA. La tabella seguente riassume le caratteristiche del DNA e dell'RNA.
Caratteristiche del DNA e dell'RNA
| Il DNA | RNA | |
|---|---|---|
| Funzione | Trasporta informazioni genetiche | Coinvolto nella sintesi proteica |
| Posizione | Rimane nel nucleo | Lascia il nucleo |
| Struttura | Doppia elica | Solitamente a filamento singolo |
| Zucchero | Deossiribosio | Ribosio |
| Pirimidine | Citosina, timina | Citosina, uracile |
| Purine | Adenina, guanina | Adenina, guanina |
Sebbene l'RNA sia a filamento singolo, la maggior parte dei tipi di RNA mostra un esteso appaiamento di basi intramolecolari tra sequenze complementari, creando una struttura tridimensionale prevedibile, essenziale per la loro funzione.
Come hai imparato, il flusso di informazioni in un organismo avviene dal DNA all'RNA alle proteine. Il DNA detta la struttura dell'mRNA in un processo che gli scienziati chiamano trascrizione , e l'RNA detta la struttura della proteina in un processo che gli scienziati chiamano traduzione . Questo è il dogma centrale della vita, che vale per tutti gli organismi; tuttavia, si verificano eccezioni alla regola in relazione alle infezioni virali.
L'ATP
[modifica | modifica sorgente]Un altro tipo di acido nucleico presente nella cellula è l'ATP.

L'adenosina trifosfato ( ATP ) è una sostanza chimica . Tutti gli esseri viventi producono ATP per immagazzinare energia e trasportarla alle cellule che ne hanno bisogno. Le cellule ricavano tutta la loro energia dall'ATP. Rompono le molecole di ATP, staccando i gruppi fosfati, per utilizzare l'energia immagazzinata. Più duramente lavora una cellula, più ATP ha bisogno. La molecola di ATP è molto versatile: viene utilizzata per molte reazioni chimiche nel corpo. L'energia è immagazzinata nei suoi legami chimici. L'energia immagazzinata può essere utilizzata in seguito. Quando l'ATP rompe un legame con un gruppo fosfato e diventa ADP , l'energia viene rilasciata. Questa è una reazione esotermica. Lo scambio di ATP-fosfato è un ciclo quasi infinito, che si interrompe solo quando la cellula muore.
L'ATP è la principale fonte di energia per la maggior parte delle funzioni cellulari. Ciò include la sintesi di macromolecole. È utilizzato nel DNA e nell'RNA . L'ATP aiuta anche le macromolecole ad attraversare le membrane cellulari. Un adulto umano medio ne produce circa 50 chilogrammi al giorno.
-
Il ciclo di scarica e ricarica dell'ATP
Attività
[modifica | modifica sorgente]Laboratorioː fare il sapone
Laboratorioː fare il sapone schiumoso