Chimica per il liceo/L'acqua

Importanza dell'acqua
[modifica | modifica sorgente]Provate a guardarvi attorno, ed è molto probabile che in tutto ciò che osservate c'entri in qualche modo l’acqua. Consideriamo ad esempio il caso di Mario che si trova nella sua stanza per svolgere i compiti pomeridiani. La sedia su cui è seduto è una comoda poltrona costituita da fibre sintetiche e materiali plastici rigidi. Ebbene nei processi industriali per la produzione delle materie plastiche l’acqua e le sue soluzioni sono molto utilizzate.

Il tavolo è in legno, il legno è un prodotto biologico ottenuto naturalmente attraverso una serie di reazioni chimiche, la prima fondamentale è la fotosintesi clorofilliana, reazione in cui l’acqua è uno dei reagenti. I muri della stanza sono in calcestruzzo, rivestiti di intonaco bianco. Il calcestruzzo è un miscuglio di: cemento, materiali inerti (sabbia o ghiaia) e acqua. Per l’intonaco il discorso è molto simile. Per il pc posto sopra il tavolo (e in generale per qualsiasi pc) è stato stimato che la produzione e l’imballaggio dei singoli componenti richiedono 1500 litri d’acqua. L’elenco potrebbe continuare, fatelo per esercizio. Qui concludiamo con la cosa più importante: l’esistenza stessa di Mario (e di tutti noi). Nell’uomo la percentuale in peso di acqua varia tra il 50% e l’80% a seconda dell’età e del sesso.


Cerchiamo dunque di conoscere un po’ meglio questa sostanza. È composta da una semplice molecola: H2O, ovvero due atomi di idrogeno legati chimicamente a un atomo di ossigeno. Con ciò che abbiamo capito nei precedenti capitoli siamo in grado di determinare il peso molecolare. Conoscendo il peso molecolare possiamo svolgere dei calcoli interessanti per esempio sapere quante molecole ci siamo appena bevuti svuotando un bicchiere da 0,2 l. Provateci, dovreste ottenere un numero vicino alle molecole. Questo calcolo permette inoltre di farsi un’idea delle dimensioni estremamente ridotte (rispetto alla scala umana) della molecola.
Nonostante l’acqua ci sia molto familiare ancora non è chiaro il motivo per cui il nostro pianeta ne sia così ricco. Grazie a tecnologie di rilevamento sempre più sofisticate si è potuto però constatare la presenza di acqua in vari contesti spaziali. Per esempio l’acqua è presente nell’atmosfera di alcuni pianeti del sistema solare. Oppure in certe regioni delle nebulose planetarie.
Non sappiamo come sia arrivata sulla Terra, ma sappiamo com' è fatta la molecola.
La struttura chimica
[modifica | modifica sorgente]Ma perché l’ossigeno si lega con l’idrogeno?
Se avete studiato il capitolo 8, di questo libro, allora risponderete più o meno in questo modo: per raggiungere una configurazione elettronica con una stabilità maggiore l’ossigeno tende ad acquisire due elettroni, l’idrogeno ne dispone solo di uno quindi il legame si forma tra un atomo di ossigeno e due atomi di idrogeno.

E’ un legame di tipo covalente polare che dà vita di conseguenza a una molecola con una polarità elettrica, la carica è positiva in prossimità degli atomi di idrogeno e negativa in prossimità dell’atomo di ossigeno. Se la risposta non vi è chiara allora ritornate al capitolo 8. Altrimenti possiamo porci un'altra domanda:
Perché la molecola ha questa geometria?
Ciò sostanzialmente porta a chiedersi perché l’angolo al vertice dell’ossigeno è pari a 104,5°?
Ebbene questo angolo corrisponde alla configurazione di maggior stabilità energetica della molecola, è determinato dall’equilibrio repulsivo tra gli elettroni dell’atomo di ossigeno. La situazione non è simmetrica perché due dei sei elettroni di valenza sono impegnati nel legame covalente polare mentre gli altri sono liberi.

Scoprirai nei prossimi anni, proseguendo con lo studio della chimica che esiste una teoria che consente di determinare la geometria delle molecole sulla base dei legami tra i suoi atomi costituenti è la teoria VSEPR (teoria della repulsione delle coppie elettroniche del guscio di valenza).
Concentriamoci ora sulla polarità della molecola. Nella figura a sinistra potete vedere ciò che tende ad accadere quando un certo numero di molecole vengono a contatto. In accordo con le leggi dell'elettromagnetismo, accade che le polarità opposte si attraggono.
La staticità che l’immagine comunica non deve ingannare, le molecole sono in continuo movimento. Il legame, evidenziato con il tratteggio, è il legame a idrogeno. Quest’ultimo è molto più debole del legame covalente tra gli atomi in rapporto a questo infatti la sua intensità è solo del 5%.
Esso però è fondamentale ed alla base delle ragioni che conferiscono all’acqua una serie di proprietà straordinarie che ora andremo a scoprire.


Le proprietà chimico-fisiche dell’acqua sono riconducibili, in primo luogo, alle caratteristiche dell’atomo di ossigeno. L’acqua ha formula H2O e questo significa che la molecola (insieme strutturato di più atomi, dello stesso elemento o di più elementi, legati tra loro da legami covalenti) è composta da due atomi di idrogeno e uno di ossigeno. Consultando la Tavola Periodica, potete rendervi conto che H è il primo elemento e O il sesto del secondo periodo: H, insieme a He costituisce il primo periodo ma, verosimilmente, non appartiene al primo gruppo che è costituito dai metalli alcalini; O è il capostipite del sesto gruppo, ha numero atomico 8 ed è un atomo con una versatile struttura elettronica (organizzazione matematica degli elettroni intorno al nucleo), 1s22s22p4. I numeri indicano il livello energetico crescente: il numero cresce al crescere della distanza dal nucleo; le lettere (s e p, per il momento) “scandiscono” il livello energetico. Il livello energetico 1 è caratterizzato da un sol tipo di orbitale (spazio tridimensionale con una forma che si ripete identica a ogni livello e un contenuto energetico direttamente proporzionale alla distanza dal nucleo, naturalmente: tutti gli orbitali vengono determinati al massimo da due elettroni). Al livello energetico 2, all’orbitale di tipo s, si aggiunge il tipo p. Se l’orbitale s è unico, l’orbitale p è triplice: questo assetto, ovviamente, si ripete a tutti i successivi livelli energetici. Come descritto nel riquadro di seguito riportato, l’atomo di ossigeno si predispone alla formazione della molecola dell’acqua con un riarrangiamento della sua struttura elettronica che prende il nome di ibridizzazione o, più semplicemente, ibridazione.
L’ibridazione degli orbitali del secondo livello energetico, non comporta alcun aumento della valenza dell’ossigeno (O forma due legami chimici) ma consente uno straordinario risultato: i doppietti elettronici, non condivisibili per la formazione di legami covalenti, vengono a trovarsi in orbitali ibridi sullo stesso piano energetico. L’ossigeno, quindi, assume una configurazione che lo rende perfettamente predisposto a “gestire” la formazione della molecola d’acqua, nell’ambito della quale svolge il ruolo di elemento aggregante, e diventa determinante anche nella formazione di legami tra molecole (legami intermolecolari).
Gli elettroni spaiati sono quelli utilizzati per la formazione dei legami covalenti, quelli accoppiati nello stesso orbitale (gli orbitali vengono schematicamente rappresentati con piccoli riquadri, detti caselle) al livello energetico 2, vengono impiegati per la formazione dei legami a idrogeno.
L’atomo di ossigeno di ogni molecola di acqua forma due legami covalenti con due atomi di idrogeno (così da costituire la molecola) e due legami a idrogeno (legami intermolecolari, segmenti tratteggiati) con due atomi di idrogeno di due molecole di acqua. Questa “rete” caratterizza lo stato liquido dell’acqua (nell’intervallo di temperatura da 0°C a 100°C).

In virtù della presenza dei doppietti elettronici, l’atomo di ossigeno viene a essere depositario di una doppia parziale carica negativa (ẟ-). Quest’ultima rende l’ossigeno molto elettronegativo: ciò significa che riesce ad attirare con considerevole forza gli elettroni dei due atomi di idrogeno i quali restano un po’ sguarniti di carica negativa (ẟ+). La molecola dell’acqua ha una struttura tetraedrica. Il tetraedro è un solido geometrico costituito da quattro facce triangolari: se i triangoli sono tutti congruenti il tetraedro è regolare; la regolarità viene meno se i quattro triangoli non sono tutti congruenti: quest’ultima è la condizione della molecola d’acqua che, quindi, risulta essere un tetraedro irregolare. Come si evince dall’immagine, l’atomo di ossigeno si trova all’interno del tetraedro. A due dei quattro vertici sono posizionati i due atomi di idrogeno, ai rimanenti due vertici i due doppietti elettronici non condivisibili per la formazione di legami covalenti. I due doppietti si respingono poiché sono cariche negative: di conseguenza, l’angolo di legame tra l’ossigeno e i due atomi di idrogeno si restringe e, come è stato già detto, il tetraedro risulta irregolare.

I legami a idrogeno sono alla base delle sorprendenti proprietà chimico – fisiche dell’acqua. I legami a idrogeno sono abbastanza forti da giustificare l’alto punto di ebollizione dell’acqua, dal momento che solo a 100°C iniziano a rompersi copiosamente rendendo libere le unità molecolari e determinando il passaggio dallo stato liquido a quello gassoso. Nel ghiaccio le molecole di acqua sono tenute insieme (sempre da legami idrogeno) in una struttura a maglie esagonali non planari: le unità molecolari risultano, pertanto, più distanziate; il maggior distanziamento determina un aumento del volume della originaria massa d’acqua (se riempiamo completamente di acqua una bottiglia di plastica e la mettiamo in freezer, a congelamento avvenuto, verificheremo una deformazione del contenitore causata dall’aumento di volume) e, conseguentemente, un abbassamento della densità (infatti il ghiaccio galleggia sull’acqua!).
Le proprietà dell'acqua
[modifica | modifica sorgente]Esiste una lunga serie di fenomeni che avvengono costantemente davanti ai nostri occhi non banali da capire. Per esempio, come fanno gli alberi a far salire le soluzioni acquose fino alle foglie più alte senza una pompa? Perché l’acqua nel suo aspetto macroscopico tende a preferire la forma di una goccia? Perché se dobbiamo pulire qualcosa ci viene naturale pensare come prima opzione all'acqua? Perché i Gerridi (insetti acquatici) riescono a camminare sull'acqua? Queste e mille altre possibili domande trovano risposta analizzando le proprietà di questa sostanza, tenete presente però che non tutto è stato ancora scoperto, aspettiamoci sorprese in futuro.
L'adesione
[modifica | modifica sorgente]
Versate una piccola quantità d’acqua su qualsiasi superficie piana non assorbente. Quello che vedrete tenderà ad assomigliare a quanto vedete in una delle due figure accanto.

In entrambi i casi la massa d’acqua va a disporsi secondo una struttura continua concava (la curvatura del pelo d’acqua all’interfaccia con l’aria è rivolta verso il basso). Ciò che è rilevante osservare ai fini del nostro ragionamento è l’angolo di contatto tra superficie e pelo d’acqua.
Nel primo caso l’angolo è superiore a 90° nel secondo caso invece l'angolo è inferiore a 90°. Diremo quindi che la prima è una superficie idrofila la seconda idrofoba.
In ambito chimico l’aggettivo idrofilo si utilizza per indicare una certa attinenza a legarsi con l’acqua, idrofobo al contrario è utilizzato nei casi in cui si manifesta invece una repellenza all’acqua.
La proprietà che regola queste interazioni è l’adesione.
Per capire qualcosa in più sulle conseguenze di questa proprietà potrebbe venirvi l’idea di inclinare la superficie piana per osservare il comportamento della massa d’acqua in moto. E’ un'idea intelligente, mettetela in pratica. Anche in questo caso noterete una differenza di comportamento tra il caso idrofilo e quello idrofobo. Nel primo caso infatti rimarrà dell’acqua adesa alla superficie lungo il cammino seguito (la scia d'acqua). Nel secondo caso invece l’intera massa d’acqua procederà lungo il cammino compiendo un moto che tende ad essere di puro rotolamento (è il tipo di moto compiuto da una palla lungo un piano inclinato) quest’ultima affermazione è tanto più vera quanto più idrofoba è la superficie.
In questo modo state mettendo in risalto la diversa bagnabilità delle superfici. Le superfici idrorepellenti ad esempio sono costruite proprio per permettere all’acqua di scorrere velocemente evitando quindi che la superficie si bagni.
Per giustificare le osservazioni compiute dobbiamo ritenere esista una forza che lega l’acqua alle superfici idrofile. La forza in questione è di natura elettrostatica e si manifesta quando le molecole polari dell’acqua si trovano a contatto con molecole d’ altra natura ma anch'esse polari.
Più in generale, la proprietà dell’adesione è quindi una conseguenza della forza elettrostatica che si genera tra le molecole di due sostanze diverse.
Relativamente al caso precedente. Nel caso statico (acqua ferma) la maggior adesione si manifesta con un minor angolo di contatto; perché l’acqua attirata dalle molecole polari del materiale massimizza la superficie di contatto. Vale il contrario per la superficie idrofoba.
Nel caso dinamico (acqua in moto) l’azione dell’adesione trattiene un certo numero di molecole. Per essere precisi le molecole d’acqua trattenute sono tutte quelle per cui la forza elettrostatica che le lega alla superficie supera quella gravitazionale che tende a metterle in moto.
-
Una piccola goccia su una superficie molto idrofoba
-
Adesione della rugiada nell'equiseto
-
Goccia su tessuto idrorepellente
La coesione
[modifica | modifica sorgente]

Poniamoci nelle condizioni di un astronauta sulla stazione spaziale internazionale (ISS). In quel contesto ci troviamo in condizioni di microgravità. L’ acqua può dunque liberamente fluttuare nello spazio (ci liberiamo in questo modo degli effetti legati al contatto con superfici e quindi dell’ adesione).
Immaginiamo, in questa situazione, di avere una siringa piena d’acqua e di spingere lentamente l’acqua all’esterno. Noteremo allora come dalla punta della siringa si formi una bolla che via via aumenta di dimensione proporzionalmente alla quantità d’acqua espulsa. Un po' come quando sulla Terra gonfiamo un palloncino.
Per capire perché ciò accade dobbiamo ricordarci che esiste il legame a Idrogeno che lega tra loro le molecole d’acqua. In virtù di questo legame le molecole d’acqua sono spinte ad assumere la geometria tridimensionale che più le avvicina l’una con l’altra, limitando al minimo la superficie esposta all’aria. Tale geometria è la sfera. Questo solido tridimensionale ha infatti la proprietà di avere il rapporto superficie/volume più basso. Da qui la bolla dell’ esperimento. Nel caso terrestre la presenza della forza di gravità trasforma la sfera in quella che chiamiamo goccia.
La coesione è quindi una conseguenza della forza elettrostatica presente tra molecole della stessa sostanza, cioè dei legami a idrogeno.
La tensione superficiale
[modifica | modifica sorgente]Per comuni esperienze personali sappiamo prevedere con buona sicurezza se un oggetto depositato in acqua galleggerà oppure no.
Il principio di Archimede ci dice che un corpo galleggia se la sua densità è minore o uguale a quella del liquido in cui è immerso.

Prendiamo un bicchiere d’acqua riempiamolo fino al bordo e depositiamo delicatamente un ago d' acciaio. Osserverete l’ago rimanere in superficie.
La densità dell’acciaio è di circa 7500 quella dell’acqua circa 1000 dovrebbe andare immediatamente a fondo. Evidentemente ci sta sfuggendo qualcosa. Ciò che non stiamo considerando è la tensione superficiale.

Se ragioniamo a scala molecolare dobbiamo immaginare la superficie d’acqua nel nostro bicchiere come una sorta di rete in cui i nodi sono le molecole d’acqua, i nodi sono connessi l’uno all’altro dai legami a idrogeno. L’apparente stabilità di questa situazione non deve ingannare, ricordate che le molecole sono in continuo movimento, dovete quindi immaginare questa ipotetica rete in continua trasformazione. Nonostante la precarietà di questa struttura i ponti temporanei che il legame a idrogeno riesce a costruire sono sufficienti a resistere a piccole pressioni, come quella dell’ago o quella di insetti come i Gerridi.
Per questi insetti camminare sull’acqua è un po' come, per noi umani, camminare su uno dei quei materassi spessi presenti in palestra.
Le osservazioni compiute quindi non violano il principio di Archimede, questi corpi, sufficientemente leggeri, stanno in superficie non per galleggiamento ma per l’effetto della tensione superficiale.
Pertanto, una prima definizione di tensione superficiale può essere la seguente:
La tensione superficiale è la forza di coesione (legami a idrogeno) tra le molecole superficiali di un liquido.
E’ possibile però esprimersi in termini più rigorosi.
Immaginiamo di poter portare un certo numero di molecole d’acqua, dall’interno del bicchiere, alla superficie. Per svolgere questa operazione dobbiamo spendere energia, perché le molecole sono attratte verso l’interno. Applicando l’energia necessaria siamo dunque in grado di aumentare la superficie d’acqua esposta all’aria di una quantità proporzionale al numero di molecole trasferito. Per questa ragione la tensione superficiale è definibile anche come l’energia richiesta per aumentare l’area superficiale di un liquido.
Questa formulazione consente di assegnare una grandezza fisica alla tensione superficiale. [tabella con valori]
la determinazione sperimentale dei valori avviene con dei metodi molto più pratici rispetto alla costruzione teorica esposta nelle righe precedenti. Nella prossima sezione capiremo che cos’è la capillarità e come questo fenomeno può aiutarci a determinare la tensione superficiale di un liquido.
La capillarità
[modifica | modifica sorgente]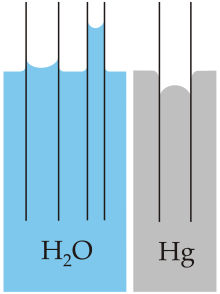
Un effetto notevole di grande importanza nella natura è quello della capillarità. Capillarità è un termine generico utilizzato per descrivere diversi fenomeni che dipendono dalla combinazione di forze di adesione e di coesione.
Il termine capillare è utilizzato con vari significati, quello che a noi interessa, in questo caso, è il seguente: “Simile a un capello, della dimensione di un capello sottilissimo”.
Capiamo quindi dall’analisi dei termini che quanto stiamo per scoprire deve legare in qualche modo le forze di coesione e adesione con le dimensioni ridotte.

Proviamo dunque ad applicare quello che abbiamo scoperto precedentemente in spazi molto piccoli.
Immergiamo ad esempio un tubicino aperto dal diametro molto piccolo in acqua. Quanto piccolo? Probabilmente il tubicino più sottile che avete in casa è quello che contiene l’inchiostro nella vostra penna biro. Provate con quello.
Ciò che osserviamo non ci sorprende, il fatto che ci sia dell’acqua confinata in un piccolo spazio all’interno del tubo pare non introdurre nessuna novità.
Il sospetto è che il diametro non sia piccolo abbastanza. Quello da noi utilizzato è di circa 3 mm se ripetiamo l’esperimento con un diametro di 1 mm allora osserveremo un effetto piuttosto curioso.
Si tratta della risalita capillare. L’acqua all’interno del tubicino risale ad un’altezza superiore rispetto al livello esterno. Detto questo nascono due domande:
- Perché l’acqua risale?
- Perché solo se il diametro è abbastanza piccolo?
Le risposte sono collegate. L’acqua risale se è presente una forza in grado di opporsi alla forza di gravità. Le molecole adese alla superficie del tubicino risentono dell'attrazione elettrostatica che le spinge ad avanzare verso l'alto. Sappiamo però che esistono anche le forze di coesione. Le molecole a contatto con le pareti tendono quindi ad alzarsi “trainando” per coesione tutte le molecole che stanno verso il centro.
A questo punto interviene la geometria: facciamo il rapporto tra area e perimetro di una circonferenza.
- ,
Scopriamo che all’aumentare del raggio il rapporto tra area e perimetro aumenta, tradotto nel nostro problema specifico significa che aumentando il raggio del tubicino il rapporto tra molecole a contatto con la parete (perimetro) rispetto a tutte le altre (area) diminuisce. Le relativamente poche molecole che avanzano per adesione devono quindi “trainare” le molte molecole per coesione. Questa situazione ha un limite ed è per questo che la risalita avviene solo se il raggio è abbastanza piccolo.
Esiste una formula che permette di quantificare la risalita capillare. Chi è interessato può continuare nell'approfondimento.
Legge di Jurin:
dove:
- è la tensione superficiale ( o );
- è l'angolo di contatto tra la superficie del liquido e la parete del contenitore;
- è la densità del liquido ;
- è l'accelerazione di gravità ;
- è il raggio del capillare ;
- è la variazione di quota del liquido nel capillare rispetto a quello del liquido nel recipiente esterno .
Densità
[modifica | modifica sorgente]La densità è definita come il rapporto tra la massa e il volume di un corpo.

Per abitudine tendiamo ad attribuire a ciascun materiale una sua propria densità caratteristica. Per l’acqua, ad esempio, si assume comunemente il valore di 1000 . In realtà questo valore è corretto solo per l’acqua pura alla temperatura di 20 °C e alla pressione di 5 MPa, cioè circa 49 volte la pressione atmosferica standard. Questo valore è dunque una comoda approssimazione utile a semplificare i conti.
La densità della materia dipende dagli atomi o molecole che la compongono e dalla disposizione di questi nello spazio. Pressione e temperatura influiscono su tale disposizione. Conseguentemente la densità di un materiale (sostanza o composto) dipende dalla pressione alla quale è confinato e dallo stato di agitazione delle particelle che lo compongono, ovvero dalla sua temperatura.
Nel caso dell'acqua distillata possiamo osservare ciò che accade analizzando il grafico proposto a destra.
Il grafico mostra l'andamento della densità in funzione della temperatura alla pressione standard di 1 atm.
Si può notare come l'abbassamento di temperatura comporti un incremento della densità. Questo incremento raggiunge il culmine alla temperatura di 4 °C. Questa è la temperatura corrispondente alla maggior densità per l'acqua, il valore è pari a 999,97 .
Sotto i 4 °C la densità diminuisce, a 0 °C (prima del congelamento) è pari a 999,84 .
L'acqua congelata ha invece una densità pari a 916,8
Questo andamento è caratteristico dell'acqua; tipicamente le sostanze presentano un incremento della densità con l'abbassamento della temperatura. Inoltre allo stato solido risultano avere una densità maggiore rispetto allo stato liquido.
L'acqua presenta quindi un comportamento anomalo. Perché?

La risposta è complessa in quanto conseguenza di diversi fattori. Giocano un ruolo fondamentale la forma della molecola e l'intensità dei legami a Idrogeno. Senza voler essere troppo precisi, si può dire che alla temperatura di 4 °C l'energia posseduta dalle molecole è sufficiente a farle avvicinare ma ancora insufficiente per far si che i legami a idrogeno riescano a sviluppare le strutture esagonali
A temperature inferiori, quindi a energie inferiori, l'azione del legame a idrogeno diventa via via più incisiva consentendo la disposizione nelle strutture esagonali. Strutture che che si stabilizzano al passaggio allo stato solido.
A parità di molecole la disposizione esagonale delle stesse occupa un volume maggiore. Conseguentemente la densità diminuisce.
Il lago ghiacciato: Considerate a titolo di esempio un lago alpino ricco di biodiversità. Con l'arrivo dell’inverno il calore accumulato nel periodo estivo dal lago si disperde nell’ambiente. Conseguentemente la temperatura superficiale dell’acqua inizia a diminuire (dalla superficie perché direttamente a contatto con l’aria). Dopo un po' di tempo l'acqua raggiunge i 4°C e sprofonda perché presenta la densità massima. Al suo posto risale acqua più calda dalle profondità. Gli scambi continuano fino a quando tutta la massa d’acqua raggiunge i 4°C. A questo punto in superficie la temperatura scende sotto i 4 °C, l’acqua non sprofonda più perché ha raggiunto la minor densità. Ipotizzando che la temperatura dell’ambiente continui ad essere inferiore a quella dell’acqua, si arriverà al punto in cui l’acqua ghiaccia. Il ghiaccio rimane in superficie perché meno denso. A questo punto lo strato ghiacciato funge da isolante termico, limitando la dispersione del calore. L’acqua liquida rimasta sotto lo spessore di ghiaccio riesce quindi a mantenere la temperatura intorno ai 4 °C. In questo modo gli organismi possono vivere. Naturalmente questo processo diventa rilevante per tutta la vita nelle aree fredde del pianeta, ma siccome nella storia della Terra si sono ripetute diverse glaciazioni, capite che se siamo qui oggi a leggere queste righe lo dobbiamo anche a questo comportamento anomalo dell’acqua.
Calore specifico
[modifica | modifica sorgente]Il calore specifico è definito come la quantità di calore assorbita o ceduta da una sostanza quando la sua temperatura varia di 1°C.

Nel caso dell’acqua il calore specifico è pari a . Questa è l’energia da fornire a 1 kg di acqua distillata per aumentare di un grado la sua temperatura. Nel verso opposto è la quantità di energia che 1 kg d’acqua libera quando la sua temperatura diminuisce di un grado. Come si è arrivati a questo valore? Nella figura a destra potete vedere un apparato sperimentale simile a quello adottato da Joule, si tratta di un rudimentale calorimetro. Osservando come è costruito; si può capire molto di ciò che intendeva fare il fisico inglese. Intuì che ci dovesse essere una relazione tra l’energia meccanica e il calore. L’azione manuale mette in rotazione le palette, le quali per attrito viscoso trasmettono il moto alle molecole d’acqua. L’effetto macroscopico è un aumento della temperatura della massa d’acqua dovuto ad un aumento dell'energia delle singole molecole.
Il valore corrisponde a 1 kilocaloria simbolo kcal l’unità di misura è utilizzata soprattutto in ambito nutrizionale. Trovate infatti la resa energetica dell’alimento scritto nella confezione. Per esempio in una barretta di cioccolata è riportato il valore di 539 Kcal per 100 g di prodotto. Questo significa che i processi metabolici nel nostro organismo sono in grado di ottenere quel quantitativo energetico dalla combustione di quell'alimento. In riferimento all’acqua è sufficiente l’equivalente energetico fornito da 1g di cioccolato per innalzare la temperatura di 1L di acqua di circa 5 °C.
Il calore specifico dell'acqua risulta essere molto elevato, nella tabella sottostante potete confrontarlo con quello di altre sostanze.
Per chi vuole rendersi conto dell'elevato calore specifico dell'acqua consiglio l'approfondimento sottostante.
Legge fondamentale della termologia:
- .
dove:
- è il calore ;
- è la massa ;
- è il calore specifico ;
- è la variazione di temperatura .
Questa relazione ci permette di capire alcune cose interessanti, ad esempio questa: Avrete certamente notato, camminando in qualche spiaggia, come nelle calde e serene giornate estive la sabbia raggiunga temperature tali da scottarci i piedi. Al contrario l'acqua rimane ad una temperatura decisamente inferiore. Conoscendo i rispettivi calori specifici possiamo cercare di rendere oggettiva questa differenza. Consideriamo una tonnellata di acqua e un altrettanta quantità di sabbia alla stessa temperatura. Per la sabbia possiamo assumere il calore specifico pari a ; Applicando la legge fondamentale della termologia è possibile determinare quanta energia serve per aumentare di un grado la temperatura di entrambe le sostanze. Per l'acqua il calcolo è il seguente: Per la sabbia il calcolo è il seguente: Questo significa che per innalzare di un grado la temperatura di una tonnellata di sabbia serve circa 1/5 dell'energia che serve per una pari quantità d'acqua. Detto in altri termini lo stesso quantitativo di energia (per esempio fornita dal sole) innalza la temperatura della sabbia circa cinque volte in più rispetto all'acqua.
Valori numerici del calore specifico:
| Sostanza | Stato fisico | Calore specifico: J/(kg·K) | Sostanza | Stato fisico | Calore specifico: J/(kg·K) |
|---|---|---|---|---|---|
| Alluminio | solido | 880 | Litio | solido | 3582 |
| Acciaio inox | solido | 502 | Mercurio]] | liquido | 139 |
| Acqua | liquido | 4186 | Olio | liquido | ~ 2000 |
| Acqua Ghiaccio | solido | 2090 | Ossigeno | gassoso | 920 |
| Anidride carbonica | gassoso | 838 | Oro | solido | 129 |
| Aria (secca) | gassoso | 1005 | Ottone (lega) | solido | 377 |
| Aria (100% umidità relativa) | gassoso | ~ 1030 | Piombo | solido | 130 |
| Azoto | gassoso | 1042 | Polistirene | solido | 1450 |
| Berillio | solido | 1824 | Rame | solido | 385 |
| Diamante | solido | 502 | Silice (fuso) | liquido | 703 |
| Elio | gassoso | 5190 | Silice | solido | 2020 |
| Etanolo | liquido | 2460 | Stagno (elemento chimico) | solido | 228 |
| Ferro | solido | 460 | Zinco | solido | 388 |
| Glicerina | liquido | 2260 | Idrogeno | gassoso | 14435 |
| Grafite | solido | 720 | |||
| Zinco | solido | 388 | Zinco | solido | 388 |
Potere solvente
[modifica | modifica sorgente]
Quando diciamo di bere un tè, un caffè o un succo di frutta o qualsiasi altra cosa non dobbiamo dimenticare che stiamo bevendo soprattutto acqua. Ciò che beviamo è dunque una soluzione acquosa in cui il solvente (l'acqua) è in quantità predominanti sul soluto. L'acqua dunque, oltre alle già discusse proprietà, è dotata di un elevato potere solvente ovvero ha la capacità di dissociare (sciogliere) i composti ionici e le molecole polari.
Vediamo come ciò avviene:
Fase 1: Idratazione
Le molecole d'acqua vengono attirate dalle polarità elettriche presenti nei composti ionici o molecolari del soluto. In risposta a questa forza di natura elettrica le molecole d'acqua vanno a disporsi circondando la molecola o il composto ionico in soluzione.
Fase 2: Dissociazione ionica
La molecola polare o il composto ionico si dissociano nei loro ioni costituenti disperdendosi nella soluzione acquosa.
Esempi:
HCl(g)→ H+(aq)+ Cl-(aq)
NaOH(s) → Na+(aq)+ OH-(aq)
Gli ioni dispersi nella soluzione acquosa sono chiamati elettroliti. Sono elettroliti forti quei composti che si dissociano completamente in acqua. Sono invece elettroliti deboli quelli che si dissociano parzialmente. Esempi:
Ba(OH)2(aq) → Ba2+(aq) + 2OH- (aq) elettrolita forte
CaF2(aq) → Ca2+(aq) + 2F-(aq) elettrolita forte
H2CO3(aq) → 2H+(aq) + CO2-3(aq) elettrolita debole
Fe(OH)3(aq) → Fe3+(aq) + 3OH-(aq) elettrolita debole
Praticamente tutti i composti ionici sono elettroliti forti (sali solubili; basi solubili dei metalli alcalini e di alcuni metalli alcalino terrosi) a questi si aggiungono gli acidi inorganici fortemente polarizzati. Mentre la maggior parte dei composti molecolari sono elettroliti deboli o non elettroliti (basi poco solubili dei metalli di transizione; molti acidi inorganici; basi organiche; acidi organici)
Una delle conseguenze di questa dispersione ionica all'interno delle soluzioni acquose è la capacità di conduzione dell'elettricità. L'applicazione di una differenza di potenziale infatti mette in moto e ordina gli ioni dispersi consentendo la conduzione elettrica.
L'acqua distillata quindi non conduce l'elettricità a meno di debolissime correnti dovute all'autoionizzazione delle molecole d'acqua.
In soluzione acquosa avvengono la grande maggioranza delle reazioni che accadono nel nostro pianeta, sia per quanto riguarda la parte inorganica che quella organica. Proseguendo con lo studio della chimica ti occuperai delle reazioni di precipitazione e delle reazioni di ossidoriduzione (o redox). Mentre ora, introduciamo, partendo dalle soluzioni acquose, il concetto di acidità e basicità. Per chi invece vuol sapere perché acqua e sapore hanno un potere pulente c'è l'approfondimento sottostante.


I tensioattivi sono sostanze in gradi di abbassare la tensione superficiale di un liquido. Tra le conseguenze di questo fatto c'è anche l'aumento del potere detergente. Nel caso di una soluzione acquosa l'aggiunta del sapone aumenta il potere pulente della soluzione, vediamo perché. Un sapone comune è costituito da una molecola composta da due parti fondamentali: "una coda" polare e una "testa" apolare. Questo significa che le teste di queste molecole sono solubili in acqua mentre le code sono solubili nei composti apolari (ad esempio il grasso). Dunque, quando le molecole di sapone vengono a contatto con il grasso si orientano disponendosi con la testa (idrofila) in acqua e la coda (idrofoba) "immersa" nel grasso.
Le code idrofobe tendono a sciogliersi nel grasso favorendone la dispersione nella soluzione acquosa. Le teste polari delle molecole, cariche negativamente tendono a respingersi reciprocamente negando alle particelle di grasso la possibilità di riaggregarsi. La combinazione di queste due azioni ne determina la definitiva dispersione nella soluzione acquosa.Soluzioni acquose acide e basiche
[modifica | modifica sorgente]

| Sostanza | pH |
|---|---|
| Acido cloridrico 1 M | 0 |
| Succo gastrico | 1,0 – 2,0 |
| Coca Cola e succo di Limone (agrume)|limone | 2,5 |
| Aceto | 2,9 |
| Succo di arancia | 3,7 |
| Birra | 4,5 |
| Pioggia acida | 4,5 - 4,8 |
| Caffè | 5,0 |
| Tè e pelle sana | 5,5 |
| Acqua deionizzata a 25 | 5,5 - 6,0 |
| Acqua ossigenata | 6,2 |
| Latte ben conservato | 6,5 - 6,7 |
| Acqua distillata a 25 | 7,0 |
| Saliva umana normale | 6,5 – 7,5 |
| Sangue | 7,35 - 7,45 |
| Acqua di piscina regolare | 7,2 - 7,8 |
| Acqua di mare | 7,7 – 8,3 |
| Bicarbonato di sodio | 8,31 |
| Saponi alcalini | 9,0 - 10,0 |
| Ammoniaca | 11,5 |
| Varechina | 12,5 |
| Liscivia | 13,5 |
| Idrossido di sodio 1 M | 14 |
La parola acido deriva dal latino acidus traducibile in aspro mentre base deriva dall'arabo al-qali riferito alle ceneri di certe piante dalle quali si potevano estrarre sostanza alcaline, basiche per l'appunto.
Il concetto acido-base rappresenta uno dei temi più dibattuti nella storia della chimica. Questo a testimonianza dell'importanza e della quotidianità con cui da sempre ci imbattiamo in questo tipo di soluzioni.
Se all'improvviso qualcuno ci chiedesse di nominare un acido probabilmente risponderemo dicendo acido cloridrico o acido solforico, se ci venisse chiesto invece di nominare una base di solito i primi composti che vengono in mente sono il bicarbonato di sodio oppure la soda caustica ovvero l'idrossido di sodio, utilizzato industrialmente per la produzione di ipoclorito di sodio che non è altro che la candeggina comunemente usata per disinfettare sanitari e pavimenti.
E se ci venisse chiesto qual è la differenza tra un acido e una base?
Cominciamo con il chiarire di che cosa stiamo parlando. Prendiamo ad esempio l'acido cloridrico (o più propriamente cloruro di idrogeno secondo la nomenclatura IUPAC). A temperatura e pressione ambiente esso è un composto allo stato gassoso, incolore e dall'odore pungente. Tossico se respirato in grande concentrazione. In acqua invece libera tutto il suo potere corrosivo, perché?
Consideriamo la reazione di dissociazione.
HCl(g)→ H+(aq)+ Cl-(aq)
Come visto nel paragrafo precedente vengono liberati in soluzione gli ioni H+ e Cl-. Gli ioni H+ hanno una grande mobilità e tendono a combinarsi con le molecole d'acqua per formare lo ione ossonio idrato o idronio:
H+ + H2O→ H3O+ ⇐ Questo catione esercita la sua elettronegatività attirando elettroni:
2H3O+ + 2e -→H2 + 2H2O
Ma chi può fornire gli elettroni?
Quegli elementi che possono cederli, ovvero i metalli. Gli acidi quindi, sequestrando elettroni, distruggono i reticoli cristallini dei metalli provocando quella che a livello macroscopico è chiamata corrosione.
Naturalmente gli acidi intaccano non solo i solidi inorganici ma, con analogo meccanismo, anche i composti biologici.
D'altro canto le basi forti manifestano in acqua un comportamento altrettanto aggressivo. Consideriamo ad esempio la reazione di dissociazione dell' idrossido di sodio:
NaOH(s) → Na+(aq)+ OH-(aq) In questo caso lo ione libero OH- va ad aggredire le porzioni positive dei composti molecolari o i cationi nei composti ionici. L'effetto corrosivo è equiparabile.
TEORIA DI ARRHENIUS
Sulla base di numerose osservazioni il chimico svedese Svante Arrhenius nel 1887 formulò la prima teoria relativa agli acidi e le basi.
Acido: specie chimica che in soluzione acquosa aumenta la concentrazione degli ioni idrogeno H+
Base: specie chimica che in soluzione acquosa aumenta la concentrazione degli ioni idrossido OH-
GRADO DI ACIDITÀ DI UNA SOLUZIONE: pH
Il pH è un intervallo di valori che va da 0 a 14. Questa numerazione è ottenuta per via matematica partendo dalla concentrazione in soluzione degli ioni H+.
Ciò che ci interessa in questo momento è saper dire se una soluzione è acida o basica.
È acida se il pH è <7;
È basica se il pH è >7;
È neutra se il pH è =7.
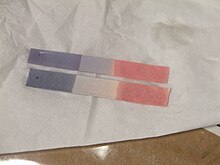
Per determinare il valore nella scala del pH può essere utilizzata la cartina indicatrice acido-base anche chiamata cartina tornasole. È sufficiente inserire la cartina all'interno della soluzione. La porzione bagnata assumerà una colorazione che potrà andare dal viola al blu. Il viola è indice di una soluzione estremamente acida, mentre il blu indica invece una soluzione estremamente basica.
Attività
[modifica | modifica sorgente]Versione stampabile. Pdf pronto all'uso.
Esercizi: in questa pagina si trovano esercizi su questi argomenti Acidi, basi e pH: in questa scheda troverete una sintesi che comprende tutte e tre le teorie






























