Chimica per il liceo/Teoria cinetico molecolare dei gas
La teoria cinetico-molecolare
[modifica | modifica sorgente]Le leggi dei gas che abbiamo visto finora, così come l'equazione dei gas ideali, sono empiriche, cioè derivano da osservazioni sperimentali. Le forme matematiche di queste leggi descrivono da vicino il comportamento macroscopico della maggior parte dei gas a pressioni inferiori a circa 1 o 2 atm. Sebbene le leggi dei gas descrivano relazioni che sono state verificate da molti esperimenti, non ci dicono perché i gas seguono queste relazioni.

La teoria cinetico-molecolare (KMT) è un semplice modello microscopico che spiega efficacemente le leggi dei gas descritte nei moduli precedenti di questo capitolo. Questa teoria si basa sui seguenti cinque postulati qui descritti. (Nota: il termine “molecola” verrà utilizzato per riferirsi alle singole specie chimiche che compongono il gas, sebbene alcuni gas siano composti da specie atomiche, ad esempio i gas nobili.)
- I gas sono composti da molecole che sono in continuo movimento, viaggiano in linea retta e cambiano direzione solo quando entrano in collisione con altre molecole o con le pareti di un contenitore.
- Le molecole che compongono il gas sono trascurabilmente piccole rispetto alla distanza che le separa.
- La pressione esercitata da un gas in un contenitore risulta dalle collisioni tra le molecole del gas e le pareti del contenitore.
- Le molecole di gas non esercitano forze attrattive o repulsive tra loro o sulle pareti del contenitore; pertanto i loro urti sono elastici (non comportano una perdita di energia).
- L'energia cinetica media delle molecole di gas è proporzionale alla temperatura Kelvin del gas.
La prova del KMT e dei suoi postulati è la sua capacità di spiegare e descrivere il comportamento di un gas. Le varie leggi dei gas possono essere derivate dalle ipotesi della KMT, che hanno portato i chimici a credere che le ipotesi della teoria rappresentino accuratamente le proprietà delle molecole di gas. Per prima cosa esamineremo concettualmente le leggi dei singoli gas (leggi di Boyle, Charles, Amontons, Avogadro e Dalton) per vedere come le spiega il KMT. Poi, considereremo più attentamente le relazioni tra le masse molecolari, le velocità e le energie cinetiche con la temperatura, e spiegheremo la legge di Graham.
La teoria cinetico-molecolare spiega il comportamento dei gas
[modifica | modifica sorgente]Ricordando che la pressione del gas è esercitata dalle molecole di gas in rapido movimento e dipende direttamente dal numero di molecole che colpiscono un'area unitaria della parete per unità di tempo, vediamo che il KMT spiega concettualmente il comportamento di un gas come segue:
- La legge di Gay-Lussac (o di Amontons, o di trasformazione isocora). Se la temperatura aumenta, aumentano la velocità media e l'energia cinetica delle molecole del gas. Se il volume viene mantenuto costante, l'aumento della velocità delle molecole di gas provoca collisioni più frequenti e più forti con le pareti del contenitore, aumentando quindi la pressione (vedi figura sotto).
- La legge di Charles (o di Volta Gay-Lussac, o di trasformazione isobarica) . Se si aumenta la temperatura di un gas, la pressione può essere mantenuta costante solo se aumenta il volume occupato dal gas. Ciò si tradurrà in maggiori distanze medie percorse dalle molecole per raggiungere le pareti del contenitore, nonché in una maggiore superficie delle pareti. Queste condizioni diminuiranno sia la frequenza delle collisioni molecola-parete sia il numero di collisioni per unità di area, i cui effetti combinati bilanciano l'effetto delle maggiori forze di collisione dovute alla maggiore energia cinetica alla temperatura più elevata.
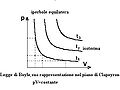
- La legge di Boyle (o legge di trasformazione isotermica). Se il volume di una determinata quantità di gas a una determinata temperatura diminuisce (ovvero, se il gas viene compresso ), le molecole saranno esposte a un'area ridotta della parete del contenitore. Le collisioni con la parete del contenitore si verificheranno quindi con maggiore frequenza e la pressione esercitata dal gas aumenterà (vedi figura sotto).
- Legge di Avogadro. A pressione e temperatura costanti, la frequenza e la forza delle collisioni molecola-parete sono costanti. In tali condizioni, l’aumento del numero di molecole gassose richiederà un aumento proporzionale del volume del contenitore per produrre una diminuzione del numero di collisioni per unità di area per compensare l’aumento della frequenza delle collisioni (vedi figura sotto). In altre parole: volumi uguali di gas differenti, nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di molecole.
- Legge di Dalton. A causa delle grandi distanze tra loro, le molecole di un gas in una miscela bombardano le pareti del contenitore con la stessa frequenza indipendentemente dalla presenza o meno di altri gas, e la pressione totale di una miscela di gas è uguale alla somma delle pressioni (parziali) di i singoli gas.

(a) Quando la temperatura del gas aumenta, la pressione del gas aumenta a causa dell'aumento della forza e della frequenza delle collisioni molecolari. (b) Quando il volume diminuisce, la pressione del gas aumenta a causa dell'aumento della frequenza delle collisioni molecolari. (c) Quando la quantità di gas aumenta a pressione costante, il volume aumenta fino a produrre un numero costante di collisioni per unità di area della parete per unità di tempo.
-
Rappresentazione grafica della seconda legge di Gay Lussac
-
Rappresentazione grafica della Legge di Charles
-
Animazione che spiega la legge di Charles
-
Rappresentazione isoterma della legge di Boyle
-
Animazione che spiega la legge di Boyle
-
Relazioni tra le leggi di Boyle, di Charles, di Gay-Lussac, di Avogadro, combinate e dei gas ideali, con la costante di Boltzmann
-
Legge di Dalton delle pressioni parziali
Velocità molecolari ed energia cinetica
[modifica | modifica sorgente]La discussione precedente ha mostrato che la teoria cinetica molecolare KMT spiega qualitativamente i comportamenti descritti dalle varie leggi sui gas. I postulati di questa teoria possono essere applicati in modo più quantitativo per ricavare queste leggi individuali. Per fare ciò, dobbiamo prima osservare le velocità e le energie cinetiche delle molecole di gas e la temperatura di un campione di gas.



In un campione di gas, le singole molecole hanno velocità molto variabili; tuttavia, a causa del gran numero di molecole e di collisioni coinvolte, la distribuzione della velocità molecolare e la velocità media sono costanti. Questa distribuzione della velocità molecolare è nota come distribuzione di Maxwell-Boltzmann e rappresenta il numero relativo di molecole in un campione globale di gas che possiede una determinata velocità ( Figura sopra).
Se la temperatura di un gas aumenta, il suo KE medio aumenta, più molecole hanno velocità più elevate e meno molecole hanno velocità più basse e la distribuzione si sposta complessivamente verso velocità più elevate, cioè verso destra. Se la temperatura diminuisce, KE avg diminuisce, più molecole hanno velocità inferiori e meno molecole hanno velocità più elevate e la distribuzione si sposta complessivamente verso velocità inferiori, cioè verso sinistra. Questo comportamento è illustrato nella Figura sopra.
Ad una data temperatura, tutti i gas hanno lo stesso KE medio per le loro molecole. I gas composti da molecole più leggere hanno più particelle ad alta velocità, con una distribuzione della velocità che raggiunge il picco a velocità relativamente più elevate. I gas costituiti da molecole più pesanti hanno più particelle a bassa velocità, e una distribuzione della velocità che raggiunge il picco a velocità relativamente più basse. Questa tendenza è dimostrata dai dati per una serie di gas nobili mostrati nella Figura sotto.

Fonte
[modifica | modifica sorgente]https://openstax.org/books/chemistry-atoms-first-2e/pages/8-5-the-kinetic-molecular-theory