Chimica per il liceo/lo stato solido
Solidi amorfi e cristallini
[modifica | modifica sorgente]Quando la maggior parte dei liquidi viene raffreddata, alla fine si congela e formano solidi cristallini , solidi in cui gli atomi, gli ioni o le molecole sono disposti secondo uno schema geometrico ripetitivo definito. È anche possibile che un liquido congeli prima che le sue molecole si dispongano in uno schema ordinato. I materiali risultanti sono chiamati solidi amorfi o solidi non cristallini (o, talvolta, vetri). Le particelle di tali solidi mancano di una struttura interna ordinata e sono disposte in modo casuale

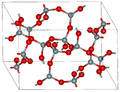
I metalli e i composti ionici formano tipicamente solidi cristallini ordinati. Le sostanze costituite da grandi molecole, o da una miscela di molecole i cui movimenti sono più limitati, spesso formano solidi amorfi. Ad esempio, le cere delle candele sono solidi amorfi composti da grandi molecole di idrocarburi. Alcune sostanze, come il biossido di silicio (mostrato nella Figura 10.38 ), possono formare solidi cristallini o amorfi, a seconda delle condizioni in cui vengono prodotte. Inoltre, i solidi amorfi possono subire una transizione allo stato cristallino in condizioni appropriate.
| Silice cristallina | silice amorfa |
|---|---|
 |
 |
| Il biossido di silicio, SiO2 , nella forma cristallina | Il raffreddamento rapido della SiO2 fusa produce un solido amorfo |
I solidi cristallini sono generalmente classificati in base alla natura delle forze che tengono insieme le sue particelle. Queste forze sono le principali responsabili delle proprietà fisiche esibite dai solidi sfusi. Le sezioni seguenti forniscono descrizioni dei principali tipi di solidi cristallini: ionici, metallici, reti covalenti e molecolari.
Solidi ionici
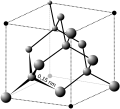
[modifica | modifica sorgente]I solidi ionici , come il cloruro di sodio e l'ossido di nichel, sono composti da ioni positivi e negativi tenuti insieme da attrazioni elettrostatiche, che possono essere piuttosto forti ( Figura 10.39 ). Molti cristalli ionici hanno anche punti di fusione elevati. Ciò è dovuto alle fortissime attrazioni tra gli ioni: nei composti ionici, le attrazioni tra le cariche complete sono (molto) maggiori di quelle tra le cariche parziali nei composti molecolari polari. Questo verrà esaminato più dettagliatamente in una discussione successiva sulle energie reticolari. Sebbene siano duri, tendono anche ad essere fragili e si frantumano anziché piegarsi. I solidi ionici non conducono elettricità; tuttavia, conducono quando sono fusi o disciolti perché i loro ioni sono liberi di muoversi. Molti composti semplici formati dalla reazione di un elemento metallico con un elemento non metallico sono ionici.

Solidi metallici
[modifica | modifica sorgente]I solidi metallici come i cristalli di rame, alluminio e ferro sono formati da atomi di metallo ( Figura 10.40 ). La struttura dei cristalli metallici viene spesso descritta come una distribuzione uniforme di nuclei atomici all'interno di un “mare” di elettroni delocalizzati. Gli atomi all'interno di un solido metallico di questo tipo sono tenuti insieme da una forza unica nota come legame metallico che dà origine a molte proprietà utili e varie. Tutti presentano un'elevata conduttività termica ed elettrica, lucentezza metallica e malleabilità. Molti sono molto duri e piuttosto forti. A causa della loro malleabilità (la capacità di deformarsi sotto pressione o martellamento), non si frantumano e, quindi, costituiscono utili materiali da costruzione. I punti di fusione dei metalli variano ampiamente. Il mercurio è un liquido a temperatura ambiente e i metalli alcalini fondono al di sotto dei 200 °C. Anche diversi metalli post-transizione hanno punti di fusione bassi, mentre i metalli di transizione fondono a temperature superiori a 1000 °C. Queste differenze riflettono le differenze nella forza del legame metallico tra i metalli.

Solidi covalenti
[modifica | modifica sorgente]I solidi covalenti includono cristalli di diamante, silicio, alcuni altri non metalli e alcuni composti covalenti come il biossido di silicio (sabbia) e il carburo di silicio (carborundum, l'abrasivo sulla carta vetrata). Molti minerali hanno reti di legami covalenti. Gli atomi di questi solidi sono tenuti insieme da una rete di legami covalenti, come mostrato nella galleria sotto . Per rompere o fondere una rete covalente solida, i legami covalenti devono essere rotti. Poiché i legami covalenti sono relativamente forti, i solidi della rete covalente sono tipicamente caratterizzati da durezza, resistenza e punti di fusione elevati. Il diamante, ad esempio, è una delle sostanze più dure conosciute e fonde a temperature superiori a 3.500 °C.
-
diamante
-
quarzo (SiO2)
-
carburo di silicio
-
grafite
Un cristallo covalente contiene una rete tridimensionale di legami covalenti, come illustrato dalle strutture del diamante, del biossido di silicio, del carburo di silicio e della grafite. La grafite è un esempio eccezionale, composto da fogli planari di cristalli covalenti tenuti insieme in strati da forze non covalenti. A differenza dei tipici solidi covalenti, la grafite è molto morbida ed elettricamente conduttiva.
Solido molecolare
[modifica | modifica sorgente]I solidi molecolari , come ghiaccio, saccarosio (zucchero da tavola) e iodio, come mostrato nella galleria sotto , sono composti da molecole neutre. L'intensità delle forze di attrazione tra le unità presenti nei diversi cristalli varia ampiamente, come indicato dai punti di fusione dei cristalli. Piccole molecole simmetriche (molecole non polari), come H2 , N2 , O2 e F2 , hanno deboli forze attrattive e formano solidi molecolari con punti di fusione molto bassi (sotto −200 °C). Le sostanze costituite da molecole più grandi e non polari hanno forze attrattive maggiori e fondono a temperature più elevate. I solidi molecolari composti da molecole con momenti di dipolo permanenti (molecole polari) fondono a temperature ancora più elevate. Gli esempi includono il ghiaccio (punto di fusione, 0 °C) e lo zucchero da tavola (punto di fusione, 185 °C).
-
Il saccarosio
-
Il ghiaccio
-
Ghiaccio secco (CO2 allo stato solido)
-
Ghiaccio secco (CO2), struttura cristallina
-
iodio solido (I2)
-
iodio solido, struttura cristallina
Figura 10.42 L'anidride carbonica (CO2) è costituita da piccole molecole non polari e forma un solido molecolare con un punto di fusione di −78 °C. Lo iodio (I2 ) è costituito da molecole più grandi, non polari e forma un solido molecolare che fonde a 114 °C.
Proprietà dei solidi
[modifica | modifica sorgente]Un solido cristallino, come quelli elencati nella Tabella 10.4 , ha una temperatura di fusione precisa perché ogni atomo o molecola dello stesso tipo è tenuto in posizione con le stesse forze o energia. Pertanto, le attrazioni tra le unità che compongono il cristallo hanno tutte la stessa forza e richiedono tutte la stessa quantità di energia per essere spezzate. Il graduale rammollimento di un materiale amorfo differisce notevolmente dalla netta fusione di un solido cristallino. Ciò risulta dalla non equivalenza strutturale delle molecole nel solido amorfo. Alcune forze sono più deboli di altre e quando un materiale amorfo viene riscaldato, le attrazioni intermolecolari più deboli si rompono per prime. Quando la temperatura aumenta ulteriormente, le attrazioni più forti vengono interrotte. Pertanto i materiali amorfi si ammorbidiscono in un intervallo di temperature.
Tipi di solidi cristallini e loro proprietà
| Tipo di solido | Tipo di particelle | Tipo di attrazioni | Proprietà | Esempi |
|---|---|---|---|---|
| ionico | ioni | legami ionici | duro, fragile, conduce l'elettricità come un liquido ma non come un solido, con punti di fusione da alti a molto alti | NaCl , Al2O3 |
| metallico | atomi di elementi elettropositivi | legami metallici | lucido, malleabile, duttile, conduce bene calore ed elettricità, durezza e temperatura di fusione variabili | Cu, Fe, Ti, Pb, U |
| rete covalente | atomi di elementi elettronegativi | legami covalenti | molto duro, non conduttivo, punti di fusione molto alti | C (diamante), SiO 2 , SiC |
| molecolare | molecole (o atomi) | FMI | durezza variabile, fragilità variabile, non conduttivo, basso punto di fusione | H2O , CO2 , I2 , C12H22O11 |
Grafene: materiale del futuro
[modifica | modifica sorgente]Il carbonio è un elemento essenziale nel nostro mondo. Le proprietà uniche degli atomi di carbonio consentono l’esistenza di forme di vita basate sul carbonio come noi. Il carbonio forma un'enorme varietà di sostanze che utilizziamo quotidianamente, comprese quelle mostrate nella Figura 10.43 . Potresti avere familiarità con il diamante e la grafite, i due allotropi più comuni del carbonio. (Gli allotropi sono forme strutturali diverse dello stesso elemento.) Il diamante è una delle sostanze più dure conosciute, mentre la grafite è abbastanza morbida da poter essere utilizzata come mina per matite. Queste proprietà molto diverse derivano dalla diversa disposizione degli atomi di carbonio nei diversi allotropi.
-
Diamante
-
struttura del diamante
-
La mina della matita contiene grafite
-
Struttura della grafite
Nella galleria: Il diamante è estremamente duro a causa del forte legame tra gli atomi di carbonio in tutte le direzioni. La grafite (nella mina della matita) si stacca dalla carta a causa delle deboli attrazioni tra gli strati di carbonio. Un'immagine di una superficie di grafite mostra la distanza tra i centri degli atomi di carbonio adiacenti. Potresti avere meno familiarità con una forma di carbonio scoperta di recente: il grafene. Il grafene è stato isolato per la prima volta nel 2004 utilizzando nastro adesivo per staccare strati sempre più sottili dalla grafite. È essenzialmente un singolo foglio (spesso un atomo) di grafite. Il grafene, illustrato nella galleria qui sotto, non solo è resistente e leggero, ma è anche un eccellente conduttore di elettricità e calore. Queste proprietà potrebbero rivelarsi molto utili in una vasta gamma di applicazioni, come chip e circuiti di computer notevolmente migliorati, batterie e celle solari migliori e materiali strutturali più resistenti e leggeri. Il Premio Nobel per la Fisica 2010 è stato assegnato ad Andre Geim e Konstantin Novoselov per il loro lavoro pionieristico con il grafene.
-
Nanotubi di carbonio
-
Grafene
-
nanotubo
-
Nanosfera di carbonio
I fogli di grafene possono essere formati in nanosfere, nanotubi e strati impilati.
Difetti del cristallo
[modifica | modifica sorgente]In un solido cristallino, gli atomi, gli ioni o le molecole sono disposti secondo uno schema ripetitivo definito, ma nello schema possono verificarsi difetti occasionali. Sono noti diversi tipi di difetti. I posti vacanti sono difetti che si verificano quando le posizioni che dovrebbero contenere atomi o ioni sono vacanti. Meno comunemente, alcuni atomi o ioni in un cristallo possono occupare posizioni, chiamate siti interstiziali , situate tra le posizioni regolari degli atomi. Altre distorsioni si trovano nei cristalli impuri, come, ad esempio, quando i cationi, gli anioni o le molecole dell'impurità sono troppo grandi per adattarsi alle posizioni regolari senza distorcere la struttura. Tracce di impurità vengono talvolta aggiunte a un cristallo (un processo noto come drogaggio) per creare difetti nella struttura che producono cambiamenti desiderabili nelle sue proprietà. Ad esempio, i cristalli di silicio vengono drogati con quantità variabili di elementi diversi per ottenere proprietà elettriche adatte al loro utilizzo nella produzione di semiconduttori e chip di computer (vedi galleria qui sotto)
-
Drogaggio con fosforo
-
Drogaggio con alluminio
-
Drogaggio con boro o antimonio
Esercizi
[modifica | modifica sorgente]https://openstax.org/books/chemistry-atoms-first-2e/pages/10-exercises
Fonti
[modifica | modifica sorgente]https://openstax.org/books/chemistry-atoms-first-2e/pages/10-5-the-solid-state-of-matter