Chimica per il liceo/Geometria molecolare
Geometria delle molecole e loro polarità
[modifica | modifica sorgente]Finora abbiamo utilizzato strutture di Lewis bidimensionali per rappresentare le molecole. Tuttavia, la struttura molecolare è in realtà tridimensionale ed è importante essere in grado di descrivere i legami molecolari in termini di distanze, angoli e disposizioni relative nello spazio (Figura sotto). Un angolo di legame è l'angolo tra due legami qualsiasi che includono un atomo comune, solitamente misurato in gradi. Una distanza di legame (o lunghezza di legame) è la distanza tra i nuclei di due atomi legati lungo la linea retta che unisce i nuclei. Le distanze di legame sono misurate in Ångstrom (1 Å = 10–10 m) o picometri (1 pm = 10–12 m, 100 pm = 1 Å).

Teoria VSEPR
[modifica | modifica sorgente]La teoria della repulsione delle coppie di elettroni del guscio di valenza (teoria VSEPR) ci consente di prevedere la struttura molecolare, compresi gli angoli approssimativi di legame attorno a un atomo centrale, di una molecola da un esame del numero di legami e di coppie di elettroni solitari nella sua struttura di Lewis. Il modello VSEPR presuppone che le coppie di elettroni nel guscio di valenza di un atomo centrale adottino una disposizione che minimizzi le repulsioni tra queste coppie di elettroni massimizzando la distanza tra loro. Gli elettroni nel guscio di valenza di un atomo centrale formano coppie di elettroni di legame, situati principalmente tra atomi legati, o coppie solitarie. La repulsione elettrostatica di questi elettroni si riduce quando le varie regioni ad alta densità elettronica assumono posizioni quanto più lontane possibile tra loro.
La teoria VSEPR prevede la disposizione delle coppie di elettroni attorno a ciascun atomo centrale e, solitamente, la corretta disposizione degli atomi in una molecola. Dovremmo capire, tuttavia, che la teoria considera solo le repulsioni delle coppie di elettroni. Anche altre interazioni, come le repulsioni nucleare-nucleare e le attrazioni nucleare-elettrone, sono coinvolte nella disposizione finale che gli atomi adottano in una particolare struttura molecolare.
Come semplice esempio della teoria VSEPR, prevediamo la struttura di una molecola gassosa di BeF2 . La struttura di Lewis di BeF2 (Figura sotto) mostra solo due coppie di elettroni attorno all'atomo centrale di berillio. Con due legami e nessuna coppia solitaria di elettroni sull'atomo centrale, i legami sono quanto più distanti possibile e la repulsione elettrostatica tra queste regioni ad alta densità elettronica è ridotta al minimo quando si trovano su lati opposti dell'atomo centrale. L'angolo di legame è 180°.

La tabella qui sotto illustra questa e altre geometrie di coppie di elettroni che minimizzano le repulsioni tra regioni (o domini) ad alta densità elettronica (legami e/o coppie solitarie). Due regioni di densità elettronica attorno a un atomo centrale in una molecola formano una geometria lineare; tre regioni formano una geometria planare trigonale quattro regioni formano una geometria tetraedrica; cinque regioni formano una geometria bipiramidale trigonale; e sei regioni formano una geometria ottaedrica.
Le geometrie di base delle coppie di elettroni previste dalla teoria VSEPR massimizzano lo spazio attorno a qualsiasi regione (o dominio) di densità elettronica (legami o coppie solitarie).
È importante notare che la geometria della coppia di elettroni attorno a un atomo centrale non è la stessa cosa della sua struttura molecolare. Le geometrie delle coppie di elettroni mostrate nella tabella descrivono tutte le regioni in cui si trovano gli elettroni, i legami e le coppie solitarie. La struttura molecolare descrive la posizione degli atomi, non degli elettroni.
Distinguiamo tra queste due situazioni denominando la geometria che include tutte le coppie di elettroni geometria della coppia di elettroni . La struttura che include solo la disposizione degli atomi nella molecola è chiamata struttura molecolare . Le geometrie delle coppie di elettroni saranno le stesse delle strutture molecolari quando non ci sono coppie di elettroni solitari attorno all'atomo centrale, ma saranno diverse quando sono presenti coppie di elettroni solitari sull'atomo centrale.
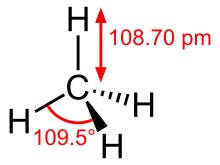
Ad esempio, la molecola di metano, CH4, che è il componente principale del gas naturale, ha quattro coppie di elettroni di legame attorno all'atomo di carbonio centrale; la geometria della coppia di elettroni è tetraedrica, così come la struttura molecolare. Strutture VSEPR come questa sono spesso disegnate utilizzando la notazione cuneo e trattino, in cui le linee continue rappresentano i legami nel piano della pagina, i cunei solidi rappresentano i legami che escono dal piano e le linee tratteggiate rappresentano i legami che scendono nel piano. D'altra parte, anche la molecola dell'ammoniaca, NH3, ha quattro coppie di elettroni associate all'atomo di azoto, e quindi ha una geometria della coppia di elettroni tetraedrica. Una di queste regioni, tuttavia, è una coppia solitaria, che non è inclusa nella struttura molecolare, e questa coppia solitaria influenza la forma della molecola. Quindi (a) la geometria delle coppie di elettroni (domini) per la molecola di ammoniaca è tetraedrica con una coppia solitaria e tre legami singoli. (b) La struttura molecolare piramidale trigonale è determinata dalla geometria degli atomi di idrogeno attaccati all'azoto. (c) Gli angoli di legame effettivi deviano leggermente dagli angoli idealizzati perché la coppia solitaria occupa una regione di spazio più ampia rispetto ai legami singoli, facendo sì che l'angolo H-N-H sia leggermente inferiore a 109,5°.

Come si vede nella dell'ammoniaca, piccole distorsioni rispetto agli angoli ideali mostrati in tabella possono derivare da differenze nella repulsione tra varie regioni di densità elettronica. La teoria VSEPR prevede queste distorsioni stabilendo un ordine di repulsioni e un ordine della quantità di spazio occupato dai diversi tipi di coppie di elettroni. L'ordine delle repulsioni delle coppie di elettroni dalla repulsione maggiore a quella minore è:
coppia solitaria - coppia solitaria > coppia solitaria - coppia di legame > coppia di legame - coppia di legame
Questo ordine di repulsioni determina la quantità di spazio occupato dalle diverse regioni di elettroni. Una coppia solitaria di elettroni occupa una regione di spazio più ampia degli elettroni in un triplo legame; a loro volta, gli elettroni in un triplo legame occupano più spazio di quelli in un doppio legame, e così via. L'ordine delle dimensioni dalla più grande alla più piccola è:
coppia solitaria > triplo legame > doppio legame > legame singolo
Consideriamo la formaldeide, H2CO, che viene utilizzata come conservante per campioni biologici e anatomici.

Questa molecola ha regioni ad alta densità elettronica costituite da due legami singoli e un doppio legame. La geometria di base è trigonale planare con angoli di legame di 120°, ma vediamo che il doppio legame provoca angoli leggermente più grandi (121°) e l'angolo tra i singoli legami è leggermente più piccolo (118°).
Nella molecola dell'ammoniaca, i tre atomi di idrogeno attaccati all'azoto centrale non sono disposti in una struttura molecolare planare piatta, trigonale, ma piuttosto in una piramide trigonale tridimensionale con l'atomo di azoto all'apice e i tre atomi di idrogeno atomi che costituiscono la base. Gli angoli di legame ideali in una piramide trigonale si basano sulla geometria della coppia di elettroni tetraedrici. Ancora una volta, ci sono lievi deviazioni dall'ideale perché le coppie solitarie occupano regioni di spazio più grandi rispetto agli elettroni di legame. Gli angoli di legame H–N–H in NH3 sono leggermente più piccoli dell'angolo di 109,5° in un tetraedro regolare perché la repulsione della coppia solitaria-coppia di legame è maggiore della repulsione della coppia di legame-coppia di legame. La Figura 4.19 illustra le strutture molecolari ideali, previste in base alle geometrie delle coppie di elettroni per varie combinazioni di coppie solitarie e coppie di legame.

Le strutture molecolari sono identiche alle geometrie delle coppie di elettroni quando non sono presenti coppie solitarie (prima colonna). Per un particolare numero di coppie di elettroni (riga), le strutture molecolari di una o più coppie solitarie vengono determinate in base alle modifiche della corrispondente geometria della coppia di elettroni.
Secondo la teoria VSEPR, le posizioni degli atomi terminali (X nella tabella sopra) sono equivalenti all'interno delle geometrie delle coppie di elettroni lineare, planare trigonale e tetraedrica (le prime tre righe della tabella). Non importa quale X viene sostituito con una coppia solitaria perché le molecole possono essere ruotate per convertire le posizioni. Per le geometrie di coppie di elettroni bipiramidali trigonali, tuttavia, ci sono due posizioni X distinte, come mostrato nella Figura 4.20 : una posizione assiale (se manteniamo un modello di bipiramide trigonale mediante le due posizioni assiali, abbiamo un asse attorno al quale possiamo ruotare il modello) e una posizione equatoriale (tre posizioni formano un equatore attorno al centro della molecola). Come mostrato nella tabella, la posizione assiale è circondata da angoli di legame di 90°, mentre la posizione equatoriale ha più spazio disponibile a causa degli angoli di legame di 120°. In una geometria trigonale bipiramidale di coppie di elettroni, le coppie solitarie occupano sempre posizioni equatoriali perché queste posizioni più spaziose possono ospitare più facilmente le coppie solitarie più grandi.
Teoricamente, possiamo trovare tre possibili disposizioni per i tre legami e due coppie solitarie per la molecola ClF3 ( Figura sotto ). La struttura stabile è quella che colloca le coppie solitarie in posizioni equatoriali, dando una struttura molecolare a forma di T.

Quando un atomo centrale ha due coppie di elettroni solitari e quattro regioni di legame, abbiamo una geometria della coppia di elettroni ottaedrica. Le due coppie solitarie si trovano sui lati opposti dell'ottaedro (a 180° di distanza), dando vita ad una struttura molecolare planare quadrata che minimizza le repulsioni tra coppie solitarie.
Previsione della geometria della coppia di elettroni e della struttura molecolare
[modifica | modifica sorgente]La seguente procedura utilizza la teoria VSEPR per determinare le geometrie delle coppie di elettroni e le strutture molecolari:
- Scrivi la struttura di Lewis della molecola o dello ione poliatomico.
- Contare il numero di regioni di densità elettronica (coppie solitarie e legami) attorno all'atomo centrale. Un legame singolo, doppio o triplo conta come una regione di densità elettronica.
- Identificare la geometria della coppia di elettroni in base al numero di regioni di densità elettronica: lineare, planare trigonale, tetraedrica, bipiramidale trigonale o ottaedrica (vedi tabella sopra).
- Utilizzare il numero di coppie solitarie per determinare la struttura molecolare. Se è possibile più di una disposizione di coppie solitarie e legami chimici, scegliere quella che minimizzerà le repulsioni, ricordando che le coppie solitarie occupano più spazio dei legami multipli, che occupano più spazio dei legami singoli. Nelle disposizioni bipiramidali trigonali, la repulsione è ridotta al minimo quando ogni coppia solitaria si trova in posizione equatoriale. In una disposizione ottaedrica con due coppie solitarie, la repulsione è ridotta al minimo quando le coppie solitarie si trovano sui lati opposti dell'atomo centrale.
Gli esempi seguenti illustrano l'uso della teoria VSEPR per prevedere la struttura molecolare di molecole o ioni che non hanno coppie solitarie di elettroni. In questo caso, la struttura molecolare è identica alla geometria della coppia di elettroni.
Esempio 1
[modifica | modifica sorgente]Prevedere la geometria della coppia di elettroni e la struttura molecolare per ciascuno dei seguenti elementi: (a) anidride carbonica, CO2, una molecola prodotta dalla combustione di combustibili fossili. (b) tricloruro di boro, BCl3, un importante prodotto chimico industriale.
Soluzione
[modifica | modifica sorgente](a) Scriviamo la struttura di Lewis della CO2 come: 
Questo ci mostra due regioni ad alta densità elettronica attorno all'atomo di carbonio: ogni doppio legame conta come una regione e non ci sono coppie solitarie sull'atomo di carbonio. Utilizzando la teoria VSEPR, prevediamo che le due regioni di densità elettronica si dispongano sui lati opposti dell'atomo centrale con un angolo di legame di 180°. La geometria della coppia di elettroni e la struttura molecolare sono identiche e le molecole di CO2 sono lineari.
(b) Scriviamo la struttura di Lewis di BCl3 come: 
Quindi vediamo che BCl3 contiene tre legami e non ci sono coppie solitarie di elettroni sul boro. La disposizione di tre regioni ad alta densità elettronica dà una geometria planare trigonale della coppia di elettroni. I legami B–Cl giacciono su un piano con angoli di 120° tra di loro. BCl3 ha anche una struttura molecolare planare trigonale.

La geometria delle coppie di elettroni e la struttura molecolare di BCl3 sono entrambe planari trigonali. Si noti che la geometria VSEPR indica gli angoli di legame corretti (120°), a differenza della struttura di Lewis mostrata sopra.
Esercizio 1
[modifica | modifica sorgente]Lo ione carbonato CO32-, è uno ione poliatomico comune presente in vari materiali, dai gusci d'uovo agli antiacidi. Quali sono la geometria della coppia di elettroni e la struttura molecolare di questo ione poliatomico?
Soluzione
[modifica | modifica sorgente]La geometria della coppia di elettroni è planare trigonale e la struttura molecolare è planare trigonale. A causa della risonanza, tutti e tre i legami C–O sono identici. Che siano singoli, doppi o una media dei due, ciascun legame conta come una regione di densità elettronica.
Esempio 2
[modifica | modifica sorgente]Due dei 50 principali prodotti chimici prodotti negli Stati Uniti, il nitrato di ammonio NH4+ e il solfato di ammonio, entrambi utilizzati come fertilizzanti, contengono lo ione ammonio. Prevedere la geometria della coppia di elettroni e la struttura molecolare del catione.
Soluzione
[modifica | modifica sorgente]Scriviamo la struttura di Lewis di NH4+

Possiamo vedere che NH4+ contiene quattro legami dall'atomo di azoto agli atomi di idrogeno e nessuna coppia solitaria. Ci aspettiamo che le quattro regioni ad alta densità elettronica si dispongano in modo tale da puntare verso gli angoli di un tetraedro con l'atomo di azoto centrale al centro. Pertanto, la geometria della coppia di elettroni dello ione ammonio è tetraedrica e anche la struttura molecolare è tetraedrica

Esercizio 2
[modifica | modifica sorgente]Identificare una molecola con struttura molecolare bipiramidale trigonale.
Soluzione
[modifica | modifica sorgente]Qualsiasi molecola con cinque coppie di elettroni attorno agli atomi centrali che non includono coppie solitarie sarà bipiramidale trigonale. PF 5 è un esempio comune.
I prossimi esempi illustrano l'effetto delle coppie solitarie di elettroni sulla struttura molecolare.
[modifica | modifica sorgente]Esempio 3
[modifica | modifica sorgente]Prevedere la geometria della coppia di elettroni e la struttura molecolare di una molecola d'acqua.
Soluzione
[modifica | modifica sorgente]
La struttura di Lewis dell'H2O indica che ci sono quattro regioni ad alta densità elettronica attorno all'atomo di ossigeno: due coppie solitarie e due legami chimici:  Prevediamo che queste quattro regioni siano disposte in modo tetraedrico. Pertanto, la geometria delle coppie di elettroni è tetraedrica e la struttura molecolare è piegata con un angolo leggermente inferiore a 109,5°. Infatti l’angolo di legame è 104,5°.
Prevediamo che queste quattro regioni siano disposte in modo tetraedrico. Pertanto, la geometria delle coppie di elettroni è tetraedrica e la struttura molecolare è piegata con un angolo leggermente inferiore a 109,5°. Infatti l’angolo di legame è 104,5°.
Esercizio 3
[modifica | modifica sorgente]Lo ione idronio, H3O+, si forma quando gli acidi vengono disciolti in acqua. Prevedere la geometria della coppia di elettroni e la struttura molecolare di questo catione.
Soluzione
[modifica | modifica sorgente]geometria della coppia elettronica: tetraedrica; struttura molecolare: piramidale trigonale
Esempio 4
[modifica | modifica sorgente]
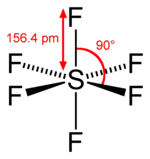
Il tetrafluoruro di zolfo, SF4, è estremamente prezioso per la preparazione di composti contenenti fluoro utilizzati come erbicidi (vale a dire, l'SF4 viene utilizzato come agente fluorurante). Prevedere la geometria della coppia di elettroni e la struttura molecolare di una molecola di SF4 .
Soluzione
[modifica | modifica sorgente]La struttura di Lewis di SF4 indica cinque regioni di densità elettronica attorno all'atomo di zolfo: una coppia solitaria e quattro coppie di legame:
Ci aspettiamo che queste cinque regioni adottino una geometria trigonale bipiramidale di coppia di elettroni. Per ridurre al minimo le repulsioni delle coppie solitarie, la coppia solitaria occupa una delle posizioni equatoriali. La struttura molecolare è quella di un'altalena.

Esercizio 4
[modifica | modifica sorgente]Prevedere la geometria della coppia di elettroni e la struttura molecolare delle molecole di XeF2 .
Soluzione
[modifica | modifica sorgente]La geometria della coppia di elettroni è bipiramidale trigonale. La struttura molecolare è lineare.
Esempio 5
[modifica | modifica sorgente]Di tutti i gas nobili, lo xeno è il più reattivo e spesso reagisce con elementi come ossigeno e fluoro. Prevedere la geometria della coppia di elettroni e la struttura molecolare della molecola XeF4
Soluzione
[modifica | modifica sorgente]La struttura di Lewis di XeF4 indica sei regioni ad alta densità elettronica attorno all'atomo di xeno: due coppie solitarie e quattro legami. Queste sei regioni adottano una disposizione ottaedrica, che è la geometria della coppia di elettroni. Per ridurre al minimo le repulsioni, le coppie solitarie dovrebbero trovarsi sui lati opposti dell'atomo centrale. I cinque atomi sono tutti sullo stesso piano e hanno una struttura molecolare planare quadrata.
Esercizio 5
[modifica | modifica sorgente]In una certa molecola, l'atomo centrale ha tre coppie solitarie e due legami. Quale sarà la geometria della coppia di elettroni e la struttura molecolare?
Soluzione
[modifica | modifica sorgente]geometria della coppia elettronica: bipiramidale trigonale; struttura molecolare: lineare
Struttura molecolare per molecole multicentriche
[modifica | modifica sorgente]Quando una molecola o uno ione poliatomico ha un solo atomo centrale, la struttura molecolare descrive completamente la forma della molecola. Le molecole più grandi non hanno un singolo atomo centrale, ma sono collegate da una catena di atomi interni che possiedono ciascuno una geometria “locale”. Anche il modo in cui queste strutture locali sono orientate l'una rispetto all'altra influenza la forma molecolare, ma tali considerazioni vanno ampiamente oltre lo scopo di questa discussione introduttiva. Per i nostri scopi, ci concentreremo solo sulla determinazione delle strutture locali.
Esempio 6
[modifica | modifica sorgente]
Qui è mostrata la struttura di Lewis per l'amminoacido più semplice, la glicina. Prevedere la geometria locale per l'atomo di azoto, i due atomi di carbonio e l'atomo di ossigeno con un atomo di idrogeno attaccato:
Soluzione
[modifica | modifica sorgente]
Considera ciascun atomo centrale in modo indipendente. Le geometrie della coppia di elettroni:
- azoto – quattro regioni di densità elettronica; tetraedrico
- carbonio ( -CH2- ) - quattro regioni di densità elettronica; tetraedrico
- carbonio ( -CO2 ): tre regioni di densità elettronica; planare trigonale
- ossigeno ( OH ): quattro regioni di densità elettronica; tetraedrico
Le strutture locali:
- azoto – tre legami, un paio solitario; piramidale trigonale
- carbonio ( CH2 ): quattro legami, nessuna coppia solitaria; tetraedrico
- carbonio ( CO2 )—tre legami (il doppio legame conta come un legame), nessuna coppia solitaria; planare trigonale
- ossigeno ( OH ): due legami, due coppie solitarie; piegato (109°)
Esercizio 6
[modifica | modifica sorgente]
Un altro amminoacido è l'alanina, che ha la struttura di Lewis mostrata qui. Prevedere la geometria della coppia di elettroni e la struttura locale dell'atomo di azoto, dei tre atomi di carbonio e dell'atomo di ossigeno con l'idrogeno attaccato:
Soluzione
[modifica | modifica sorgente]geometrie della coppia di elettroni: azoto––tetraedrico; carbonio ( CH)—tetraedrico; carbonio ( CH3 )—tetraedrico; carbonio ( CO2 )—planare trigonale; ossigeno ( OH )—tetraedrico; strutture locali: azoto-piramidale trigonale; carbonio ( CH )—tetraedrico; carbonio ( CH3 )—tetraedrico; carbonio ( CO2 )—planare trigonale; ossigeno ( OH )—piegato (109°)
Esempio 7
[modifica | modifica sorgente]Simulazione molecolare
[modifica | modifica sorgente]L'uso del simulatore di forma molecolare (piattaforma PhET) ci consente di controllare come gli angoli di legame e/o le coppie solitarie vengono visualizzati selezionando o deselezionando le caselle sotto "Opzioni" a destra. Possiamo anche utilizzare le caselle "Nome" in basso a sinistra per visualizzare o nascondere la geometria della coppia di elettroni (chiamata "geometria elettronica" nel simulatore) e/o la struttura molecolare (chiamata "forma molecolare" nel simulatore). Costruisci la molecola HCN nel simulatore basandoti sulla seguente struttura di Lewis ![]()
Fai clic su ciascun tipo di legame o coppia solitaria a destra per aggiungere quel gruppo all'atomo centrale. Una volta ottenuta la molecola completa, ruotala per esaminare la struttura molecolare prevista. Di che struttura molecolare si tratta?
Soluzione
[modifica | modifica sorgente]La struttura molecolare è lineare.
Esercizio 7
[modifica | modifica sorgente]Costruisci una molecola più complessa nel simulatore. Identificare la geometria del gruppo elettronico, la struttura molecolare e gli angoli di legame. Quindi prova a trovare una formula chimica che corrisponda alla struttura che hai disegnato.
Soluzione
[modifica | modifica sorgente]Le risposte varieranno. Ad esempio, un atomo con quattro legami singoli, un doppio legame e una coppia solitaria ha una geometria del gruppo elettronico ottaedrico e una struttura molecolare piramidale quadrata. XeOF4 è una molecola che adotta questa struttura.
Polarità molecolare e momento dipolare
[modifica | modifica sorgente]Come discusso in precedenza, i legami covalenti polari collegano due atomi con diversa elettronegatività, lasciando un atomo con una carica parzialmente positiva (δ+) e l’altro atomo con una carica parziale negativa (δ–), poiché gli elettroni vengono attratti verso l’atomo più elettronegativo. . Questa separazione di carica dà origine ad un momento di dipolo di legame . L'entità del momento di dipolo di un legame è rappresentata dalla lettera greca mu ( µ ) ed è data dalla formula qui mostrata, dove Q è l'entità delle cariche parziali (determinata dalla differenza di elettronegatività) e r è la distanza tra le cariche :
Questo momento di legame può essere rappresentato come un vettore, una quantità avente sia direzione che grandezza ( Figura sotto). I vettori dipolo sono mostrati come frecce che puntano lungo il legame dall'atomo meno elettronegativo verso l'atomo più elettronegativo. Viene disegnato un piccolo segno più sull'estremità meno elettronegativa per indicare l'estremità parzialmente positiva del legame. La lunghezza della freccia è proporzionale all'entità della differenza di elettronegatività tra i due atomi.

Un'intera molecola può anche avere una separazione di carica, a seconda della sua struttura molecolare e della polarità di ciascuno dei suoi legami. Se esiste una tale separazione di carica, si dice che la molecola è una molecola polare (o dipolo); altrimenti la molecola si dice non polare. Il momento dipolare misura l'entità della separazione netta di carica nella molecola nel suo insieme. Determiniamo il momento di dipolo sommando i momenti di legame nello spazio tridimensionale, tenendo conto della struttura molecolare.
Per le molecole biatomiche, esiste un solo legame, quindi il suo momento dipolare di legame determina la polarità molecolare. Le molecole biatomiche omonucleari come Br2 e N2 non hanno differenze di elettronegatività, quindi il loro momento dipolare è zero. Per le molecole eteronucleari come la CO, c'è un piccolo momento dipolare. Per HF, c'è un momento di dipolo maggiore perché c'è una maggiore differenza di elettronegatività.
Quando una molecola contiene più di un legame, è necessario tener conto della geometria. Se i legami in una molecola sono disposti in modo tale che i loro momenti di legame si annullano (la somma vettoriale è uguale a zero), allora la molecola è non polare. Questa è la situazione della CO2 ( Figura 4.27 ). Ciascuno dei legami è polare, ma la molecola nel suo insieme è non polare. Dalla struttura di Lewis e utilizzando la teoria VSEPR, determiniamo che la molecola di CO2 è lineare con legami polari C=O sui lati opposti dell'atomo di carbonio. I momenti di legame si annullano perché sono rivolti in direzioni opposte. Nel caso della molecola d'acqua ( Figura sotto), la struttura di Lewis mostra ancora una volta che ci sono due legami con un atomo centrale, e la differenza di elettronegatività mostra ancora una volta che ciascuno di questi legami ha un momento di legame diverso da zero. In questo caso, però, la struttura molecolare è piegata a causa delle coppie solitarie sull’O, e i due momenti di legame non si annullano. Pertanto, l'acqua ha un momento dipolare netto ed è una molecola polare (dipolo).

La molecola dell'OCS ha una struttura simile alla CO2, ma un atomo di zolfo ha sostituito uno degli atomi di ossigeno. Per determinare se questa molecola è polare, disegniamo la struttura molecolare. La teoria VSEPR prevede una molecola lineare:
Il legame CO è notevolmente polare. Sebbene C e S abbiano valori di elettronegatività molto simili, S è leggermente più elettronegativo di C, e quindi il legame CS è solo leggermente polare. Poiché l'ossigeno è più elettronegativo dello zolfo, l'estremità dell'ossigeno della molecola è l'estremità negativa.
Il clorometano, CH3Cl, è una molecola tetraedrica con tre legami CH leggermente polari e un legame C-Cl più polare. L'elettronegatività relativa degli atomi legati è H < C < Cl, quindi i momenti di legame puntano tutti verso l'estremità Cl della molecola e si sommano per produrre un considerevole momento dipolare (le molecole sono relativamente polari).
Per molecole ad alta simmetria come BF3 (trigonale planare), CH4 (tetraedrico), PF5 (bipiramidale trigonale) e SF6 (ottaedrico), tutti i legami hanno la stessa polarità (stesso momento di legame) e sono orientati in geometrie che producono molecole non polari (il momento dipolare è zero). Molecole con minore simmetria geometrica, tuttavia, possono essere polari anche quando tutti i momenti di legame sono identici. Per queste molecole, le direzioni dei momenti di legame uguali sono tali che si sommano per dare un momento di dipolo diverso da zero e una molecola polare. Esempi di tali molecole includono idrogeno solforato, H2S (non lineare), e ammoniaca, NH3 (piramidale trigonale).

Riassumendo, per essere polare, una molecola deve:
- Contengono almeno un legame covalente polare.
- Hanno una struttura molecolare tale che la somma dei vettori di ciascun momento dipolare di legame non si annulla.
Esercizi
[modifica | modifica sorgente]https://openstax.org/books/chemistry-atoms-first-2e/pages/4-exercises
Fonte
[modifica | modifica sorgente]https://openstax.org/books/chemistry-atoms-first-2e/pages/4-6-molecular-structure-and-polarity