Chimica per il liceo/L'atomo
Le prime teorie atomiche
[modifica | modifica sorgente]
Il primo sostenitore conosciuto di qualcosa che somigliasse alla moderna teoria atomica fu l'antico pensatore greco Democrito (V sec. a.c.) . Propose l'esistenza degli atomi indivisibili come risposta alle argomentazioni di Parmenide e ai paradossi di Zenone.
Democrito infatti postulò l'esistenza di atomi indistruttibili che esistono nel vuoto. Propose 5 punti per la sua teoria degli atomi:
- Tutta la materia è composta da atomi, che sono pezzetti di materia troppo piccoli per essere visti. Questi atomi non possono essere ulteriormente suddivisi in porzioni più piccole.
- C'è un vuoto, che è lo spazio vuoto tra gli atomi.
- Gli atomi sono completamente solidi.
- Gli atomi sono omogenei, senza struttura interna.
- Gli atomi sono diversi per dimensione, forma e peso.
L'alchimia
[modifica | modifica sorgente]
Empedocle (V sec. a.c.) propose che esistessero quattro elementi, aria, terra, acqua e fuoco e che tutto il resto fosse una miscela di questi. Questa credenza era molto popolare nel Medioevo e introdusse la scienza dell'alchimia. L'alchimia si basava sulla convinzione che, poiché ogni cosa era composta da soli quattro elementi, si potesse trasmutare una miscela in un'altra miscela dello stesso tipo. Ad esempio, si credeva che il piombo potesse essere trasformato in oro.
La teoria dell'alchimia fu confutata, con diversi esperimenti chimici, da Antoine Lavoisier.
Lavoisier affermò anche che la combustione non era un elemento, ma era invece una reazione chimica tra un carburante e l'ossigeno.
La moderna teoria atomica (John Dalton)
[modifica | modifica sorgente]
La moderna teoria atomica nacque con Dalton quando pubblicò le sue teorie nel 1803. La sua teoria si compone di cinque punti importanti, che sono considerati per lo più veri oggi:
- Gli elementi sono composti da minuscole particelle chiamate atomi.
- Tutti gli atomi di un dato elemento sono identici.
- Gli atomi di un dato elemento sono diversi da quelli di qualunque altro elemento; gli atomi di elementi diversi possono essere distinti l'uno dall'altro in base ai rispettivi pesi relativi.
- Gli atomi di un elemento possono combinarsi con atomi di altri elementi per formare composti chimici; un dato composto ha sempre lo stesso numero relativo di tipi di atomi.
- Gli atomi non possono essere creati, divisi in particelle più piccole, né distrutti nel processo chimico; una reazione chimica cambia semplicemente il modo in cui gli atomi sono raggruppati insieme.
Ora sappiamo che gli elementi hanno isotopi diversi, che hanno pesi leggermente diversi. Inoltre, le reazioni nucleari possono dividere gli atomi in parti più piccole (ma le reazioni nucleari non sono realmente considerate reazioni chimiche ). Altrimenti, la sua teoria è valida ancora oggi.
La classificazione degli atomi (Dmitri Mendeleev)
[modifica | modifica sorgente]Alla fine del 1800, allo scienziato russo Dmitri Mendeleev fu attribuita la creazione di una delle prime tavole periodiche organizzate. Organizzando ogni elemento in base al peso atomico, catalogò ciascuno dei 56 elementi scoperti all'epoca. Oltre al peso atomico, organizzò la sua tabella anche per raggruppare gli elementi in base alle proprietà conosciute.
Mentre scriveva una serie di libri di testo, Mendeleev si rese conto che non aveva più spazio per trattare ogni elemento individualmente. Iniziò a "riportare" regolarmente gli elementi sulla riga successiva e a creare quella che oggi viene chiamata la tavola periodica degli elementi. Utilizzando la sua tabella, predisse l'esistenza di elementi scoperti successivamente, come il gallio e il germanio secondo modelli trovati in precedenza. Le sue previsioni furono un successo, dimostrando che la sua tabella era eccezionalmente accurata. Teorie successive, quelle degli elettroni attorno all'atomo, spiegano perché gli elementi dello stesso periodo, o gruppo, hanno proprietà chimiche simili. I chimici avrebbero successivamente organizzato ogni elemento in base al numero atomico, non al peso atomico, dando origine alla moderna tavola periodica degli elementi .
-
La prima tavola periodica di Mendeleev
-
Mendeleev
Il primo modello atomico (JJ Thomson)
[modifica | modifica sorgente]Scoperta dell'elettrone
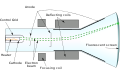
[modifica | modifica sorgente]Nel 1889 il fisico britannico JJ Thomson scoprì l'elettrone. Thomson ha condotto una serie di esperimenti utilizzando il tubo a raggi catodici . I raggi catodici sono costruiti sigillando due elettrodi in un tubo di vetro collegato ad un alimentatore e ad una pompa a vuoto che rimuove l'aria da esso. Quando gli elettrodi sono collegati ad un'alta tensione di circa 15.000 V e a una bassa pressione, un raggio di radiazione viene emesso dall'elettrodo negativo (catodo) che si muove verso l'elettrodo positivo (anodo). Questi raggi sono chiamati raggi catodici. Da esperimenti fatti si osservò che sono in grado di far girare una ruota a pale che si muove liberamente e che vengono deviati da un campo magnetico ed elettrico. Thomson concluse che questi raggi sono costituiti da particelle caricate negativamente; oggi li chiamiamo elettroni.
Il modello atomico "Plum Pudding"
[modifica | modifica sorgente]Subito dopo la scoperta dell'elettrone, Thomson iniziò a speculare sulla natura dell'atomo. Ha suggerito un modello a "panettone" (letteralmente un "tortino di prugne"). In questo modello i pezzetti di "uvetta" erano gli elettroni che fluttuavano in una pasta di carica positiva per corrispondere a quella degli elettroni e formare un atomo elettricamente neutro. Un esempio moderno di questa idea sarebbe un biscotto con gocce di cioccolato, con i frammenti che rappresentano gli elettroni caricati negativamente e l’impasto che rappresenta la carica positiva.
-
Schema di un tubo catodico
-
J.J. Thomson
-
Il modello atomico di Thomson
-
Nel modello a "panettone" l'uvetta rappresenterebbe gli elettroni
-
plum pudding
-
Il tubo catodico di Crooks
-
I raggi catadici vengono deviati da un campo magnetico
-
II raggi catodici posso far girare un mulinello
Il modello di Rutherford
[modifica | modifica sorgente]Scoperta del protone
[modifica | modifica sorgente]Scoperto da Ernest Rutherford nel 1919 il nome "protone" venne introdotto nel 1920 dallo stesso Rutherford come "proton" (in inglese), basandosi sul termine πρῶτον (pròton) del greco antico, un superlativo di genere neutro che significa "che è dinanzi a tutti, il primo". Grazie a questa nuova conoscenza e ai suoi esperimenti sulla lamina d'oro formulò un nuovo modello atomico a "planetario".
Ernest Rutherford è noto inaftti per il suo famoso esperimento sulla lamina d'oro nel 1911. Le particelle alfa, che sono pesanti e caricate positivamente (in realtà, nuclei di elio, ma non è questo il punto), furono sparate su uno strato molto sottile d'oro. La maggior parte delle particelle alfa sono passate direttamente attraverso, come previsto. Secondo il modello del budino di prugne tutte le particelle avrebbero dovuto rallentare mentre passavano attraverso il "budino", ma nessuna avrebbe dovuto essere deviata. Sorprendentemente, alcune particelle alfa furono deviate indietro nel modo in cui erano arrivate. Ha affermato che era "come se avessi sparato un proiettile da 15 pollici contro un pezzo di carta velina e questo fosse tornato indietro e ti avesse colpito".
-
Sir Rutherford
-
L'esperimento di Rutherford
-
Sinistra: ipotizzata. Destra: osservata.
-
Sopra: risultati ipotizzati. Sotto: osservati
-
Il modello planetario di Rutherford
Il modello planetario
[modifica | modifica sorgente]Il risultato dell'esperimento permise a Rutherford di concludere che il modello del budino di prugne è sbagliato.
- Gli atomi hanno un nucleo, molto piccolo e denso, contenente la carica positiva e gran parte della massa dell'atomo.
- L'atomo è costituito principalmente da spazio vuoto.
- Gli elettroni sono attratti dal nucleo, ma rimangono molto al di fuori di esso.
Questo modello è chiamato anche Modello Planetario.
Il modello però non spiegava perché gli elettroni non collassassero nel nucleo perdendo energia man mano che ruotavano attorno ad esso.
La doppia natura corpuscolare e ondulatoria della luce e dell'elettrone
[modifica | modifica sorgente]Tra l'800 e '900 emersero sempre più evidenti la doppia natura corpuscolare e ondulatoria della luce e dell'elettrone. Si scoprì anche che gli atomi potevano assorbire ed emettere fotoni con precisa lunghezza d'onda, c'era quindi un collegamento anche tra luce ed elettrone. Il modello di Bohr afferma anche questo. L'attuale modello quantomeccanico si basa su una funzione d'onda formulata da Schrodinger (vedi sotto).
Doppia natura della luce
[modifica | modifica sorgente]Natura ondulatoria: la luce è formata da onde elettromagnetiche (con una certa frequenza e lunghezza d'onda), e più in generale si parla di spettro elettromagnetico, di cui fa parte la luce visibile (vedi schema). Un'onda elettromagnetica è descritta da una lunghezza d'onda (λ), una frequenza (ν) e dalla relazione dove v è la velocità della luce nel vuoto ed è costante. Fenomeni che dimostrano la sua natura ondulatoria sono: la riflessione, la rifrazione, la diffrazione (tipici di qualsiasi fenomeno ondulatorio, anche delle onde del mare).
A proposito della natura ondulatoria della luce, le onde elettromagnetiche possono essere classificate in base alla lunghezza d'onda o alla frequenza (è la stessa cosa, i due parametri sono legati dalla formula λ • ν = c , dove c = velocità della luce).

- Onde radioː hanno una lunghezza d'onda molto grande (da m a km), molto usate per le trasmissioni radio
- Microonde (λ mm-cm)ː sono famose poiché usate nei forni a microonde per cucinare. Vengono anche usate per le comunicazioni telefoniche e WiFi. Sono sospettate di essere pericolose per la salute umana, per cui i forni sono schermati e i cellulari hanno dei limiti di legge.
- Infrarossoː si chiamano così poiché si trovano subito dopo le radiazioni che danno il colore rosso. I raggi infrarossi corrispondono al calore radiante, infatti tutti i corpi caldi li emettono in significativa quantità. I dispositivi a infrarossi (es. occhiali, visori, binocoli...) sono in grado di percepirli (i nostri occhi no). Esistono lampade a infrarossi usate per riscaldare porzioni di ambienti (senza riscaldare tutto l'ambiente).
- Visibileː (λ 0,4-0,7 micrometri)ː è l'intervallo di frequenze percepito dall'occhio umano, con tutti i colori dell'arcobaleno.
- Ultraviolettoː si chiamano così perché si trovano dopo il viola del visibile. Si tratta di raggi pericolosi, in buona parte schermati dall'atmosfera (ne arriva l'1 per cento); sono responsabili dell'abbronzatura della pelle che si pigmenta per bloccarli in quanto sono mutageni.
- Raggi Xː sono famosi perché usati in medicina per fare le radiografie (in piccolissime dosi non pericolose) e osservare problematiche alle ossa. Sono pericolosi per la salute umana in quanto mutageni.
- Raggi gammaː molto pericolosi per la salute umana (mutageni) ma sono prodotti da reazioni nucleari e normalmente non ne abbiamo a che fare.
Natura corpuscolare: la luce si può considerare come formata da "pacchetti" di energia chiamati fotoni, aventi energia (costante di Planck h = 6,626 * 10-34). La sua natura corpuscolare può essere dimostrata dall'effetto fotoelettrico. L'effetto fotoelettrico è quel fenomeno per cui una superficie, solitamente metallica, emette elettroni quando questa viene colpita da una radiazione elettromagnetica.
Doppia natura dell'elettrone
[modifica | modifica sorgente]Natura corpuscolare: l'elettrone fin dall'inizio, dalla scoperta di Thomson, fu considerato come formato da particelle cariche negativamente, tant'è che si calcolò anche la sua massa.
Natura ondulatoria: successivamente si capì che anche l'elettrone, come la luce, aveva una doppia natura. Le figure di diffrazione ottenute con i fotoni confermarono questa ipotesi. Schrodinger formulò la sua famosa funzione d'onda (vedi sotto) pensando proprio agli elettroni come onde.
-
La rifrazione della luce dimostra la sua natura ondulatoria
-
Lo spettro elettromagnetico della luce
-
L'effetto fotoelettrico dimostra la natura corpuscolare della luce (fotone)
-
I pannelli fotovoltaici sfruttano l'effetto fotoelettrico
-
Figura di interferenza della luce
-
Esperimento di diffrazione degli elettroni, dimostra la sua natura ondulatoria
Il modello di Bohr e lo spettro di emissione/assorbimento
[modifica | modifica sorgente]Niels Bohr creò il proprio modello dell'atomo, migliorando quello di Rutherford. Bohr usò un'equazione sviluppata da Rydberg che forniva una relazione matematica tra le linee spettrali visibili dell'atomo di idrogeno. L'equazione richiede che le lunghezze d'onda emesse dall'atomo di idrogeno siano correlate alla differenza di due numeri interi. Bohr teorizzò che questi numeri interi rappresentassero "gusci" o "orbite" in cui gli elettroni viaggiano attorno al nucleo, ciascuno con un certo livello di energia. Le orbite sono stazionarie e non perdono energia. L'energia di un'orbita è proporzionale alla sua distanza dal nucleo. Un atomo assorbirà e rilascerà fotoni che hanno una quantità specifica di energia. L'energia è il risultato del salto di un elettrone in un livello diverso. Partendo dall'equazione di Rydberg, insieme al lavoro di Planck e Einstein sulla relazione tra luce ed energia, Bohr riuscì a derivare un'equazione per calcolare l'energia di ciascuna orbita nell'atomo di idrogeno. Il modello di Bohr descrive l'atomo come un nucleo con gli elettroni che orbitano attorno ad esso a distanze specifiche. L'assorbimento di un fotone da parte di un elettrone determina (se l'energia del fotone è adeguata) un salto dell'elettrone ad un'"orbita" più esterna. Successivamente l'elettrone ritornerà alla sua "orbita" originaria emettendo lo stesso fotone che aveva assorbito. In pratica l'atomo di un certo elemento assorbe ed emette fotoni della stessa frequenza (o lunghezza d'onda). Gli atomi di un elemento (es. idrogeno) quindi si possono riconoscere in base allo spettro di assorbimento o di emissione. Un elemento allo stato gassoso ma relativamente "freddo" è in grado di assorbire determinate lunghezze d'onda determinando uno spettro di assorbimento (per ottenere lo spettro di assorbimento serve ovviamente un corpo ad alta temperatura solido, liquido o gassoso ad alta densità che fornisca lo spettro continuo). Se invece l'elemento allo stato gassoso si trova ad alte temperature o viene eccitato tende ad fornire uno spettro di emissione. Le righe di assorbimento e di emissione sono le stesse. Vedi in galleria esempi di spettri di emissione o di assorbimento.
Il modello di Bohr però spiegava solo l'idrogeno e non gli altri elementi.
-
Niels Bohr
-
Modello atomico di Bohr
-
Le onde stazionarie non perdono energia
-
Modello atomico di Bohr
-
Spettro dell'idrogeno (serie di Balmer)
-
Spettro di emissione del Ferroː avendo molti elettroni, il ferro può emettere o assorbire moltissime lunghezze d'onda
-
Le linee di Fraunhofer è lo spettro di assorbimento che si osserva nella luce solare. (C = H; D1 e D2 = Na; E = Fe; F = H; G = Ca/Fe)
-
Spettro di emissione e di assorbimento dello stesso elemento
-
Gli spettri di assorbimento servono per capire la composizione chimica di corpi celesti
-
L'atmosfera di un esopianeta contiene sodio
Robert Millikan
[modifica | modifica sorgente]Robert Millikan determinò il valore della carica dell'elettrone per cui vinse il Premio Nobel nel 1923.
La moderna struttura atomica
[modifica | modifica sorgente]
L’atomo è l’unità fondamentale della materia e tutti gli atomi sono formati dalle stesse particelle subatomiche. Quindi un atomo è formato da:
- una zona centrale detta nucleo: costituito da protoni (particelle dotate di massa e carica positiva) e neutroni (particelle neutre dotate di una massa paragonabile a quella dei protoni); la carica positiva vale per convenzione +1. Particolarmente importante è il numero di protoni (le uniche particelle ad avere sia massa che carica) poiché definisce il tipo di atomo, ovverosia l'elemento, e viene indicato come numero atomico. In genere il numero di neutroni è simile (a volte uguale) al numero di protoni. Protoni e neutroni, avendo una massa significativa, definiscono la massa dell'atomo. La loro somma si chiama numero di massa.
- spazio attorno dove si muovono gli elettroni (particelle con carica negativa e massa trascurabile rispetto a quella di un protone o di un neutrone). La carica di un elettrone è uguale e opposta a quella di un protone e vale -1. Se Il numero di elettroni eguaglia il numero di protoni l’atomo è neutro, in quanto le cariche opposte si annullano a vicenda. Un atomo è in grado di perdere o prendere elettroni e quindi di variare la sua carica elettrica.
Il nucleo è molto piccolo rispetto alle dimensioni dell'atomo: se un nucleo fosse grande come una biglia in mezzo ad un campo da calcio, gli elettroni si muoverebbero negli spalti.
Le varie specie atomiche differiscono, in primo luogo, per il numero atomico e sono ordinate in tavola periodica (vedi figura) secondo il numero atomico crescente.
E’ intuibile che all’aumentare del numero dei protoni cresce in misura pressoché proporzionale anche il numero dei neutroni: se, però, il numero dei protoni è esclusivo di una determinata specie atomica, il numero dei neutroni può variare nell’ambito della stessa specie atomica. Atomi della stessa specie con diverso numero di massa vengono denominati isotopi (dal greco ίσος τόπος, stesso luogo). Vediamo degli esempi:
- l'idrogeno. Il nucleo dell’idrogeno è, di fatto, un protone e, quindi, nella sua costituzione non dovrebbe rientrare alcun neutrone: in natura, tuttavia, esiste una piccola percentuale di deuterio e in laboratorio si può sintetizzare il trizio che presentano rispettivamente un neutrone e due neutroni. 1H idrogeno propriamente detto, quello più comune 2H deuterio 3H trizio Il numero in alto a sinistra rispetto al simbolo rappresenta il numero di massa, comprensivo, come si è detto, del numero atomico, che per l’idrogeno è uno: possiamo, quindi, verificare che l'isotopo dell’idrogeno più comune (99,9%) non presenta alcun neutrone a costituire il proprio nucleo, il deuterio (0,01%) ne presenta uno e il trizio (sintetico) due.
- il carbonio 12C 13C 14C. Il carbonio - 12 (98,9%) ha un nucleo costituito da sei protoni e sei neutroni, il carbonio – 13 (1,1%) ha sette neutroni mentre il carbonio - 14 (tracce) presenta otto neutroni: quest’ultimo è l’isotopo più pesante del carbonio ed è radioattivo.
Il modello quantistico
[modifica | modifica sorgente]La scoperta della doppia natura corpuscolare e ondulatoria dell'elettrone permisero a Schrodinger di formulare una teoria atomica basata proprio su questo.
Gli elettroni possono essere pensati come onde di una certa lunghezza, quindi sarebbero in grado di formare un cerchio attorno al nucleo solo a determinate distanze multiple della lunghezza d'onda. Naturalmente, questo solleva un problema: gli elettroni sono particelle in una posizione specifica o le onde in un'area generale? Werner Heisenberg tentò di utilizzare i fotoni per localizzare gli elettroni. Naturalmente, quando i fotoni raggiungono gli elettroni, gli elettroni cambiano velocità e si spostano in uno stato eccitato. Di conseguenza, è impossibile misurare con precisione la velocità e la posizione di un elettrone allo stesso tempo. Questo è noto come effetto osservatore . Questo viene spesso confuso con il Principio di Indeterminazione di Heisenberg, che va ancora oltre, affermando che ci sono limiti al grado in cui sia la posizione che la quantità di moto di una particella possono essere conosciute. Ciò è dovuto al fatto che gli elettroni non possono mostrare contemporaneamente le loro proprietà ondulatorie e corpuscolari quando vengono osservati mentre interagiscono con l'ambiente circostante. La quantità di moto di un elettrone è proporzionale alla sua velocità, ma basata sulle sue proprietà ondulatorie; la sua posizione è basata sulla posizione delle sue particelle nello spazio. Il principio di indeterminazione di Heisenberg è una sorta di dilemma scientifico: più conosci la velocità di qualcosa, meno conosci la sua posizione; e più sai della sua posizione, meno sai della sua velocità. Il significato di questa incertezza è che non si può mai sapere esattamente dove si trovano gli elettroni di un atomo, ma solo dove è più probabile che si trovino.
La funzione d'onda
[modifica | modifica sorgente]Se non possiamo mai sapere esattamente dove si trova un elettrone, allora come facciamo a sapere il modo in cui orbitano attorno agli atomi? Erwin Schrödinger ha sviluppato il modello quantomeccanico, che descrive il comportamento dell'elettrone come un'onda in un dato sistema. Può essere utilizzato per calcolare la probabilità che un elettrone venga trovato in una determinata posizione. Non sai esattamente dove si trova l'elettrone, ma sai dove è più probabile e dove meno probabile trovarlo. In un atomo, la funzione d'onda può essere utilizzata per modellare una forma, chiamata orbitale, che contiene l'area all'interno della quale è più probabile che si trovi un elettrone.
Si riporta, per curiosità, l'equazione di Schrödinger. Nel caso più generale l'equazione è scritta come:
dove:
- è l'unità immaginaria;
- è un punto nello spazio tridimensionale;
- è la funzione d'onda, cioè l'ampiezza di probabilità per differenti configurazioni del sistema;
- è la costante di Planck ridotta, cioè divisa per ;
- è l'operatore hamiltoniano, che ha la proprietà di essere Matrice hermitiana.
Gli orbitali atomici
[modifica | modifica sorgente]Impareremo ora a conoscere i gusci, i sottogusci e gli orbitali in cui si trovano gli elettroni.
Ogni elettrone in orbita in un atomo ha una serie di quattro numeri che lo descrivono. Questi numeri in qualche modo derivano dall'equazione di Schrodinger. Questi sono chiamati numeri quantici, descrivono l'orbita dell'elettrone attorno al nucleo. Ogni elettrone in un atomo ha un insieme unico di numeri e i numeri cambieranno se l'orbita dell'elettrone viene alterata. Gli esempi sono se si verifica un legame o se un elettrone viene energizzato in un'orbita ad alta energia.
Questi quattro numeri sono usati per descrivere la posizione di un elettrone in un atomo.
| Number | Symbol | Possible Values | cosa definisce dell'orbitale |
|---|---|---|---|
| Numero quantico principale | dimensione (livello energetico) | ||
| Numero quantico secondario | forma | ||
| Numero quantico magnetico | numero di orbitali e orientamento | ||
| Numero quantico di spin | spin dell'elettrone |
Numero Quantico Principale ( n )
[modifica | modifica sorgente]Determina il guscio (livello energetico) in cui si trova l'elettrone. Il guscio è il componente principale che determina l'energia dell'elettrone ( n più alto corrisponde a un'energia più elevata), nonché la dimensione dell'orbitale, corrispondente alla massima distanza nucleare ( n più alto significa ulteriore distanza possibile dal nucleo). La riga in cui è posizionato un elemento nella tavola periodica indica quanti "gusci" ci saranno. Elio ( n = 1), neon ( n = 2), argon ( n = 3), ecc. Nota che i gusci avranno numeri diversi, come descritto dalla tabella sopra; ad esempio, l'argon conterrà un totale di 3 gusci.
Numero quantico secondario (o del momento angolare) ( l )
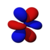
[modifica | modifica sorgente]Conosciuto anche come numero quantico azimutale. Determina il sottoguscio in cui si trova l'elettrone. Ogni sottoguscio ha una forma unica e un nome di lettera. L' orbitale s ha la forma di una sfera e si verifica quando l = 0. Gli orbitali p (ce ne sono tre) hanno la forma di doppio lobo e si verificano quando l = 1. Gli orbitali d (ce ne sono cinque, per lo più quadrilobati) si verificano quando l = 2. L' orbitale f gli orbitali (ce ne sono sette, multilobati) si verificano quando l = 3. (A proposito, quando l = 4, gli orbitali sono "orbitali g", ma essi (e gli orbitali l = 5 "h") possono essere tranquillamente ignorati in chimica generale. I numeri dei sottogusci di ciascun guscio possono essere calcolati utilizzando il numero quantico principale (vedi tabella sopra).
-
orbitale s
-
Orbitale p
-
Orbitale d
-
Orbitale f
-
orbitali dell'idrogeno
Ecco le immagini degli orbitali. Tieni presente che non mostrano il percorso effettivo degli elettroni, a causa del principio di indeterminazione di Heisenberg. Invece, mostrano il volume in cui è più probabile che si trovi l'elettrone, cioè l' ampiezza della probabilità è maggiore. I due colori rappresentano due segni (fasi) della funzione d'onda (la scelta è arbitraria). Ciascuno degli orbitali rappresentati è una sovrapposizione di due m numeri quantici opposti (vedi sotto).
| l | forma | m = 0 | m = -1 and 1 | m = -2 and 2 | m = -3 and 3 |
|---|---|---|---|---|---|
| 0 | s → | 
|
|||
| 1 | p → | 
|
 
|
||
| 2 | d → | 
|
 
|
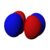 
|
|
| 3 | f → | 
|
|
 
|
 
|
Numero quantico magnetico (ml)
[modifica | modifica sorgente]Il numero quantico magnetico determina quanti sono gli orbitali di un certo sottoguscio (es. gli orbitali p) e come sono orientati (es. i tre orbitali p sono orientati secondo i tre assi x, y, z). Gli orbitali in ciascuna sottozona hanno tutti lo stesso livello energetico. La tabella sottostante riassume i vari tipi di orbitali a seconda dei valori di n, l e ml.

|
||||||||||||||||

|

|

|

|
|||||||||||||

|

|

|

|

|

|

|

|

|
||||||||

|

|

|

|
|
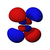
|
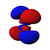
|

|

|
||||||||

|

|
|

|

|

|

|

|

|
- | - | - | - | - | - | - | |

|

|

|

|
- | - | - | - | - | - | - | - | - | - | - | - | |

|
- | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Numero quantico di spin ( ms )
[modifica | modifica sorgente]Determina lo spin (rotazione) dell'elettrone. +½ corrisponde alla freccia su in una casella di configurazione elettronica. Se nell'orbitale è presente un solo elettrone (una freccia in un riquadro), allora viene sempre considerato +½. La seconda freccia, o freccia verso il basso, è considerata -½. Ogni orbitale può contenere un elettrone con "spin up" e un elettrone con "spin down".
Alcuni esempi
[modifica | modifica sorgente]Esaminiamo i numeri quantici degli elettroni di un atomo di magnesio, 12 Mg. Ricorda che ogni lista di numeri corrisponde a ( n, l, ml , m s ) .
| Due elettroni s: | (1, 0, 0, +½) | (1, 0, 0, -½) | ||||
| Due elettroni s: | (2, 0, 0, +½) | (2, 0, 0, -½) | ||||
| Sei elettroni p: | (2, 1, -1, +½) | (2, 1, -1, -½) | (2, 1, 0, +½) | (2, 1, 0, -½) | (2, 1, 1, +½) | (2, 1, 1, -½) |
| Due elettroni s: | (3, 0, 0, +½) | (3, 0, 0, -½) |
La tavola periodica
[modifica | modifica sorgente]
Osservare uno schema della tavola periodica . Aree diverse, o blocchi, hanno diversi tipi di elettroni. Le due colonne a sinistra formano il blocco s (corrispondono al riempimento degli orbitali s). Le sei colonne a destra costituiscono il blocco p (corrispondono al riempimento degli orbitali p). L'ampia area al centro (metalli di transizione) costituisce il blocco d (corrispondono al riempimento degli orbitali d). La porzione inferiore costituisce il blocco f (Lantanidi e Attinidi). Ogni riga introduce un nuovo guscio (ovvero il livello di energia).
Riempimento dei gusci elettronici (configurazione elettronica)
[modifica | modifica sorgente]Quando un atomo o uno ione riceve elettroni nei suoi orbitali, gli orbitali e i gusci si riempiono in un modo particolare.
Principio di Aufbau (di "costruzione")
[modifica | modifica sorgente]Si può considerare un atomo come "costruito" a partire da un nucleo nudo aggiungendovi gradualmente un protone e un elettrone dopo l'altro, finché non saranno stati aggiunti tutti gli elettroni che conterrà. Proprio come si riempie un contenitore di liquido dal basso verso l'alto, gli orbitali di un atomo vengono riempiti dagli orbitali a energia più bassa fino a quelli a energia più alta.
Orbitali con il numero quantico principale più basso (n) hanno l'energia più bassa e si riempiranno per primi, in atomi più piccoli. Gli atomi più grandi con più sottogusci sembreranno riempirsi "fuori ordine", poiché gli altri fattori che influenzano l'energia orbitale diventano importanti. All'interno di un guscio possono esserci più orbitali con lo stesso numero quantico principale. In tal caso dovranno essere applicate norme più specifiche. Ad esempio, i tre orbitali p di un dato guscio si trovano tutti allo stesso livello energetico. Allora, come vengono riempiti? Risposta: tutti e tre gli orbitali p hanno la stessa energia, quindi mentre riempiamo gli orbitali p possiamo riempire per primo uno qualsiasi dei Px, Py o Pz. È una convenzione che abbiamo scelto di riempire prima Px, poi Py e poi Pz per semplicità. Quindi puoi optare per riempire questi tre orbitali anche da destra a sinistra. Il principio dell’Aufbau afferma genericamente che “gli orbitali atomici sono riempiti di elettroni in ordine crescente di livello energetico” (NBː il termine "principio di Aufbau" può essere anche riferito alla regola della diagonale, vedo più sotto).
Regola di Hund
[modifica | modifica sorgente]Secondo la regola di Hund, gli orbitali della stessa energia vengono riempiti ciascuno con un elettrone prima di riempirne uno qualsiasi con un secondo. Inoltre, questi primi elettroni hanno lo stesso spin. Questa regola è talvolta chiamata "regola dei posti a sedere sull'autobus". Mentre le persone salgono sull'autobus, ognuno prende il proprio posto, seduto da solo. Solo dopo che tutti i posti saranno stati occupati, le persone inizieranno a raddoppiare.
Principio di esclusione di Pauli
[modifica | modifica sorgente]
Non possono esistere due elettroni che abbiano tutti e quattro i numeri quantici uguali. Ciò che questo si traduce in termini della nostra immagine degli orbitali è che ciascun orbitale può contenere solo due elettroni, uno con "spin verso l'alto" (+½) e uno con "spin verso il basso" (-½).
Ordine di riempimento dell'orbitale
[modifica | modifica sorgente]Questo è l'ordine di riempimento degli orbitali: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
Se ci mettiamo gli elettroni (che vengono scritti come esponente, ma la matematica non c'entra, è solo una convenzione per rappresentare gli elettroni) l'ordine viene scritto in questo modo: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6, 7s2, 5f14, 6d10, 7p6, 8s2. Si legge "uno esse due, due esse due, due pi sei ...", ecc.)
Attenzioneǃ
[modifica | modifica sorgente]Alcuni autori (ad es. in alcuni testi scolastici, o ad es. nella pagina dedicata di wikipedia in tedesco e in inglese) viene indicato, una volta trovato gli orbitali e gli elettroni coinvolti, di scrivere gli orbitali in ordine di numero quantico principale (quantomeno gli orbitali del guscio esterno), quindi, ad un certo punto, non si seguirebbe più il principio di Aufbau. Questa modalità enfatizzerebbe gli elettroni più esterni e quindi quelli che più sono coinvolti nei legami chimici.
Come ricordare l'ordine di riempimento
[modifica | modifica sorgente]Le tavole periodiche più complete riportano anche la configurazione elettronica. Altrimenti ci sono due modi per ricordare l'ordine:

- Regola della diagonale (detto anche Principio di Aufbau o regola di Madelung): basta costruire il diagramma a lato e procedere in diagonale, in ordine delle righe dall'alto al basso, dall'estremità superiore destra all'estremità inferiore sinistra di ciascuna riga. Per essere più precisi gli orbitali con un valore n + l inferiore vengono riempiti prima di quelli con valori n + l superiori (nei casi di valori n + l uguali, l'orbitale con un valore n inferiore viene riempito per primo).
- Con la tavola periodica: se si ha a disposizione una tavola periodica (ovviamente senza la configurazione elettronica), l'ordine di riempimento si può ricavare, partendo dall'idrogeno, seguendo il numero atomico fio ad arrivare all'elemento considerato, e osservando i blocchi (s, p, d, f) che vengono attraversati, tenendo presente che quando si arriva al blocco d si scala di uno e al blocco f si scala di due.
Questi metodi si comprendono meglio se si guarda un video che spiega operativamente come funzionano, basta cercare "configurazione elettronica" su Youtube).
Come scrivere la configurazione elettronica di un atomo isolato
[modifica | modifica sorgente]La notazione della configurazione elettronica è relativamente semplice. Un atomo di calcio isolato 20Ca, ad esempio, avrebbe la configurazione di 1s2, 2s2, 2p6, 3s2, 3p6, 4s2 nel suo stato fondamentale . Sono possibili altre configurazioni come 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 4p1 ma questi stati eccitati hanno un'energia più elevata. Non sono stabili e generalmente esistono solo per un breve momento.
La configurazione dello stato fondamentale del Ca potrebbe essere abbreviata utilizzando il gas nobile precedente (gli elementi che si trovano all'estrema destra della tavola periodica) come [Ar]4s2, dove Ar è argon.
I gas nobili hanno configurazioni molto stabili e sono estremamente riluttanti a perdere o acquistare elettroni. Gli atomi di gas nobili sono anche gli unici che si trovano regolarmente come atomi isolati nello stato fondamentale. Gli atomi di altri elementi sono coinvolti tutti in legami nelle condizioni in cui viviamo e questo influenza gli orbitali in cui si trovano gli elettroni più esterni. In questo senso le configurazioni elettroniche per gli altri elementi sono in qualche modo ipotetiche: incontrare un atomo isolato di, ad esempio, tungsteno (W), dovremmo prima vaporizzare un metallo che bolle a 5800K. Tuttavia, conoscere le configurazioni atomiche è utile perché ci aiuta a capire come e perché si legano, cioè perché e come cambiano la configurazione dei loro elettroni di valenza esterna .
Configurazione elettronica rappresentata con quadratini e freccette
[modifica | modifica sorgente]
Un altro modo di rappresentare la configurazione elettronica è quello di usare quadratini e freccetteː il quadratino rappresenta un orbitale, la freccia un elettrone, il verso della freccia lo spin dell'elettrone.
Regola di stabilità
[modifica | modifica sorgente]Un sottoguscio è particolarmente stabile se è pieno o mezza pieno. Date due configurazioni, l'atomo "sceglierebbe" quella più stabile.
Esempio: Nella seguente configurazione, Cu: [Ar]4s2, 3d9, il guscio d del rame è a solo un punto dalla stabilità, e quindi un elettrone dal guscio s salta nel guscio d: [Ar]4s13d10 . In questo modo, il guscio d è pieno, ed è quindi stabile, e il guscio s è pieno per metà, ed è anche stabile.
Un altro esempio: il cromo ha una configurazione di [Ar]4s1, 3d5, anche se ti aspetteresti di vedere quattro elettroni d invece di cinque. Questo perché un elettrone s è saltato nell'orbitale d, dando all'atomo due gusci semipieni, molto più stabili dell'orbitale ad con solo quattro elettroni.
La regola di stabilità si applica agli atomi dello stesso gruppo del cromo e del rame.
Se uno di questi atomi è stato ionizzato, cioè perde un elettrone, uscirà dall'orbitale s anziché dall'orbitale d. Ad esempio, la configurazione di Cu + è [Ar]4s 0 3d 10 . Se vengono rimossi più elettroni, proverranno dall'orbitale d.
Magnetismo
[modifica | modifica sorgente]Il magnetismo è un effetto ben noto. È probabile che tu abbia dei magneti in casa. Come già sai, solo alcuni elementi sono magnetici. Le configurazioni elettroniche del guscio esterno aiutano a spiegare il perché.
Il diamagnetismo è una debole repulsione ai campi magnetici. Tutti gli elementi hanno un certo grado di diamagnetismo. Si verifica quando ci sono elettroni accoppiati.
Il paramagnetismo è una debole attrazione ai campi magnetici esterni. Si verifica ogni volta che in un orbitale è presente un elettrone spaiato.
Sia il diamagnetismo che il paramagnetismo sono risposte di spin che agiscono indipendentemente l'uno dall'altro. Ciò porta rispettivamente a repulsione e attrazione piuttosto deboli. Tuttavia, quando si trovano in un solido, possono anche interagire tra loro e rispondere collettivamente e ciò può portare a proprietà piuttosto diverse:
Il ferromagnetismo è il magnetismo permanente che incontriamo nella nostra vita quotidiana. Si verifica quando tutti gli elettroni spaiati hanno lo stesso spin, poiché tendono ad allinearsi nella stessa direzione, provocando una forte attrazione quando esposti a un campo magnetico. Ciò si verifica solo a temperatura ambiente con tre elementi: ferro (Fe), nichel (Ni) e cobalto (Co). Il gadolinio (Gd) è un caso limite, perde il ferromagnetismo a 20 ° C; al di sopra di tale temperatura gli spin cominciano ad agire da soli. Tuttavia, esistono molte leghe e composti che presentano un forte accoppiamento ferromagnetico. Il più forte è il magnete a neodimio con composizione Nd2Fe14B.
Attività
[modifica | modifica sorgente]Versione stampabile. Pdf della pagina.
Esercizi in inglese su OpenStax.org
Esercizi in inglese su Libretexts.org