Laboratorio di chimica in casa/Protossido di azoto
Il protossido di azoto a temperatura e pressione ambiente è un gas incolore, non infiammabile, dall'odore lievemente dolce. la sua formula chimica è N2O, è noto anche come gas esilarante a causa dei suoi effetti euforizzanti.
Proprietà
[modifica | modifica sorgente]

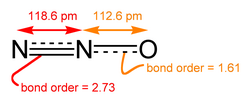
Il monossido di diazoto è un ibrido di risonanza in cui uno degli elettroni passa da un estremo all'altro della molecola (creando un 1,3-dipolo). Ciò contribuisce a smorzare il già debole dipolo elettrico fra azoto e ossigeno (Δχ = 0,4) rendendo la molecola insolubile in acqua (1,5 g/L @ 15 °C). Non forma complessi con cationi metallici.
Gas esilarante
[modifica | modifica sorgente]L'inalazione di protossido di azoto è spesso causa di euforia o confusione. Può altresì produrre nausea e una confusione persistente se l'esposizione è troppo rapida o eccessiva. L'effetto anestetico dell'ossido nitroso non è ben chiarito nei dettagli, ma si pensa che il gas interagisca con le membrane delle cellule nervose del cervello alterando la comunicazione intracellulare a livello delle sinapsi. Viene classificata come droga leggera.
L'ossido di diazoto è utilizzato in anestesia, per ottenere diversi livelli di sedazione, anche se è ampiamente documentata una interazione con la vitamina B12 e conseguente inattivazione di quest'ultima. Se inalato a bassa concentrazione lascia il paziente sveglio, ma con i sensi inibiti, cioè le sensazioni trasmesse al cervello dai cinque sensi appaiono leggermente più deboli ma completamente diverse dal solito (ecco dunque l'effetto psicotropo) e su alcuni individui può causare forte mal di testa; man mano che si aumenta la concentrazione può addirittura indurre sonnolenza e sonno vero e proprio.
L'utilizzo cronico, volontario o accidentale, può provocare polineuropatia e altre degerazioni delle cellule nervose.
Carburante per razzi
[modifica | modifica sorgente]L'ossido di azoto può essere impiegato come comburente nei motori dei razzi. Rispetto ad altri agenti ossidanti ha il vantaggio di non essere tossico, di essere stabile a temperatura ambiente e di essere relativamente facile da stoccare e trasportare in volo.
È il comburente scelto in diversi modelli di motori ibridi per razzi, ibridi perché il combustibile è solido, mentre il comburente è liquido o gassoso. È stato usato spesso in combinazione con un polibutadiene a terminali ossidrilici.
Motori a combustione interna
[modifica | modifica sorgente]Nelle applicazioni motoristiche, l'ossido di diazoto e il carburante del veicolo vengono iniettati nel condotto di aspirazione del motore, che produce i seguenti risultati:
- temperature dell'aria più basse nell'aspirazione (che producono un denso carico di aspirazione);
- aumento dell'ossigeno contenuto nel carico di aspirazione (l'aria ha una percentuale di ossigeno in peso del 20,9%);
Nelle competizioni automobilistiche il protossido di azoto, o semplicemente NOS, è iniettato nel carburatore o immediatamente a monte di esso, per aumentare le capacità respiratorie del motore. Benché di per sé non sia infiammabile, decomponendosi ad alta temperatura fornisce più ossigeno dell'aria, consentendo al motore di bruciare una miscela più ricca di comburente. Inoltre, essendo stoccato in forma liquida, la sua evaporazione nel carburatore provoca un abbassamento della temperatura: questo rende la miscela carburante-comburente più densa e riduce la detonazione. Solitamente, viene inserito in bombole di forma cilindrica comandate da una elettrovalvola che permette l'afflusso del gas a monte del carburatore attraverso l'azionamento di un apposito interruttore.
È illegale utilizzarlo come sovralimentatore chimico per motori su auto stradali.
La stessa tecnica fu impiegata durante la seconda guerra mondiale per aumentare la potenza dei motori degli aerei, soprattutto da parte della Luftwaffe, il cui carburante era mediamente peggiore - in termini di numero di ottano - di quello in dotazione alle forze aeree degli Alleati e per compensare la carenza di ossigeno in alta quota.
La benzina, come tutti i carburanti, per bruciare ha bisogno di un elemento comburente: l'ossigeno, normalmente fornito dall'aria. Mentre l'addizione di un turbo viene chiamata "sovralimentazione meccanica", quella del protossido d'azoto viene definita "sovralimentazione chimica". Adducendo l'ossigeno proveniente dal protossido d'azoto all'aria (e incrementando di conseguenza la portata di combustibile), è possibile ottenere potenze sensibilmente maggiori rispetto all'utilizzo della sola aria. La sovralimentazione chimica aumenta le prestazioni di un veicolo di serie nei limiti degli stress meccanici e termici sopportabili dal propulsore, normalmente nell'ordine del 40%-45%. Per un veicolo progettato per altissime prestazioni si può arrivare a un aumento del 150%.
Sintesi principale
[modifica | modifica sorgente]La più comune via di sintesi dell'ossido di diazoto consiste nel cauto riscaldamento del nitrato di ammonio, che si decompone in ossido di diazoto e vapore acqueo.
- NH4NO3 (s) → 2 H2O (g) + N2O (g)
In queste condizioni il nitrato di ammonio si decompone anche attraverso altre vie, pertanto il gas ottenuto conterrà altri ossidi di azoto. L'aggiunta di fosfati consente di ottenere un gas di purezza lievemente maggiore e operare a temperature inferiori.
La reazione avviene a temperature comprese tra i 170 °C e 240 °C, temperature alle quali il nitrato di ammonio è un esplosivo moderatamente sensibile e un potente ossidante. Oltre i 240 °C la reazione può accelerare e produrre una detonazione disastrosa, è quindi necessario avere sempre la temperatura della reazione sotto controllo. Alcuni impianti chimici ricorrono al vapore surriscaldato come fonte di calore.
La miscela di gas prodotta dalla decomposizione è corrosiva; viene raffreddata per condensarne il vapore acqueo e filtrata per rimuovere gli ossidi superiori dell'azoto ed eventuali trascinamenti di nitrato d'ammonio. Viene infine purificata facendola gorgogliare in tre soluzioni: basica, acida e nuovamente basica.
Sintesi alternative
[modifica | modifica sorgente]È possibile sintetizzarlo anche riscaldando un miscela di solfato di ammonio e nitrato di sodio:
- 2NaNO3 + (NH4)2SO4 → Na2SO4 + 2 N2O + 4H2O.
Il protossido di azoto si forma anche tra la reazione dell'urea con acido nitrico e acido solforico:
- 2(NH2)2CO + 2HNO3 + H2SO4 → 2 N2O + 2CO2 + (NH4)2SO4 + 2H2O.
Sicurezza
[modifica | modifica sorgente]Il protossido di azoto di per sé non è tossico ma un uso prolungato produce sintomi analoghi a quella della carenza di vitamina B12: anemia e neuropatia. Può provocare asfissia se inalato in quantità eccessive. In forma liquefatta può causare ustioni per contatto, dovute alla bassa temperatura.
Video
[modifica | modifica sorgente]Diversi esperimenti per la produzione di N2O
