Chimica organica/Addizione elettrofila al doppio legame carbonio-carbonio
Introduzione
[modifica | modifica sorgente]
| |
| Esempio di sviluppo nello spazio attorno a due nuclei di un orbitale σ e di uno π. | |
In chimica organica viene detta addizione elettrofila una reazione di addizione nella quale un legame π di un composto chimico sia rimpiazzato da due nuovi legami σ. Il legame π in questione è tipicamente quello di un doppio o triplo legame carbonio-carbonio, mentre la specie che si addiziona è una molecola elettrofila.
Per capire perché una molecola elettrofila sia in grado di attaccare gli elettroni di un legame π carbonio-carbonio, senza interagire con gli elettroni del legame σ, è necessario avere presente quale sia la direzione lungo la quale si sviluppano i rispettivi orbitali. Gli schemi a destra, già descritti in questa sezione, permettono di ricordare che gli orbitali di legame π sono dati dalla sovrapposizione fianco a fianco di due orbitali p atomici e sono pertanto protesi più lontano dai nuclei che uniscono rispetto agli orbitali σ, dati dalla sovrapposizione di orbitali il cui carattere s è senz'altro più accentuato.
Idroalogenazione degli alcheni
[modifica | modifica sorgente]Esempio 1: Alchene simmetrico
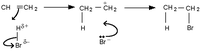
[modifica | modifica sorgente]La reazione di addizione elettrofila che i libri di chimica organica di base descrivono di solito per prima è la reazione di idroalogenazione degli alcheni, un esempio della quale è la reazione tra etene e acido bromidrico schematizzata qui a destra. La reazione avviene a temperatura ambiente e complessivamente porta alla rottura di un legame σ (quello tra idrogeno e bromo) e di uno π (quello dell'alchene) con formazione di due legami σ. La rottura di un legame forte e di uno più debole e la successiva formazione di due legami forti fanno intuire che la reazione dal punto di vista entalpico sia favorita. D'altro canto le addizioni aumentano l'"ordine" del sistema, cosa non favorita dal punto di vista entropico.
|
 |
| Sopra: Addizione elettrofila di acido bromidrico ad un alchene simmetrico A fianco: relativo profilo energetico |
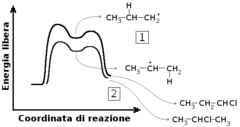
La reazione avviene in due stadi: il primo stadio porta alla rottura del legame idrogeno-alogeno, alla rottura del legame π e alla formazione del legame tra l'idrogeno dell'acido e uno dei carboni sp2 dell'alchene. Il fatto che il secondo carbonio si trovi nel prodotto a sostenere una carica positiva fa intuire che questo stadio sia fortemente endotermico. Il secondo stadio porta alla formazione di una specie neutra a partire da due cariche, grazie al legame tra l'alogeno dell'acido e il secondo carbonio. Tale considerazione di tipo qualitativo porta a concludere che questo stadio porti alla liberazione di energia.
Poiché il primo stadio della reazione è endotermico, la sua energia di attivazione è elevata. Per comprendere questa relazione è necessario ricordare che l'energia di attivazione è data dalla differenza tra l'energia dei reagenti e quella del complesso attivato e che quest'ultimo ha energia elevata poiché simile, secondo il postulato di Hammond, a quella dei prodotti. Il secondo stadio, viceversa ha una bassa energia di attivazione poiché il complesso attivato è simile ai reagenti, di nuovo per il postulato di Hammond.
Il primo stadio della reazione, dunque, ha una velocità inferiore al secondo e determina la velocità complessiva della reazione.
Tutte le caratteristiche del sistema preso in esame che velocizzino il secondo stadio non hanno effetto sulla velocità complessiva della reazione, perché il "collo di bottiglia" è dato dal primo stadio. Questa considerazione ci offre un pratico strumento per capire sperimentalmente a quale stadio un certo reagente entri nel meccanismo di reazione. Se si aumenta la sua concentrazione e si ottiene un incremento della velocità complessiva della reazione si può concludere che il reagente entra nel meccanismo di reazione in corrispondenza dello stadio lento, quello cioè che determina la velocità complessiva.
| Forza del legame σ in K-joule/mol | |||
| H-F | 568 | ||
| H-Cl | 432 | ||
| H-Br | 366 | ||
| H-I | 298 | ||
Per quanto riguarda l'addizione elettrofila di acido alogenidrico al doppio legame di un alchene, un valido esempio di quanto detto è offerto dalla rottura del legame σ dell'acido alogenidrico. Sopra è stato detto, senza alcuna dimostrazione, che tale rottura è concomitante alla formazione del legame σ idrogeno-carbonio e alla rottura del legame π carbonio-carbonio. Come si può verificare che in realtà tale rottura non avvenga prima degli altri due eventi costituendo uno stadio a sé stante? Se il legame σ dell'acido alogenidrico si rompesse per primo, il relativo stadio sarebbe veloce rispetto alla formazione del carbocatione, poiché gli acidi alogenidrici sono acidi molto forti. Eseguendo la reazione con acido fluoridrico, cloridrico, bromidrico e iodidrico non si dovrebbe dunque assistere ad un aumento di velocità, perché tale modifica inciderebbe su uno stadio già veloce di per se. Sperimentalmente, invece, è possibile verificare che la velocità complessiva della reazione è inversamente proporzionale alla forza del legame σ dell'acido.
Esempio 2: Alchene monoinsaturo asimmetrico
[modifica | modifica sorgente]Quando l'attacco elettrofilo da parte dell'acido alogenidrico avviene a scapito di un alchene monoinsaturo asimmetrico si possono formare due prodotti, isomeri di struttura. Di questi uno tende a formarsi in misura maggiore rispetto all'altro. In particolare, nel caso in cui i carboni sp2 dell'alchene leghino un numero diverso di gruppi alchilici, si forma preferenzialmente il prodotto nel quale l'idrogeno dell'acido alogenidrico risulta legato al carbonio che regge il numero maggiore di idrogeni.[1] Un esempio di tale caso è l'addizione elettrofila di acido alogenidrico al propene, illustrata dallo schema a sinistra, che porta a 2-cloropropano piuttosto che a 1-cloropropano. Questa regolarità è stata descritta nel dettaglio nel 1870 dal chimico V.V. Markovnikov [2] [3], e prende dunque il nome di "regola di Markovnikov".

|
|
Oggi si sa che la osservazione di Markovnikov è spiegata dal fatto che il primo stadio della reazione è fortemente endotermico e porta alla formazione di un carbocatione. Tale carbocatione è di un certo ordine se l'idrogeno dell'acido si lega al carbonio meno sostituito, è di un ordine inferiore se si lega all'altro. Considerando ancora il caso del propene, se l'idrogeno si lega al carbonio 1 forma un carbocatione secondario, più stabile, se si lega al carbonio 2 ne forma uno primario, più instabile. Poiché lo stadio che porta al carbocatione è endotermico, il relativo complesso attivato è ad energia più alta nel primo caso rispetto al secondo, quindi il primo caso richiede una energia di attivazione superiore, dunque la sua velocità di reazione è inferiore. La formazione del carbocatione più stabile, in definitiva, avviene più velocemente e sottrae reagente alla seconda opzione, che viene saeguita da un numero minore di molecole.
La correttezza di questa serie di deduzioni è confermata dal decorso della reazione tra acido bromidrico e 1-cloroetene. In questo caso il carbocatione è stabilizzato per effetto coniugativo dal cloro. È interessante notare come il cloro eserciti anche un effetto induttivo, di senso opposto a quello coniugativo. È evidente che in questo caso vince l'effetto coniugativo.
Esempio 3: Diene coniugato (addizione 1,4)
[modifica | modifica sorgente]Una conferma del meccanismo a doppio stadio dell'addizione di acido alogenidrico ad un doppio legame carbonio-carbonio viene dai prodotti che si formano da un alchene con due doppi legami coniugati. Il caso che descrivono tipicamente i libri di testo al proposito è l'attacco elettrofilo da parte di acido bromidrico all'1,3-butadiene.

|
|
| A fianco: Addizione di acido bromidrico all'1,3-butadiene Sopra: Strutture di risonanza dell'intermedio di reazione |
Tale attacco, porta, oltre all'atteso 3-bromo-but-1-ene, anche il 4-bromo-but-2-ene, non previsto in modo esplicito dal meccanismo descritto per il propene. Le formule di risonanza a destra, tuttavia, mostrano come il carbocatione che si forma a seguito dell'addizione dell'idrogeno possa essere descritto da due strutture limite di risonanza, dalle quali si comprende che i carboni caratterizzati da carica positiva, e dunque ataccabili dall'alogenuro, siano il 2, come atteso, ma anche il 4. Ecco perché nel caso dell'1,3-butadiene si parla di attacchi 1-2 e 1-4.
Lo schema sopra descrive una seconda caratteristica interessante di questa reazione, cioè la dipendenza dalla temperatura del rapporto tra le concentrazioni finali dei prodotti. Per interpretare questa apparente stranezza è necessario confrontare i profili energetici delle reazioni che portano ad entrambi i prodotti, riportati sotto.

|
| Addizione elettrofila di acido bromidrico all'1,3-butadiene: profilo energetico |
L'attacco dello ione bromuro al carbocatione è una reazione endotermica, che dunque passa da un complesso attivato più simile al reagente, il carbocatione, che al prodotto. La formazione dell'3-bromo-but-1-ene prevede un complesso attivato relativamente povero di energia, perché simile ad un carbocatione secondario. La formazione del 4-bromo-but-2-ene passa invece per un complesso attivato che assomiglia di più ad un carbocatione primario, più ricco di energia. La formazione del primo prodotto, dunque, richiedendo meno energia risulta più veloce di quella del secondo e sottrae reagente ad esso. Quando il sistema è ricco di energia, cosa che si ottiene semplicemente fornendo calore, la differenza nelle rispettive energie di reazione perde di importanza, poiché l'energia delle molecole è ben più che sufficiente per superare entrambe le barriere energetiche. Il rapporto finale tra prodotti è dato invece dalla stabilità relativa. L'alchene terminale ha energia potenziale più alta di quello con doppio legame interno e dunque si forma in minore concentrazione. Il caso nel quale a determinare la concentrazione dei prodotti sia la velocità degli stadi delle reazioni si dice "a controllo cinetico", il secondo si dice a "controllo termodinamico".
Alogenazione degli alcheni
[modifica | modifica sorgente]Idroborazione
[modifica | modifica sorgente]I borani sono composti aventi legami diretti boro-idrogeno e boro-carbonio. Il boro è fortemente elettron-deficiente (6 e-) ed i borani tendono a dimerizzare, formando legami a tre centri al fine di completare i gusci elettronici. L'esempio classico è il diborano B2H6, dimero del capostipite borano BH3, ove due idrogeni a ponte dividono il loro elettrone di legame tra i due bori adiacenti (legame a tre centri e due elettroni).

In quanto elettron-deficienti, i borani sono dei potenti acidi di Lewis e come elettrofili possono addizionarsi ai legami multipli, portando ad organoborani, compost. Questa reazione è stata sviluppata da H.C. Brown
Nei borani il legame boro-idrogeno è polarizzato Bδ+-Hδ-, ovvero in modo inverso rispetto agli acidi alogenidrici. Per questa ragione la reazione ha una selettività anti-Markovnikov, con l'idrogeno che si lega al carbonio più sostituito.
L'addizione di borani avviene in maniera concertata e sia il boro che l'idrogeno si legano dalla stessa parte del doppio legame (addizione syn)

I borani possono poi essere idrolizzati con H2O2 per dare l'alcol (anti-Markovnikov) ed acido borico B(OH)3
Un reagente commerciale comune per l'idroborazione è il 9-BBN, 9-borabiciclo[3.3.1]nonane.
Approfondimenti
[modifica | modifica sorgente]Per una trattazione di migliore qualità rispetto a quella presentata in questa pagina potete consultare queste pagine scritte da Mauro Tonellato, docente di chimica presso l'ITIS Natta di Padova.
Bibliografia
[modifica | modifica sorgente]- ↑ Tale carbonio è indicato come il "meno sostituito", dove la sostituzione in questione è quella degli idrogeni potenzialmente legabili al carbonio sp2 da parte di gruppi alchilici.
- ↑ Markovnikov, V. V. Annalen der Pharmacie 1870, 153, 228–259.
- ↑ Was Markovnikov’s Rule an Inspired Guess? Peter Hughes 1152 Journal of Chemical Education • Vol. 83 No. 8 August 2006


