Chimica organica/Reazioni organiche: introduzione e classificazione
Questa pagina funge da indice delle reazioni chimiche che verranno descritte in questo libro di Chimica Organica e introduce alcuni concetti che risultano fondamentali per comprendere il motivo dell'esito di molte di queste.
Classificazione delle reazioni in base al meccanismo
[modifica | modifica sorgente]- Reazione di addizione: Reazione chimica tra due o più reagenti, che porta a un singolo prodotto contenente tutti i loro atomi, grazie alla formazione di due legami chimici e alla conseguente riduzione del numero di legami doppi o tripli che caratterizza almeno in uno dei reagenti. Il numero di legami doppi o tripli è detto molteplicità di legami. Le reazioni di addizione si dividono anche in:
- Addizione elettrofila
- Addizione nucleofila
- Addizione radicalica
- Reazione di eliminazione
- Reazione di sostituzione. Reazioni bi-reagente con scambio di legami, si suddividono in
- Sostituzione elettrofila
- Sostituzione elettrofila aromatica
- Sostituzione nucleofila
- Sostituzione nucleofila aromatica
- Reazione di trasposizione o riarrangiamento. Reazioni mono-reagente con modifica interna alla molecola di ordine di legami. Si dividono in
- Riarrangiamenti 1,2
- Reazioni pericicliche
- Metatesi
- Reazione di condensazione
- Reazione di ossido riduzione
Rappresentare lo spostamento di elettroni
[modifica | modifica sorgente]Una reazione consiste nella formazione o nella rottura di legami chimici, legami che, come abbiamo visto nel primo capitolo, comportano la compartecipazione di elettroni tra più atomi. Per rappresentare una reazione è perciò conveniente mostrare quali elettroni si spostino e il punto di partenza e di arrivo di tale spostamento. Nelle prime due righe dello schema a destra sono mostrate la formazione e la rottura omolitica del legame tra gli atomi A e B. Queste consistono rispettivamente nella messa in compartecipazione o sottrazione da parte di A e B di un elettrone ciascuno. Per mostrare che a spostarsi è solo un elettrone si usa la freccia a singola punta. Nella terza riga è mostrata una scissione eterolitica del legame tra A e B, cioè nella sottrazione dell'intera coppia di elettroni da parte di un solo nucleo. Per rappresentare lo spostamento di una coppia di elettroni si usa la freccia a due punte.
Imparare a capire e a delineare le reazioni chimiche
[modifica | modifica sorgente]Questa sezione raccoglie alcune regole di tipo pratico che possono agevolare la comprensione dei meccanismi di reazione.
- Chi studia la chimica delle sostanze organiche può sperare di ricordare in modo efficace le reazioni chimiche solamente se
- riesce ad identificare all'interno di ciascuna molecola i gruppi funzionali
- capisce i meccanismi attraverso i quali avvengano le reazioni
- Cercare di imparare a memoria il modo in cui ciascuna molecola reagisce è infatti una perdita di tempo, dal momento che esistono circa 16 milioni di molecole organiche. Una perdita di tempo è anche considerare le reazioni chimiche come una sorta di scatola nera i cui meccanismi siano da ingozzare a memoria come una filastrocca.
- I meccanismi di reazione rappresentano la parte più logica della chimica organica e, di conseguenza, la parte più facile da imparare, a patto che si accetti di dedicare un po' di tempo alla comprensione di ciò che accade in ciascun loro passaggio.
- L'idea chiave per capire le reazioni chimiche è notare che ciascun passaggio del loro meccanismo è una reazione acido base, secondo la definizione di Bronsted o di Lewis.
- Lo studio di un meccanismo di reazione di cui si discute in aula o che è presentato in un libro di testo si esegue con carta e penna, scrivendo nero su bianco tutti i passaggi prendendo in considerazione specifici reagenti e prodotti:
- È necessario capire in ogni step della reazione quale specie chimica coinvolta rappresenti la base oppure l'acido.
- Ciascuno step non coinvolge più di due molecole e non deve portare alla rottura di più di un legame.
- Ciascuna molecola che si disegna deve essere un reagente aggiunto al sistema o un prodotto di uno step precedente.
- Ciascuno step deve essere bilanciato per quanto riguarda atomi, elettroni e cariche.
- Gli elettroni che si spostano in ciascun passaggio devono essere indicati esplicitamente
- I disegni dei reagenti devono essere corredati con frecce che rappresentino lo spostamento degli elettroni. A tal fine le frecce devono partire dal punto in cui si trovano gli elettroni al punto in cui vanno a finire. Le frecce fungono pertanto da chiare istruzioni su come i reagenti si trasformano in prodotti.
- Tutti gli intermedi di reazione devono essere plausibili, cosa che limita le possibilità a
- acidi o basi coniugati a reagenti, prodotti o intermedi di step precedenti
- complessi acido-base di Lewis
- carbocationi, carbanioni, radicali liberi o carbeni
- Le seguenti caratteristiche permettono di identificare prodotti NON plausibili
- più di 8 elettroni in un elemento del secondo periodo
- un elemento del secondo periodo con più di due elettroni in meno rispetto all'ottetto
- due cariche positive o negative sulla stessa molecola
- contemporanea presenza su una molecola di cariche positive e negative, tranne in casi noti
- due o più elettroni spaiati su una molecola organica
Dizionario minimo circa le reazioni chimiche
[modifica | modifica sorgente]Una reazione si dice regioselettiva quando può comportare la rottura (o la formazione) di diversi legami, ma solo uno è effettivamente rotto (o formato).[1]
Una reazione si dice stereoselettiva quando di due stereoisomeri ai quali una reazione può teoricamente dare origine se ne forma preferenzialmente uno.[2]
Una reazione è stereospecifica quando può avvenire su reagenti che differiscono solamente per la loro configurazione e quando tali reagenti sono rispettivamente trasformati in prodotti che, di nuovo, sono stereoisomeri l'uno dell'altro. Dunque: dallo stereoisomero A allo stereoisomero X, dallo stereoisomero B lo stereoisomero Y. Secondo questa definizione una reazione stereospecifica è per forza anche stereoselettiva, ma non è vero il contrario.[3]
Una molecola elettrofila è un reagente in grado di formare un legame accettando una coppia di elettroni da un altro reagente. Quest'ultimo, in grado di cedere una coppia di elettroni all'elettrofilo è detto nucleofilo. Le specie elettrofile e nucleofile sono, pertanto, rispettivamente acidi e basi di Lewis.[4] Al fine di predire l'esito di molte reazioni che verranno descritte in questo libro, delle specie elettrofile e nucleofile è fondamentale conoscere quale sia la capacità rispettivamente di acquistare o cedere coppie di elettroni. A questa caratteristica verrà dedicata una specifica sezione del presente capitolo. I termini nucleofilo ed elettrofilo sono stati introdotti da Christopher Kelk Ingold nel 1929,[5] mandando in pensione i termini cationoide e anionoide proposti precedentemente da A. J. Lapworth nel 1925.[6]
Gli intermedi delle reazioni organiche
[modifica | modifica sorgente]Stabilità relativa dei carbocationi
[modifica | modifica sorgente]
|
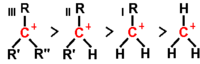 |
| A sinistra: ibridazione e orientamento relativo di un carbonio carico positivamente che caratterizza un carbocatione. A destra: scala di stabilità dei carbocationi | |
Un carbocatione (o ione carbenio) è una molecola organica in cui uno (o più) carbonio possiede una carica positiva. Tale carbonio ha 6 elettroni nella sua sfera di valenza, e pertanto uno dei suoi orbitali resta vuoto. L'immagine a destra mostra che il carbonio in questione è ibridato sp2 poiché lega 3 gruppi, con la carica positiva ospitata nell'orbitale p non ibridato e dunque perpendicolare al piano formato dai tre orbitali sp2. Essendo una specie elettron-deficiente, i carbocationi si comportano da elettrofili.
Al fine di comprendere il decorso di molte delle reazioni che verranno descritte in questo libro è fondamentale notare come i gruppi alchilici legati al carbonio carico positivamente siano in grado, al contrario degli idrogeni, di cedergli carica negativa. Una espressione concisa largamente usata per indicare questa proprietà che tali gruppi sono a rilascio elettronico. La cessione di carica da parte dei gruppi alchilici si realizza per effetto iperconiugativo. Tale effetto, come già indicato in questa sezione del libro, consiste in una interazione degli elettroni del legame σ carbonio(carico positivamente)-carbonio(metilico) con l'orbitale vuoto p che regge la carica positiva. Un numero più elevato di gruppi metilici comporta un più esteso effetto iperconiugativo e dunque una maggiore stabilità del carbocatione. Ecco perché, come indicato in figura, un carbocatione terziario è più stabile di uno secondario che è a sua volta più stabile di uno primario.
I carbocationi tendono a modificare la loro struttura per migrazione di idrogeno o gruppo alchilico per dare luogo ad un carbocatione più stabile. Il gruppo che traspone migra con il suo doppietto elettronico nell'orbitale vuoto, con ritenzione di configurazione. Queste trasposizioni sono note come trasposizione di Wagner-Meerwein.

Le attitudini migratorie sono nell'ordine H > metile > gruppo alchilico.
Interpretazione alternativa all'effetto iperconiugativo: Sovente i libri di testo interpretano la scala di stabilità dei carbocationi senza tirare in ballo l'effetto iperconiugativo. Come già visto durante la descrizione della stabilità relativa degli alcheni, essi affermano che un legame σ tra il carbonio carico positivamente ed un idrogeno si realizza per sovrapposizione di un orbitale sp2 del carbonio con uno s dell'idrogeno. Un legame σ tra lo stesso carbonio carico e un gruppo alchilico si ha, d'altro canto, per sovrapposizione di un orbitale sp2 del carbonio carico con un orbitale sp3 del carbonio del gruppo alchilico. Un orbitale sp3 è più simile ad un orbitale atomico p che ad un s. Un orbitale p è più proteso lontano dal nucleo rispetto all' s. Concludendo: il carbonio di un gruppo alchilico cede maggiormente carica negativa al carbonio carico positivamente rispetto ad un idrogeno.
Carbanioni
[modifica | modifica sorgente]Cosí come esistono ioni in cui il carbonio porta una carica positiva, esistono ioni possedenti una carica negativa al carbonio, i carbanioni. Al contrario dei carbocationi, però, essi non sono planari, ma piramidali (conservando almeno in parte la loro configurazione), la loro stabilità diminuisce con la presenza di gruppi elettron-donatori, ed hanno un carattere nucleofilo. Formalmente, un carbanione è la base coniugata di un idrocarburo, e la stabilità di un carbanione si correla invero con il pKa dell'idrocarburo
Un altro fattore di stabilità è la possibilità di delocalizzazione della carica grazie alla risonanza.
A causa del guscio elettronico completo, i carbanioni non subiscono trasposizione dello scheletro.
Radicali
[modifica | modifica sorgente]Carbeni
[modifica | modifica sorgente]Elettrofilicità e nucleofilicità
[modifica | modifica sorgente]Le caratteristiche che fanno di una molecola una specie elettrofila, cioè un orbitale in grado di accettare una coppia di elettroni, sono le stesse che la rendono acida secondo la definizione di Lewis. Un nucleofilo, per gli stessi motivi, è contemporaneamente anche una base. Tuttavia mentre i termini acido e base si riferiscono alla sola concentrazione dei reagenti e dei prodotti quando la reazione sia giunta all'equilibrio, i termini nucleofilo ed elettrofilo si riferiscono specificatamente alla velocità della stessa reazione. Poiché le due coppie di termini focalizzano l'attenzione su due aspetti diversi della reazione, una buona base non necessariamente è anche un nucleofilo forte, così come un acido forte non è per forza un elettrofilo potente. Alle capacità di un nucleofilo e di un elettrofilo di agire socondo la loro natura sono rispettivamente attribuiti i termini di nucleofilicità ed elettrofilicità.[7]
Molti schemi sono stati proposti nel tempo per quantificare queste caratteristiche. Tutti si basano sulla misura sperimentale della velocità di reazione di un grande numero di nucleofili nei confronti di diversi substrati. Senza scendere nel dettaglio dei metodi e delle equazioni relative è possibile indicare delle regole generali per classificare i nucleofili e gli elettrofili in base alla loro forza.
Per quanto riguarda l'entità della nucleofilicità è possibile affermare che
- hanno le carte in regola per essere nucleofili tanto una specie carica negativamente quanto il corrispondente acido coniugato, ma il primo è un nucleofilo più forte del secondo. Un esempio è dato dall'anione OH-, migliore nucleofilo di H2O.
- in una serie di nucleofili caratterizzata dallo stesso centro nucleofilo, cioè dallo stesso nucleo che materialmente dona la coppia di elettroni, la nucleofilicità segue la basicità.
- in solvente acquoso o alcolico due nucleofili che hanno per centri nucleofili due nuclei dello stesso gruppo del sistema periodico, il nucleofilo più forte è quello caratterizzato dall'atomo nucleofilo più grande. Il confronto tipico proposto dai libri di testo è quello dei tioli, nucleofili più forti dei corrispondenti alcoli.
Bibliografia
[modifica | modifica sorgente]- ↑ IUPAC goldbook:definizione di reazione regioselettiva
- ↑ IUPAC goldbook:definizione di reazione stereoselettiva
- ↑ IUPAC goldbook:definizione di reazione stereospecifica
- ↑ IUPAC goldbook:definizione di elettrofilo
- ↑ Ingold, C. K. Recl. TraV. Chim. Pays-Bas 1929
- ↑ Lapworth, A. Nature 1925, 115, 625
- ↑ IUPAC goldbook: definizione di Nucleofilicità



