Chimica organica/Lipidi
Considerazioni generali
[modifica | modifica sorgente]Il termine lipide si usa per indicare cumulativamente molti composti, tra i quali è utile ricordare
|
|
|
| ||
Questi termini sono non sistematici, raggruppando semplicemente le molecole in base ad alcune caratteristiche comuni. Spesso dunque capita di imbattersi in molecole che appartengano simultaneamente a più classi. Questo fa girare un po' la testa sia agli studenti che a chi insegna. Questo capitolo descrive alcune caratteristiche di acidi grassi, trigliceridi e fosfolipidi. Manca colpevolmente di ogni riferimento alle altre classi di composti. Chiedo a chi legga ed abbia tempo uno sforzo per aggiungere le informazioni mancanti.
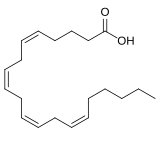
Acidi grassi
[modifica | modifica sorgente]Cenni sulla nomenclatura
[modifica | modifica sorgente]Gli acidi carbossilici la cui catena carboniosa sia costituita da almeno 14 carboni prendono il nome comune di acidi grassi. Come per i carboidrati, esistono per gli acidi grassi termini che permettono la loro classificazione in gruppi in base ad alcune caratteristiche di rilievo.
- Per indicare il numero dei carboni che compongono la catena dell'acido grasso e il numero di doppi legami si usa l'espressione Cnumero carboni:numero doppi legami. L'acido palmitico (16 carboni e 0 doppi legami) è indicato per iscritto come C16:0 e a voce come C sedici con zero.
- La posizione dei doppi legami può essere indicata come distanza del primo legame dal carbonio carbossilico (nomenclatura Δ) o dell'ultimo legame dal fondo della catena (nomenclatura ω). Nel caso in cui sono presenti più doppi legami la nomenclatura non varia, dal momento che tali legami sono sempre separati da un gruppo CH2 e che dunque la posizione di uno indica implicitamente anche quella degli altri. Ad esempio l'acido linolenico, C18:2, può essere indicato come Δ9 oppure ω3.
Cenni sul loro ruolo nella dieta
[modifica | modifica sorgente]Il corpo umano può produrre tutti gli acidi grassi dei quali ha bisogno tranne 2, l'acido linoleico (LA dall'inglese linoleic acid) e l'α-linolenico (LNA dall'nglese alpha-linolenic acid), che sono perciò considerati essenziali, cioè da assumere con la dieta. Altri acidi grassi, quali l'acido eicosapetenoico (EPA) e docosaesenoico (DHA), possono essere prodotti dal corpo umano a partire da LA e LNA, ma l'assunzione tramite dieta aiuta a soddisfarne il fabbisogno giornaliero. La e LNA sono largamente presenti negli oli vegetali, EPA e DHA nel grasso di pesce.
Confronto di alcune caratteristiche fisiche degli acidi grassi
[modifica | modifica sorgente]Gliceridi
[modifica | modifica sorgente]Fosfolipidi
[modifica | modifica sorgente]| Glicerolo | Sfingosina |

|
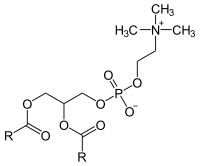
I fosfolipidi sono molecole caratterizzate da una molecola di glicerolo o di sfingosina cui sono uniti
- Un acido grasso solitamente saturo
- Un acido grasso solitamente insaturo
- Un gruppo fosfato
Nel primo caso si parla di glicerofosfolipidi, nel secondo di sfingofosfolipidi.
Glicerofosfolipidi
| Fosfatidato | Fosfatidilcolina | Fosfatidiletanolammina |

|
|
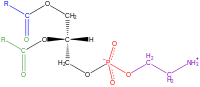
|
| Fosfatidilinositolo | Fosfatidilserina | Difosfatidilglicerolo |

|

|

|
Una nota sulla nomenclatura dei Glicerofosfolipidi: I termini con i quali vengono comunemente indicati i diversi fosfolipidi sono spesso contraddittori e fuorvianti. I libri di testo definiscono la fosfatidilcolina anche come lecitina. Con il termine lecitina sono posti in vendita nei supermercati, come integratori alimentari, delle miscele di fosfolipidi derivate dalla purificazione di oli vegetali (di soia, in particolare), nelle quali si trovano fosfatidilcolina, fosfatidilserina, fosfatidilinositolo e fosfatidiletanolammina. Con il termine "cefalina" i libri di testo indicano una fosfatidilcolina nella quale i gruppi metilici legati all'azoto siano sostituiti da idrogeni.
Sfingofosfolipidi
Anfipaticità dei fosfolipidi
[modifica | modifica sorgente]I fosfolipidi sono molecole anfipatiche, cioè sia idrofile che lipofile, poiché costituiti, come rappresentato in figura per il caso dei glicerofosfolipidi, da una parte polare, alla quale spesso ci si riferisce col termine di "testa", rappresentata dal gruppo fosfato, e da parti non polari, le "code", costituite dalle catene degli acidi grassi. Questo fa sì che in ambiente acquoso i fosfolipidi tendano ad organizzarsi in micelle, a destra, così rivolgere verso l'acqua le parti polari. In alternativa i fosfolipidi si possono organizzare a doppio strato, come avviene nelle membrane cellulari. Sulla superficie di un solvente, essi tendono a disporsi in modo da rivolgere verso il basso la parte affine con esso. La tensione superficiale dei solventi non polari è di gran lunga inferiore a quello dei solenti polari. Nel caso i fosfolipidi si trovino sulla superficie dell'acqua, ne abbassano la tensione superficiale. Tra gli impieghi nelle industrie è opportuno ricordare quello di agente di distacco, cioè di sostanza impiegataper favorire il distacco degli impasti dagli stampi, comenel caso dei cioccolatini.
Glicolipidi
[modifica | modifica sorgente]| Secondo la definizione IUPAC con il termine glicolipide si intende qualunque composto contenente uno o più residui monosaccaridici uniti con legame glicosidico ad un residuo idrofobico, ad esempio acilglicerolico, sfingolipidico, ceramidico o un fenilfosfato. Qui le cose si complicano e pare opportuno rimandare a testi esplicitamente dedicati alla nomenclatura di queste sostanze. [1] |
Terpeni
[modifica | modifica sorgente]| Isoprene | Farnesolo | Geraniolo | Limonene | Squalene |

|

|
I terpeni sono costituenti degli oli essenziali estratti da piante e fiori. Essi sono caratterizzati da unità isopreniche (nome tratto dalla molecola di isoprene), catene di 4 carboni al secondo dei quali è legato un ulteriore carbonio. Vengono raggruppati in base al numero di unità isopreniche che li costituiscono.
|
Carotenoidi
[modifica | modifica sorgente]| La classe dei carotenoidi comprende gli idrocarburi (caroteni) e i loro derivati ossigenati (xantofille) costituiti da 8 unità isopreniche. Tali unità sono unite in modo tale che i gruppi CH3 centrali sono separati da 6 carboni (o, come dice la IUPAC, i gruppi CH3 centrali hanno una relazione posizionale 1,6), mentre tutti gli altri sono separati da 5 carboni. Tutti i doppi legami, compreso quello centrale, sono di solito caratterizzati da una configurazione trans. La configurazione stessa viene sottointesa nel nome se di tipo trans, indicata esplicitamente se di tipo cis. La maggior pate dei carotenoidi non è solubile in acqua. Per ricorare questo dato basta considerare che lo strutto e il burro (matrici alimentali prevalentemente costituite da lipidi) sono gialline proprio a causa dei carotenoidi solubilizzati al loro interno.
|
| Alcuni carotenoidi comuni | ||
| Licopene | α-carotene | β-carotene |

|

| |
| γ-carotene | 6',7'-Dideidro-β,ε-carotene | Violaxantina, di colore giallo |

|

|
|
| Acido 8,8-diapo-8,8-carotenoico | ||

|
||
Steroidi
[modifica | modifica sorgente]| Trasformazione dello squalene in lanosterolo |

|
Collocazione dei lipidi negli alimenti
[modifica | modifica sorgente]Comprendere quale sia la collocazione dei lipidi negli alimenti spesso porta a considerazioni interessanti circa le proprietà dell'alimento stesso. Un tessuto vegetale è costituito per l'80% da acqua. Eppure trovano in esso posto anche i caroteni, sostanze idrofobiche, tanto da caratterizzarne spesso il colore complessivo. Evidentemente i comparti che li ospitano sono diversi da quelli nei quali è collocata l'acqua. Si tratta dei plastidi, ai quali sono attribuiti nomi specifici a seconda delle molecole che contengono. I cromoplasti contengono sostanze colorate, i cloroplasti clorofilla e così via.
| Tipi di plastidi | Cloroplasti |
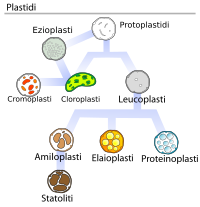
|
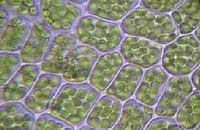
|
Cristalli formati dai lipidi 
[modifica | modifica sorgente]Una delle principali caratteristiche che sono apprezzate nei lipidi è la consistenza che sono in grado di conferire agli alimenti cui sono aggiunti. Tale consistenza è modulata dall'orientano reciproco all'interno del cristallo che formano allo stato solido.
- La prima riga della tabella sotto mostra le due conformazioni principali dei trigliceridi nei cristalli: a diapason
 e a sedia
e a sedia  . Per la conformazione a sedia è mostrato anche il modo in cui più molecole di triglicerie possono legarsi le une a fianco alle altre a formare una sorta di piano.
. Per la conformazione a sedia è mostrato anche il modo in cui più molecole di triglicerie possono legarsi le une a fianco alle altre a formare una sorta di piano. - Focalizzando l'attenzione sugli ultimi due carboni della catena e osservando tale catena dal basso è possibile scendere in maggior dettaglio. È possibile infatti distinguere 3 tipi di cristallo [3], identificati con le lettere greche α, β e β'. Il primo cristallo ha una base pressappoco esagonale. È il più disordinato ed infatti è caratterizzato dal punto di fusione minore. Il secondo, detto ortorombico, presenta un livello di ordine maggiore e, coerentemente, un punto di fusione più alto. Il terzo, detto triclino presenta il livello maggiore di ordine e un più alto punto di fusione. Alcuni articoli presentano vere e proprie fotografie di tali cristalli. [4]
Per meglio apprezzare quale sia il nesso tra la consistenza di un alimento ricco in lipidi e forma dei cristalli lipidici è opportuno descrivere due fasi della produzione del cioccolato:
- Concaggio
 : Gli ingredienti che compongono il cioccolato vengono portati ad una temperatura di poco superiore a quella d fusione e mescolati per tempi prolungati (anche una settimana) in speciali contenitori. Poiché questi hanno una forma simile a quella di una conchiglia al processo viene dato il nome di concaggio. Lo scopo del concaggio è quello di sminuzzare i componenti non liposolubili, quali grani di zucchero e fibre, e fare in modo che questi siano interamente ricoperti da una patina di burro di cacao. In questa sospensione il burro di cacao costituisce dunque la fase continua, cioè il gel. [5]
: Gli ingredienti che compongono il cioccolato vengono portati ad una temperatura di poco superiore a quella d fusione e mescolati per tempi prolungati (anche una settimana) in speciali contenitori. Poiché questi hanno una forma simile a quella di una conchiglia al processo viene dato il nome di concaggio. Lo scopo del concaggio è quello di sminuzzare i componenti non liposolubili, quali grani di zucchero e fibre, e fare in modo che questi siano interamente ricoperti da una patina di burro di cacao. In questa sospensione il burro di cacao costituisce dunque la fase continua, cioè il gel. [5] - Temperaggio
 : Questa fase consiste nel raffreddare la pasta di cacao gradualmente da 45 °C a 27 °C, per poi riscaldarla a 37 °C e successivamente raffreddata fino allo stato solido. Lo scopo di questa fase è fare sì che i trigliceridi formino i cristalli più apprezzabili al palato, quelli in configurazione β', danno il cosiddetto cioccolato fondente.
: Questa fase consiste nel raffreddare la pasta di cacao gradualmente da 45 °C a 27 °C, per poi riscaldarla a 37 °C e successivamente raffreddata fino allo stato solido. Lo scopo di questa fase è fare sì che i trigliceridi formino i cristalli più apprezzabili al palato, quelli in configurazione β', danno il cosiddetto cioccolato fondente.
Due dei tipici difetti dati da una errata condotta delle due fasi sopra descritte sono l'aspetto opalescente oppure opaco della superficie della tavoletta. Il primo difetto scaturisce dall'affioramento di una parte della componente grassa. Il secondo difetto da una non perfetta formazione della sospensione. Il cioccolato è aggiunto alle merendine come barriera commestibile all'umidità. L'inadeguata dispersione delle componenti non liposolubili ne riduce l'efficacia. [6] Vuoi sapere di più sull'inventore delle tecniche di concaggio e temperaggio? Dai una occhiata qui.
Bibliografia
[modifica | modifica sorgente]- ↑ Nomenclatura glicolipidi
- ↑ Nomenclatura dei carotenoidi secondo la IUPAC
- ↑ C. Lopez, P. Lesieur, G. Keller and M. Ollivon. Thermal and Structural Behavior of Milk Fat. 1. Unstable Species of Cream. J. Coll. Int. Sci. 229:62-71 (2000)
- ↑ T. Arishima, N. Sagi, H. Mori and K. Sato Polymorphism of pos. I. occurrence and polymorphic transformation JAOCS 68(10):710-715 (1991)
- ↑ J.M. Hoskin and P. Dimick. Observations of chocolate during conching by scanning electron microscopyand viscosimetry. J. Food. Sci. 45:1541-1545 (1980)
- ↑ V. Morillon, F. Debeaufort, G. Blonda, M. Capelle and A. Voilley Factors Affecting the Moisture Permeability of Lipid-Based Edible Films: A Review. Critical Reviews in Food Science and Nutrition 42(1):67-89 (2002)