Chimica organica/Richiami di chimica generale
Gli orbitali atomici - Un atomo è formato da un nucleo, costituito da protoni e neutroni, e da elettroni. I primi rappresentano i 999/1000 del peso dell'atomo, le orbite dei secondi ne rappresentano i 999/1000 del volume. Tali orbite determinano anche l'energia degli elettroni, dato che ad una maggiore distanza degli elettroni dal nucleo corrisponde una loro maggiore energia potenziale. Le orbite tuttavia, possono essere note solo in via approssimata, come specificato dal principio di indeterminazione di Heisenberg. L'approssimazione alla quale si ricorre consiste nel considerare ciascun livello energetico che gli elettroni possono assumere secondo la meccanica quantistica, ed associando ad essi orbitali atomici, cioè volumi all'interno dei quali si abbia il 95% di probabilità di trovare gli elettroni. Gli orbitali s sono disposti a sfera attorno al nucleo, ed hanno fase negativa vicino ad esso e fase negativa lontano. Gli orbitali p sono 3, caratterizzati dalla medesima energia (degeneri) e disposti perpendicolarmente gli uni rispetto agli altri, tanto da essere iddentificati da una x, una y ed una z. Gli orbitali p sono maggiormente protesi lontano dal nucleo rispetto agli s. La disposizione degli elettroni all'interno degli orbitali può essere ricavata seguendo le regole dell'aufbau, di Pauli e di Hund. La disposizione degli elettroni più vantaggiosa dal punto di vista energetico è quella dei gas nobili, con gli orbitali più esterni completamente pieni.
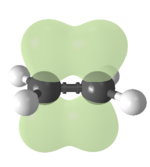
I legami chimici, sigma e pi greco - Per raggiungere tale configurazione gli atomi possono dare vita a legami chimici, ovvero a una condizione nella quale alcuni elettroni siano condivisi con altri nuclei. La teoria degli orbitali molecolari propone, semplificando la realtà, che per condividere elettroni gli atomi debbeno avvicinarsi, sovrapponendo gli orbitali contenenti gli elettroni da condividere. La sovrapposizione più ampia, e dunque il legame chimico più forte, si realizza quando l'orbitale risultante sia di tipo σ, ovvero caratterizzato da un asse di simmetria che passa attraverso i nuclei uniti. Tale asse di simmetria garantisce la libera rotazione tra i nuclei che unisce. Un legame σ si può avere per sovrapposizione di 2 orbitali atomici s, un s e un p, 2 p che si avvicinino testa-testa. Tra 2 nuclei uniti mediante legami σ si possono formare ulteriori legami per sovrapposizione dei rimanenti orbitali atomici, i “p”. Essendo questi perpendicolari al legame σ già formato, non si possono che sovrapporre fianco a fianco, dando vita ad un orbitale π. Questa sovrapposizione è di estensione inferiore a quella di un σ, ed è massima quando gli orbitali sono paralleli, nulla quando sono perpendicolari. La presenza di un orbitale π impedisce dunque la libera rotazione dei nuclei che unisce.
Ibridazione - Per predire con sufficiente precisione quale sia la disposizione reciproca che i nuclei assumono in seguito a legami non è sufficiente considerare la sovrapposizione dei rispettivi orbitali atomici. È necessario immaginare anche che tutti gli orbitali atomici impegnati nella formazione di legami σ subiscano una ibridazione, mescolandosi in modo perfetto. Ecco dunque, a titolo di esempio, che gli orbitali s e p di un nucleo impegnato in legami con 2 altri gruppi danno vita a due orbitali ibridi sp prima di legarsi.
Risonanza - Esistono legami chimici le cui caratteristiche sono intermedie a quelle di legami semplici e doppi. Per poter rappresentare queste situazioni mediante legami netti è possibile ricorrere alle strutture limite di risonanza, cioè strutture che differiscano solo per la disposizione degli elettroni di non legame o di legami π.
Dall'atomo alla molecola
[modifica | modifica sorgente]Modello elettronico dell'atomo
[modifica | modifica sorgente]
Un atomo pesa circa 10-27Kg (?¿), dei quali 999/1000 rappresentati dal nucleo (protoni + neutroni) e 1/1000 dagli elettroni. Il raggio di un atomo è circa 10-10 m; quello di un nucleo circa 10-11 - 10-12 m. Lo spazio occupato da un atomo dunque coincide in buona approssimazione con lo spazio nel quale si muovono gli elettroni.
La conoscenza di tale spazio è possibile solo in modo approssimato. Infatti il principio di indeterminazione di Heisenberg stabilisce un limite nella precisione con la quale è possibile conoscere l'energia e la posizione istantanea di ogni corpo, elettrone incluso. L'espressione matematica di tale principio è
, dove Δ (mv) = quantità di moto; Δ x= posizione; h = costante di Plank
Il prodotto tra la precisione con la quale si conosce la quantità di moto e quella con la quale si conosce la posizione del corpo sono pari ad una costante, quindi maggiore è la precisione con la quale si conosce una grandezza, minore è la precisione con la quale si conosce l'altra. Il problema può essere risolto per approssimazione. Ponendo che un elettrone sia caratterizzato da una certa quantità di energia è possibile individuare lo spazio attorno al nucleo che sia in grado di esplorare. È quanto viene proposto dalla
- Teoria degli orbitali atomici
- Un orbitale può essere definito in modo barbaro ma comodo come il volume all'interno del quale ci sia una certa probabilità di trovare un elettrone caratterizzato da una certa energia.
- L'elettrone può assumere solo determinati valori di energia.
- A ciascuno di tali valori è dunque associato un determinato volume.
- A ciascuno di tali volumi è stata attribuita una sigla. In ordine crescente di energia abbiamo gli orbitali 1s, 2s, 2p, 3s, 3p ....
- Breve descrizione degli orbitali s e p
- Gli orbitali s sono sferici, centrati attorno al nucleo. Gli orbitali p sono bilobati.
- A parità di periodo, gli orbitali s sono più raccolti attorno al nucleo, gli orbitali p più protesi lontano dal nucleo.
- Il moto degli elettroni è caratterizzato da una fase. Non stupisce dunque che gli orbitali atomici, che in fondo descrivono il moto degli elettroni, siano pure loro caratterizzati da fasi. Negli orbitali p le due fasi coincidono con i due lobi, l'uno positivo e l'altro negativo. Negli orbitali s il volume a fase positiva e quello a fase negativa sono due volumi sferici l'uno dentro l'altro.
- Qualunque equazione passa da valori positivi a valori negativi passando per lo zero. Questo vale anche per le due fasi degli orbitali atomici. Negli orbitali p il punto nel quale c'è una probabilità pari a zero di trovare l'elettrone coincide col nucleo. Questo punto prende il nome di nodo. Negli orbitali s esiste una superficie nodale, di forma sferica, che sta tra la sfera con segno positivo e quella con segno negativo.
- Gli orbitali p sono perpendicolari gli uni agli altri e sono detti degeneri, poiché caratterizzati da una medesima energia.
- Disposizione degli elettroni negli orbitali atomici
- Principio dell' Aufbau: Il principio dell'Aufbau (costruzione, in tedesco) stabilisce che gli orbitali elettronici di un atomo vengono "riempiti" dagli elettroni a partire da quello a minore energia verso quello a più alta energia.
- Principio di Pauli: Il numero di elettroni che può occupare ciascun orbitale è limitato dal Principio di Pauli. In un orbitale al massimo possono coesistere due elettroni ma con numero quantico di spin opposto.
- Regola di Hund: Se più orbitali della medesima energia sono disponibili, la Regola di Hund stabilisce che gli orbitali inoccupati verranno riempiti prima che gli orbitali occupati vengano riutilizzati (da elettroni con spin opposti).
In un corso di fondamenti di Chimica Organica ci si occupa di pochi elementi della tavola periodica, tanto che di questa potrebbe, quasi per gioco, essere riscritta una versione ridotta come quella riportata a destra. Ecco, per alcuni degli elementi di questa microtavola, la configurazione elettronica basata sui tre principi sopra riportati:
| Carbonio | Azoto | Ossigeno | Fluoro |
| 1s2 2s2 2p2 | 1s2 2s2 2p3 | 1s2 2s2 2p4 | 1s2 2s2 2p5 |
L'azoto, grazie ai tre elettroni spaiati presenti negli orbitali p, può formare 3 legami senza caricarsi positivamente; l'ossigeno, per lo stesso motivo, può formare 2 legami; il fluoro 1 legame. Il carbonio sembra poter formare 2 legami, ma la promozione di un elettrone dall'orbitale 2s al 2p vuoto gli permette di formare 4 legami.
Gli atomi legati a dare molecole
[modifica | modifica sorgente]Tra gli atomi che si trovano nel medesimo sistema possono stabilirsi interazioni, cumulativamente indicate col termine di legame chimico, grazie alle quali cominciano a comportarsi come una entità individuale (la molecola) se sottoposti a sollecitazioni esterne. La spinta principale alla formazione della molecola è data dal fatto che gli atomi all'interno di questa possono mettere in compartecipazione i propri elettroni, raggiungendo la configurazione elettronica dei gas nobili, che, con termini poco rigorosi ma efficaci, possiamo definire particolarmente "vantaggiosa". Per capire in termini più rigorosi in cosa consista tale vantaggio dovremmo ora introdurre il concetto di energia. Poiché questo porterebbe ad una divagazione per il momento non necessaria, lo lasceremo per alcuni capitoli in sospeso. Ciò che è utile sottolineare al momento è che la compartecipazione degli elettroni fa si che questi debbano essere considerati come delocalizzati all'interno di tutta la molecola e non più confinati all'atomo di origine.
Forza e lunghezza di un legame
[modifica | modifica sorgente]
Per valutare la forza di un legame o il numero di legami tra due nuclei durante questo corso osserveremo spesso la lunghezza di legame, cioè la distanza tra i due nuclei all'interno della molecola. Per capire il nesso tra queste due grandezze diamo una occhiata all'energia potenziale di un sistema costituito da due atomi che si avvicinano.
Nel grafico a destra sull'asse delle x è indicata la distanza (r) tra i nuclei degli atomi A e B, mentre l'asse delle y rappresenta l'energia potenziale del sistema costituito da tali atomi. Quando gli atomi sono così distanti da non interagire (parte destra del grafico), essi sono caratterizzati da una energia potenziale pari alla somma dei due atomi separati, alla quale viene attribuito arbitrariamente il valore di zero. Quando la distanza diminuisce (nel grafico, da destra a sinistra) si stabiliscono tra gli atomi interazioni attrattive e repulsive la cui entità dipende dalla distanza stessa. Con la vicinanza le prime prevalgono sempre più sulle seconde fino ad un minimo, cui fa seguito un nuovo, repentino aumento. La distanza che corrisponde al minimo energetico è la così detta distanza o lunghezza di legame. Tale distanza da dunque informazioni prezione circa la forza delle interazioni di tipo attrattivo rispetto a quelle di tipo repulsivo. In termini puramente qualitativi è dunque lecito attendersi che due atomi legati con doppio legame risultino più vicini all'interno di una molecola rispetto a due legati da un legame semplice. A parità di legami, due nuclei che compaiono nello stesso periodo della tavola periodica si legano con legame più forte, e dunque più corto, rispetto a nuclei di gruppi diversi.
Per molte coppie di atomi tale lunghezza è stata calcolata in condizioni standard. In questa pagina della sezione italiana di wikipedia si trovano alcuni esempi. Per avere informazioni sulla tecnica mediante la quale sia possibile avere informazioni sulle distanza di legame vedere questa pagina di wikipedia. Una applicazione tecnologica che deriva diretamente dalla dimensione delle molecole consiste nella loro separazione mediante filtrazione per dimensione. Ad esempio Ismail[1] descrive membrane per la separazione meccanica dell'azoto dall'ossigeno presente nell'atmosfera. Tali membrane vengono applicate nella creazione e mantenimento di atmosfere modificate all'interno delle celle frigorifere.
Orbitali atomici → molecolari
[modifica | modifica sorgente]Per indicare come a seguito di legami chimici gli elettroni dei singoli atomi si ridispongono all'interno di tutta la molecola, è stata formulata la teoria degli Orbitali Molecolari.[2] Questa descrive le molecole in termini di orbitali, diagrammi di orbitali e configurazioni elettroniche, esattamente come già visto per gli atomi. Un tipico diagramma di orbitali è riportato a destra. Gli orbitali molecolari, al centro, sono indicati come derivanti dai corrispettivi atomici. Tanti orbitali molecolari, quanti orbitali atomici.
Il modo in cui gli orbitali atomici si riarrangiano a dare quelli molecolari è tutt'altro che banale. Per molecole diatomiche è stata formulata una utile semplificazione che prevede che gli orbitali molecolari siano formati per Combinazione Lineare di Orbitali Atomici (il cui acronimo in inglese è LCAO). Secondo tale modello
- Gli orbitali molecolari si formano per sovrapposizione di quelli atomici. La forza del legame tra due atomi è proporzionale alla sovrapposizione tra i rispettivi orbitali atomici.
- La possibilità degli orbitali atomici di sovrapporsi è inversamente proporzionale alla loro differenza energetica.
- La sovrapposizione può avvenire tra le parti degli orbitali atomici aventi la stessa fase. In questo caso si ottengono orbitali che, se occupati da elettroni, rafforzano il legame tra gli atomi che li condividono. Tali orbitali sono definiti di legame. Quando si sovrappongono parti degli orbitali con fase opposta si generano orbitali di antilegame che, se occupati da elettroni, indeboliscono il legame tra gli atomi che li condividono.
Il modello LCAO ha due conseguenze notevoli:
- Poiché la sovrapposizione di due orbitali atomici è inversamente proporzionale alla loro differenza in energia, il legame tra due nuclei è più forte se essi appartengono allo stesso periodo.
- Orbitali σ e π: La sovrapposizione può portare ad un orbitale di legame caratterizzato da un asse di simmetria che passa per i nuclei che unisce.
- Questo si verifica nei casi s + s oppure s + p oppure p + p (testa a testa). L'orbitale atomico p può essere anche uno degli orbitali ibridi che verranno descritti tra poco. Un orbitale di legame di questo genere è definito σ. Tale legame consente, a causa della simmetria, una libera rotazione tra i gruppi che unisce.
- La sovrapposizione, se p + p (fianco a fianco), porta a un orbitale di legame π, non simmetrico rispetto all'asse che passa per i due nuclei che unisce e caratterizzato da un piano nodale che comprende i nuclei che unisce. Un piano nodale è un piano lungo il quale si ha una probabilità pari a zero di trovale l'elettrone. La sovrapposizione fianco a fianco di due orbitali p è meno estesa rispetto a quella testa a testa. Un legame di tipo π è dunque meno forte rispetto ad uno σ. La rotazione di uno dei gruppi che unisce rispetto all'alto porta ad un decremento della sovrapposizione (fino ad arrivare a zero per orbitali perpendicolari). Tale legame non consente dunque una libera rotazione. È ovvio, ma bene sottolineare, che un legame fianco a fianco tra orbitali p si può avere solo dopo che si sia già formato un legame σ. È questo infatti che costringe gli orbitali p in tale posizione affiancata.
Rispetto agli elettroni di tipo σ, gli elettroni di un orbitale di tipo π sono più protesi lontano dall'asse che passa per i nuclei che unisce. Tali elettroni sono dunque ceduti con più facilità a specie in grado di accettarli.
Orbitali molecolari: il caso della molecola dell'ossigeno
[modifica | modifica sorgente]Di tutto ciò che è stato detto fino ad ora, il concetto forse più difficile da apprezzare è quello degli orbitali di antilegame. Per familiarizzare con questa entità è opportuno descrivere la molecola dell'ossigeno. La configurazione elettronica di questa molecola, inoltre, è alla base di alcune importanti reazioni che verranno descritte nelle pagine di questo libro.
Stato fondamentale: Gli orbitali di due atomi di ossigeno si combinano a dare gli orbitali della molecola di O2 in modo tale che i due orbitali di antilegame a più bassa energia risultano degeneri. Nello stato a più bassa energia (stato fondamentale) in ciascuno di tali orbitali si trova un elettrone. Dalla regola di Hund sappiamo che elettroni spaiati in orbitali degeneri possono essere caratterizzati da un medesimo spin, così che lo spin totale S della molecola sia 1. Una tale configurazione elettronica è detta di tripletto dal momento che gli spin possono allinearsi rispetto ad un campo magnetico esterno in 3 modi diversi. È interessante verificare come l'occupazione di orbitali di antilegame da parte di elettroni indebolisca in effetti il legame ossigeno-ossigeno. Per rendersene conto è sufficiente notare come nella molecola di azoto, che non presenta elettroni occupanti orbitali di antilegame, i due atomi siano legati più saldamente.
Stati eccitati: Gli stati ad energia immediatamente più alta rispetto a quello fondamentale sono detti di singoletto. Come mostra la figura a destra, gli elettroni che occupano gli orbitali ad enegia più alta ora sono appaiati all'interno dello stesso. L'origine del nome è facilmente deducibile da quella del tripletto. Tra lo stato di tripletto e quelli di singoletto c'è una differenza di energia di circa 3625 kelvin.[3][4]
Orbitali molecolari - Postilla 1 - l'ibridazione (sp3 - sp2 - sp)
[modifica | modifica sorgente]| Metano 3D | Orbitali idridi sp3 | Orbitali idridi sp2 |
|

|

|
Il modello LCAO, secondo il quale gli orbitali molecolari sono originati dalla sovrapposizione degli orbitali atomici, spesso predice in modo nettamente scorretto le caratteristiche dei legami che i vari atomi formano all'interno delle molecole. Ad esempio, i legami che uniscono carbonio e idrogeni nella molecola del metano hanno caratteristiche identiche. Eppure applicando il modello LCAO agli orbitali del carbonio, tre orbitali p e un orbitale s, uno dei quattro legami sembrerebbe dover essere diverso dagli altri 3. Per continuare ad utilizzare il modello LCAO, estremamente comodo poiché semplice, lo si amplia introducendo il concetto di ibridazione, che funziona bene con gli atomi fino al secondo periodo, ma è approssimativa per gli altri.
- Secondo il modello dell'ibridazione, gli orbitali di ciascun atomo che andranno a formare legami di tipo σ subiscono un riarrangiamento nel momento in cui l'atomo stesso entra a far parte di una molecola. In particolare, i suoi orbitali assumono una direzione reciproca che può essere predetta immaginando che essi ospitino cariche negative che si respingono quanto più possibile.
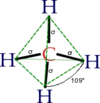
- 4 cariche negative legate allo stesso elemento (l'atomo) si dispongono a tetraedro, 3 cariche si dispongono a triangolo, 2 cariche si dispongono in linea.
- Per formare 4 legami un atomo del secondo periodo deve impiegare i 3 orbitali 2p e quello 2s. La combinazione lineare di questi 4 orbitali atomici dà origine proprio a 4 orbitali molecolari disposti a tetraedro. Ecco perché questi orbitali prendono il nome di orbitali sp3;
- quando un atomo forma 3 legami, le caratteristiche degli orbitali con cui forma tali legami possono essere ricavate per combinazione lineare tra 2 orbitali p e un s. Ecco perché a tali orbitali viene dato il nome di (sp2);
- quando un atomo forma 2 legami, infine, gli orbitali con cui forma tali legami vengono definiti sp.
È necessario sottolineare come la combinazione di 2 orbitali p e 1 s a dare 3 sp2 lasci libero un orbitale p, che tende quindi a disporsi pependicolarmente al piano identificato dai 3 orbitali sp2. I due orbitali sp lasciano 2 orbitali p non ibridati, che sono perpendicolari tra loro e perpendicolari alla direzione dei 2 orbitali sp.
Orbitali molecolari - Postilla 2 - Risonanza
[modifica | modifica sorgente]Il modello del legame chimico, così come è stato descritto fino ad ora, prevede che gli elettroni che costituiscono un legame siano localizzati tra i nuclei che uniscono. In alcune circostanze è tuttavia evidente che questo modello non regga. La rappresentazione riportata sotto della molecola di ozono, ad esempio, presuppone che i due atomi di ossigeno alle estremità siano diversi, così come i legami che li uniscono all'ossigeno centrale. In realtà tanto gli ossigeni quanto i legami sono uguali.

Per adattare a questi casi il comodo formalismo dei legami chimici, si è aggiunto a questo il formalismo della risonanza:
- In base al formalismo della risonanza una molecola è immaginata come un ibrido (cioè un intermedio) tra tutte le formule che possono essere progettate per spostamento delle coppie di non legame e degli elettroni di tipo π che la caratterizzano.
- Perché le formule chimiche scritte siano sensate, non devono mai prevedere su un atomo un numero di elettroni incompatibile con le sue caratteristiche.
- A tali formule viene dato il nome di strutture limite di risonanza.
- Nessuna delle strutture limite è "vera", perché le caratteristiche della molecola sono intermedie a ciascuna di queste.
- Per descrivere in modo rispondente alla realtà la molecola dell'ozono, dunque, è possibile immaginare lo spostamento di coppie di elettroni di non legame e di elettroni π riportato sotto

Data una struttura molecolare, come fare a capire se sia possibile scrivere ulteriori strutture limite di risonanza?
Uno spostamento di una coppia di elettroni verso un atomo è possibile
- se esso presenta un orbitale in grado di ospitare tale coppia
- se esso presenta un orbitale che ospita elettroni che si possono allontanare grazie ad un ulteriore spostamento elettronico. Questo secondo caso si verifica quando si hanno più doppi legami (o doppi legami e coppie elettroniche di non legame) coniugati, cioè separati da un legame semplice. Ad esempio tra la coppia di elettroni di non legame dell'ozono e il doppio legame c'è un legame semplice. Ecco che la coppia di elettroni di non legame può essere ospitata dall'ossigeno centrale grazie al fatto che il legame π col terzo ossigeno può essere scisso.
Un ulteriore esempio di risonanza permette di introdurre una notazione coincisa delle strutture limite. La molecola sotto non è caratterizzata da un doppio legame tra il carbonio 1 e 2 e nemmeno tra 2 e 3, ma piuttosto da un parziale doppio legame sia tra 1 e 2 che tra 2 e 3. La formula a destra, con alcuni legami tratteggiati, rappresenta una sorta di riassunto di quelle a sinistra.

Le strutture limite di risonanza hanno la stessa importanza nel reappresentare una molecola?
Una struttura limite di risonanza rappresenta in misura maggiore una molecola se
- non presenta separazione di carica
- le cariche che regge sono localizzate su nuclei in grado di sopportarle (una carica negativa su un ossigeno piuttosto che su un carbonio)
- presenta la medesima separazione di un altro (il caso tipico è quello dello ione carbossilato, in cui entrambi gli ibridi di risonanza prevedono un ossigeno carico negativamente e uno legato con doppio legame)
Elettronegatività
[modifica | modifica sorgente]Come riportato in questa pagina della versione inglese di wikipedia, l' Elettronegatività, indicata col simbolo χ, è una proprietà chimica che descrive l'abilità di un atomo (o, più raramente, di un gruppo funzionale) di attirare una nuvola elettronica facente parte di un legame covalente.[5] L'elettronegatività di un atomo dipende sia dal suo peso atomico che dalla distanza che separa i suoi elettroni più esterni (detti di valenza) dal nucleo. Esistono differenti scale per indicare l'elettronegatività dei vari atomi, la più utilizzata delle quali è quella di Pauling, l'ideatore del termine elettronegtività.[6]. Secondo tale scala al Fluoro è attribuito un valore di elettronegatività pari a 4 e agli altri nuclei valori che generalmente diminuiscono spostandosi verso sinistra e verso il basso lungo la tavola periodica. In particolare il valore dell'elettronegatività degli altri atomi può essere calcolato mediante la seguente equazione:
dove rappresenta il valore dell'elettronegatività (dell'atomo A e B), il Δ rappresenta la differenza tra l'energia di legame determinata sperimentalmente e quella calcolata (media delle energie di legame tra A-A e A-B), e 23,06 è una costante arbitraria.
È utile notare che, a causa dell'elettronegatività, gli elettroni che costituiscono un legame chimico tra due atomi diversi, o con intorni chimici differenti, danno vita ad una nuvola elettronica distribuita non equamente tra di essi. La conseguenza è che il legame tra due atomi A e B sia più forte della media dei legami A-A e B-B. L'atomo più elettronegativo attira gli elettroni a se acquistando una parziale carica negativa e rendendo l'altro positivo. I due atomi, poiché di carica opposta, si attraggono.
La distribuzione delle cariche nelle molecole organiche: i dipoli
[modifica | modifica sorgente]Come indica la sezione inglese di wikipedia alla voce "Dipole", un dipolo elettrico è una separazione di carica negativa e carica positiva.
Il caso più semplice è rappresentato dal così detto dipolo fisico, ovvero da due cariche elettriche di eguale grandezza ma di segno opposto, separate da una certa distanza. In senso letterale, tali cariche rappresentano due poli.
Un dipolo elettrico può essere descritto mediante la grandezza vettoriale detta momento dipolare. Nel caso del dipolo fisico, il momento dipolare è rappresentato da un vettore diretto dalla carica negativa verso la positiva, con lunghezza pari alla forza di ciascuna carica moltiplicata per la distanza che le separa. L'unità di misura del momento dipolare che fa parte dell'SI ( Sistema Internazionale di unità di misura) è il coulomb.metro (C.m). In chimica si ricorre spesso al debye, simboleggiato da una D, in onore di Peter Debye, che studiò diffusamente i dipoli elettrici.
Le molecole costituiscono dipoli molecolari quando sono caratterizzate da momenti dipolari, a causa della distribuzione non uniforme delle cariche negative e di quelle positive sui vari atomi. I dipoli molecolari possono essere distinti in tre tipologie:
- Dipoli permanenti: si hanno quando due atomi della molecola sono caratterizzati da una differente elettronegatività. Poiché l'atomo più elettronegativo attrae gli elettroni più dell'altro, risulta caratterizzato da una parziale carica negativa, inducendo sul secondo una parziale carica positiva. Le molecole con dipoli permanenti vengono definite polari. Vedi la voce "dipole-dipole attraction" nella sezione inglese di wikipedia. Un esempio è dato da
(+) H-Cl (-)
- Dipoli istantanei: si hanno quando gli elettroni di una molecola (non necessariamente polare) hanno fluttuazioni della loro distribuzione creando momentanee differenze di carica elettrica. Dai una occhiata alla voce "intermolecular force#London dispersion forces" nella sezione inglese di wikipedia. Un esempio è dato da
(0) Cl-Cl (0) [fluttuazione elettronica] --> (+) Cl-Cl (-)
- Dipoli indotti: Si presentano quando una molecola polare si avvicina a una molecola non polare, inducendo in essa uno spostamento della distribuzione di carica. Dai una occhiata alla voce "induced-dipole attraction" nella sezione inglese di wikipedia. Un esempio è dato da
[Dipolo permanente] H-O-H------Cl-Cl [Dipolo indotto]
Forze repulsive o attrattive tra molecole
[modifica | modifica sorgente]Secondo la IUPAC le forze attrattive o repulsive tra le molecole o loro parti si possono suddividere in[7]
- Interazioni elettrostatiche di ioni con altri ioni o molecole neutre
- Legami chimici, cioè interazioni così stabili da poter far considedrare l'aggregato risultante come una entità unica
- Forze di Van der Waals, definite come tutte le interazioni che non rientrano nelle prime due categorie.
Le forze di Van der Waals, così definite dal nome di chi le ha definite per primo, comprendono[8]
- Interazioni dipolo-dipolo, che si stabiliscono tra molecole caratterizzate da dipoli elettrici permanenti

- Tra le interazioni dipolo-dipolo è opportuno ricordare il legame a idrogeno o ponte idrogeno, in cui è implicato un atomo di idrogeno legato con legame covalente ad elementi molto elettronegativi come fluoro, ossigeno o azoto (regola FON). Questi attraggono a sé gli elettroni di valenza, acquisendo una parziale carica negativa (δ-) lasciando l'idrogeno con una parziale carica positiva (δ+). Per avere un maggior numero di informazioni su questo tipo di interazioni rimando a questa pagina di wikipedia italiana.
- Interazioni (forze) di London o Interazioni (forze) di dispersione, che si stabiliscono tra una molecola caratterizzata da un dipolo istantaneo ed una caratterizzata da un dipolo istantaneo dovuto alla vicinanza con la prima molecola. La ragione per la quale questa seconda molecola è in grado di essere polarizzata è che i suoi elettroni sono liberi di muoversi lungo tutta la molecola, adattandosi così ai dipoli circostanti. Questa visione aiuta a capire perché le molecole più grandi risultano più polarizzabili.
È opportuno notare che le interazioni di dispersione si possono stabilire tra tutte le molecole, anche tra quelle con dipoli permanenti, e che sono di solito più forti rispetto a quelle dipolo-dipolo. - Interazioni dipolo-dipolo indotto, che si stabiliscono tra una molecola caratterizzata da un dipolo elettrico permanente e una caratterizzata da un dipolo elettrico indotto dalla vicinanza alla prima molecola. Spesso ci si riferisce solo a queste ultime interazioni col termine di "Forze di Van der Waals".
Alla forza di van der Waals si attribuisce l'abilità del geco di camminare su superfici lisce senza l'uso di secrezioni adesive (le estremità delle sue zampe sono ricoperte da milioni di peli che moltiplicano le deboli forze elettromagnetiche di interazione con la superficie).[9]
Soluzioni e Dispersioni
[modifica | modifica sorgente]Due sostanze presenti dentro uno stesso ambiente di reazione che danno vita ad un sistema omogeneo, cioè dalle caratteristiche costanti per volumi piccoli a piacere, costituiscono una soluzione. Il caso contrario della soluzione è la dispersione, dove una sostanza risulta frammentata e distribuita all'interno dell'altra. Alla prima sostanza è attribuito il nome di fase dispersa, alla seconda quello di fase disperdente. La fase disperdente può essere un gas o un liquido. La fase dispersa può essere un gas, un liquido e anche un solido. Il fumo è una dispersione di solidi in un gas. La nebbia è un esempio di un liquido disperso in un gas. Un caso particolare di dispersione è quello di un solido in un liquido, detto dispersione colloidale o sol. Un sol diventa gel quando venga modificato in modo che i solidi si uniscano tra loro occupando tutto il volume prima occupato dal liquido.
Cenni sulla nomenclatura
[modifica | modifica sorgente]Riporto per comodità le regole per la nomenclatura delle sole sostanze inorganiche che verranno citate in questo libro.
Ossiacidi
[modifica | modifica sorgente]Gli ossiacidi vengono indicati con la formula generale HXO, per distinguerli dagli idrossidi (XOH).
La nomenclatura degli ossiacidi evidenzia il grado di ossidazione dell'elemento caratteristico:
- -oso: numero di ossidazione minore tra tutti quelli che può avere negli ossiacidi che è in grado di formare
- -ico: numero di ossidazione maggiore tra tutti quelli che può avere negli ossiacidi che è in grado di formare
Un esempio: acido solforoso (H2SO3, S=+4); acido solforico (H2SO4, S=+6)
Se i numeri di ossidazione possibili sono più di 2, si usa -ipo per il numero di ossidazione più basso e per- per il più alto.
Nei sali e anioni -oso e -ico sono sostituiti da -ito e -ato
Approfondimenti
[modifica | modifica sorgente]- Ossigeno singoletto
- Tutto quello che non avete mai osato chiedere sull'ossigeno singoletto
- Storia della scoperta di alcune caratteristiche descritte in questo capitolo
- L. Pauling. G. N. Lewis and the chemical bond. Journal of Chemical Education, 61(3), 201 (1984)
Bibliografia
[modifica | modifica sorgente]- ↑ A.F. Ismail, L.I.B. David (2001) A review on the latest development of carbon membranes for gas separation. Journal of Membrane Science, 193, 1-18
- ↑ Sito di Chimica di Mark Bishop
- ↑ D.R. Kearns. Physical and chemical properties of singlet molecular oxygen. Chemical Reviews 71(4):395-427 (1971)
- ↑ C. Schweitzer and R. Schmidt Physical Mechanisms of Generation and Deactivation of Singlet Oxygen. Chemical Reviews 103:1685-1757 (2003)
- ↑ Definizione di elettronegatività data dalla IUPAC
- ↑ Pauling L. The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms. Journal of the American Chemical Society, 54(9), 3570–3582 (1932)
- ↑ IUPAC (1994). "van der Waals forces". Compendium of Chemical Terminology Internet edition.
- ↑ "van der Waals forces" Encyclopædia Britannica. 2008. Encyclopædia Britannica Online. 19 Aug. 2008.
- ↑ Kellar Autumn; Metin Sitti; Yiching A. Liang; Anne M. Peattie; Wendy R. Hansen; Simon Sponberg; Thomas W. Kenny; Ronald Fearing; Jacob N. Israelachvili; Robert J. Full. "Evidence for van der Waals adhesion in gecko setae". Proceedings of the National Academy of Sciences of the USA 2002, 99, 12252-12256