Chimica per il liceo/La materia/P
Una versione più sintetica della pagina si trova qui.
Che cos'è la materia?
[modifica | modifica sorgente]Possiamo definire la chimica come la scienza che studia la composizione della materia e i suoi cambiamenti, ma che cos'è la materia? Tutto quello che ci circonda, le cose e i corpi, sono fatti di materia. Non è semplice dare una definizione univoca e rigorosa di questo termine, per i nostri scopi consideriamo la seguente:
materia è tutto ciò che occupa uno spazio e possiede una massa, e può essere percepito con i nostri sensi.

Per studiare le proprietà della materia si prende in considerazione di volta in volta una sua porzione delimitata, chiamata sistema.
Un sistema è una porzione delimitata di materia che è oggetto di studio, separata dall'esterno da un confine reale o immaginario.
Se osserviamo attentamente quello che abbiamo intorno ci rendiamo conto che esistono diversi tipi di materia, che comunemente chiamiamo “materiali”, che hanno delle caratteristiche che li rendono adatti ad utilizzi particolari: per esempio usiamo il vetro per costruire un bicchiere e il legno per costruire un tavolo, non viceversa.
I materiali, e quindi la materia, a loro volta sono costituiti da una o più sostanze pure dotate di particolari proprietà che le rendono una diversa dall'altra. Queste proprietà si distinguono in proprietà fisiche e proprietà chimiche e di seguito ne verranno spiegate le differenze
In natura però è praticamente impossibile trovare una sostanza pura: anche l’acqua che beviamo e l’aria che respiriamo sono dei miscugli. Le sostanze pure normalmente si ottengono a partire da miscugli grazie a delle tecniche di separazione sfruttando le proprietà fisiche o chimiche delle sostanze. Nella maggior parte dei casi quelle che sembrano sostanze pure in realtà sono miscele che contengono quantità infinitamente piccole di altre sostanze, in questo caso si parla di sostanze in tracce o impurità.
I componenti della materia: elementi e composti
[modifica | modifica sorgente]
La materia dunque è fatta da sostanze: sono queste i più semplici costituenti della materia?. Immaginiamo di avere a disposizione dell’acqua pura, ottenuta mediante distillazione. Sottoponendo l’acqua ad elettrolisi, un processo che utilizza la corrente elettrica per far avvenire delle reazioni chimiche (argomento che si approfondirà al triennio), è possibile scomporre l’acqua in due sostanze, l’idrogeno e l’ossigeno. Queste due sostanze non possono essere scomposte in sostanze più semplici, infatti idrogeno e ossigeno fanno parte di quel centinaio di “mattoncini” di base di cui tutta la materia è formata. Queste sostanze, che non possono essere scomposte ulteriormente sono, dette sostanze elementari o, semplicemente, elementi.
Un elemento è una sostanza che non può essere scomposta mediante reazione chimica in sostanze più semplici né con metodi chimici né fisici.
L’acqua invece è un composto poiché può essere scomposta in idrogeno e ossigeno mediante elettrolisi.
Un composto è una sostanza che può essere scomposta in due o più sostanze elementari attraverso metodi chimici o fisici.
Le proprietà chimiche e fisiche dei composti sono sempre diverse rispetto a quelle degli elementi che li costituiscono, si tratta infatti di sostanze diverse. Se consideriamo sempre l’acqua, a temperatura ambiente questa è un liquido incolore mentre ossigeno e idrogeno alla stessa temperatura sono gas.
Ad ogni elemento chimico è assegnato un nome, che deriva generalmente dal greco o dal latino e fa riferimento proprio ad alcune caratteristiche tipiche di ciascun elemento, ad esempio l’idrogeno, “generatore d’acqua”, deriva dal greco ὕδωρ, hýdor, “acqua”, più la radice γεν-, ghen-, “generare”, mentre il carbonio deriva dal latino carbo, “carbone”; in alcuni casi il nome dell’elemento deriva da un luogo geografico (ad esempio il germanio, il californio) o da un illustre scienziato (le einsteinio).
Ogni elemento viene indicato in modo univoco da un simbolo. I criteri per l’attribuzione del simbolo sono stati definiti dal chimico svedese Berzelius all’inizio dell’Ottocento e sono i seguenti: il simbolo corrisponde alla prima lettera del nome latino dell’elemento, scritta sempre maiuscola (ad esempio H per l’idrogeno, C per il carbonio, O per l’ossigeno, N per l’azoto, nitrogenum in latino, e così via), seguita, nel caso in cui più elementi abbiano la stessa iniziale, da una seconda lettera, scritta sempre minuscola (ad esempio He per l’elio, Ca per il calcio, Na per il sodio, natrium). Nel caso in cui anche la seconda lettera sia in comune, si utilizza la terza, come nel caso del magnesio, Mg, e del manganese, Mn. Nel caso di un simbolo a due lettere queste vengono sempre pronunciate staccate: ad esempio Mg “emme-gi”, He “acca-e” e così via.
| Nome elemento | Nome latino | Simbolo | Etimologia |
| Azoto | Nitrogenum | N | dal greco a=non e zon=vita |
| Elio | Helium | He | dal greco Helios=Sole |
| Sodio | Natrium | Na | da latino Sodium=soda |
| Carbonio | C | dal latino carbo-carboonis= carbone | |
| Mercurio | Hydrargyrum | Hg | dal lat. mediev. mercurius (pianeta e divinità)
Hydra-argyrum = acqua d’argento |
| Oro | Aurum | Au | dal latino aurum |
Abbiamo visto prima che però spesso la materia si presenta sotto forma di composti. Anche i composti possono venire rappresentati in modo simbolico mediante una formula chimica. La formula chimica dell’acqua, che tutti conosciamo, è:
H2O
si legge “acca-due-o” e sta ad indicare che in ogni molecola d’acqua ci sono due atomi di idrogeno legati ad uno di ossigeno (i concetti di atomo e molecola, le particelle fondamentali della materia, saranno approfonditi in seguito).
Struttura della materia: proprietà fisiche e chimiche e modello particellare
[modifica | modifica sorgente]Come abbiamo visto in precedenza, ogni sostanza possiede un insieme di caratteristiche che la rendono diversa da tutte le altre. Queste caratteristiche si suddividono in due diversi tipi di proprietà: le proprietà fisiche e le proprietà chimiche.
Le proprietà fisiche sono caratteristiche direttamente percepibili dai nostri sensi, come il colore, la forma, l’odore, o che possono essere determinate mediante appositi strumenti senza che si verifichi un cambiamento della composizione chimica della sostanza. Si tratta di proprietà osservabili a livello di corpi, di oggetti e di sistemi di dimensioni discrete, sono quindi proprietà macroscopiche della materia.
Le proprietà chimiche sono legate invece ai cambiamenti di composizione della materia. Possono essere determinate solo durante le trasformazioni chimiche, o reazioni, che alterano la composizione chimica delle sostanze coinvolte trasformandole in altre. Quando si parla di caratteristiche chimiche di fatto ci si riferisce ad un’unica caratteristica, la reattività, ovvero il modo in cui la sostanza reagisce. Le proprietà chimiche delle sostanze sono proprietà microscopiche, che non siamo in grado di osservare direttamente: per fare un esempio, possiamo osservare direttamente che l’acqua è un liquido trasparente incolore (proprietà fisiche) ma non siamo in grado di capire che l’acqua è costituita da idrogeno e ossigeno (proprietà chimica) solo sulla base di una semplice osservazione .

La percezione sensoriale ci consente di interpretare alcune delle proprietà della materia. Ci sono dei fenomeni che riguardano delle proprietà nascoste che necessitano di altri tipi di indagine. Come spiegare, per esempio, l’apparente scomparsa dello zucchero quando viene sciolto nel caffè? O di una goccia d’inchiostro che lascio cadere in un bicchiere d’acqua? Sono solo alcuni esempi dei molti fenomeni che sono facilmente spiegabili se si ipotizza che la materia sia costituita da particelle piccolissime, invisibili mediante strumenti ottici. In questo modo posso immaginare che le numerosissime piccole particelle presenti nella goccia d’inchiostro si disperdano nel grande volume dell’acqua, mescolandosi alle particelle di quest’ultima.
Anche chi affronta lo studio della chimica per la prima volta già sa che la materia è fatta di atomi anche se non sa darne una corretta definizione o non sa citare prove della loro esistenza.
L’idea di una natura particellare della materia nasce già nell’antica Grecia sulla base di considerazioni filosofiche. In particolare Democrito, già quattro secoli prima della nascita di Cristo, aveva formulato una “teoria atomista” per spiegare la natura della materia, anche se l'opera che contribuisce a far arrivare agli scienziati questa teoria è il De rerum natura di Lucrezio (I secolo a.C.). Con le dovute modificazioni, le linee essenziali di questa teoria, supportate dalle evidenze sperimentali chiare e precise della chimica moderna, sono state riprese ventidue secoli dopo e sono alla base del modello particellare della materia, a partire dal primo modello atomico formulato da Dalton nel 1803.
Nell’ambito di questo modello ciascuna sostanza è diversa dalle altre perché diverse sono le particelle, atomi e molecole, che la costituiscono.
Come detto in precedenza, tutta la materia, nonostante i milioni e milioni di sostanze presenti in natura o prodotti dall’uomo, è riconducibile a un centinaio di elementi di base. Sulla base del modello particellare possiamo dare un’altra definizione di elemento:
ogni elemento è costituito da atomi di uno stesso tipo, che hanno cioè identiche proprietà chimiche.
In pratica, se immaginiamo di prendere un campione di un qualsiasi elemento chimico puro, per esempio un blocco di ferro, e di scomporlo in porzioni sempre più piccole arriveremo alla fine a una singola particella, l’atomo, che conserva tutte le proprietà chimiche dell’elemento ferro.
Gli elementi chimici in generale sono formati da atomi, alcuni (idrogeno, ossigeno, azoto, fluoro, cloro, bromo, iodio) sono costituiti da atomi legati in coppie: H2, O2, N2, F2, Cl2, Br2, I2. Il numero in basso a destra del simbolo chimico, indica il numero di atomi e viene chiamato indice numerico. Due atomi, legati strettamente l’uno all'altro, formano una molecola. Altri quattro elementi esistono sotto forma di molecole più complesse. Fosforo e arsenico hanno molecole formate da quattro atomi: P4, As4. Zolfo e selenio possiedono anch’essi molecole complesse, formate da otto atomi: S8, Se8.

Una molecola è un raggruppamento di due o più atomi che possiede proprietà chimiche caratteristiche.
La maggior parte delle sostanze sono composti, con una composizione definita a cui partecipano atomi di diversi elementi. I composti hanno quindi molecole costituite da atomi di natura diversa.
In base a quanto detto:
la molecola è la più piccola parte di un elemento (vd. casi particolari) o di un composto che conserva le proprietà chimiche dell’elemento o del composto stesso.
Possiamo ora comprendere meglio il significato di proprietà macroscopiche e proprietà microscopiche della materia: un singolo atomo o una singola molecola di un composto conservano tutte le proprietà chimiche della sostanza da cui provengono.
Le proprietà chimiche delle sostanze sono proprietà microscopiche perché dipendono dalla natura degli atomi e delle molecole che costituiscono le sostanze.
Un singolo atomo o una singola molecola non possiedono invece le proprietà fisiche caratteristiche dell’elemento o del composto da cui provengono: è privo di significato parlare di colore o di temperatura di ebollizione di una singola molecola d’acqua!
Le proprietà fisiche di una sostanza sono proprietà macroscopiche perché derivano dagli effetti cooperativi di un enorme numero di atomi o di molecole.
Le proprietà fisiche
[modifica | modifica sorgente]Secondo il modello particellare le proprietà fisiche sono quindi le proprietà tipiche di un agglomerato di particelle che vengono determinate in porzioni di materia che possiamo vedere e toccare. Alcune di queste proprietà dipendono dalle condizioni di temperatura e pressione a cui è sono osservate, come nel caso dello stato fisico.
Le proprietà fisiche delle sostanze possono essere classificate in proprietà intensive e proprietà estensive: sono proprietà intensive quelle che non dipendono dalle dimensioni del campione in esame, come ad esempio il colore di una sostanza o lo stato fisico, mentre sono proprietà estensive quelle che dipendono dalle dimensioni, come la massa e il volume.
Le proprietà chimiche delle sostanze sono sempre intensive.
Gli stati di aggregazione della materia
[modifica | modifica sorgente]Lo stato fisico delle sostanze è una delle caratteristiche principali che possiamo osservare direttamente nella materia che ci circonda: per esempio l’acqua, l’olio e l’aceto sono liquidi mentre il legno o una barra di ferro sono solidi. Solido e liquido sono due degli stati fisici in cui la materia si presenta. Il terzo stato fisico, quello aeriforme, è molto meno evidente ai nostri sensi: è quello che caratterizza l’aria che ci circonda o che è contenuto in un palloncino.
Sostanze diverse, a parità di condizioni ambientali, possono trovarsi in stati fisici diversi, per esempio a 20 °C l’acqua è liquida mentre il ferro è solido. D’altro canto lo stato fisico di una sostanza dipende dalle condizioni ambientali: l’esempio più comune è quello dell’acqua, che è solida nella vaschetta del ghiaccio del freezer a -18°C, liquida a temperatura ambiente e aeriforme sopra una pentola in ebollizione.
Ogni stato fisico presenta caratteristiche specifiche:
- i solidi hanno volume e forma propri e, se sottoposti a pressione, non si lasciano comprimere (cioè non modificano il proprio volume se sottoposti ad un aumento di pressione a temperatura costante);
- i liquidi hanno un volume proprio ma non la forma, infatti assumono la forma del recipiente che li ospita e come i solidi sono incomprimibili;
- gli aeriformi possono essere facilmente compressi, quindi non hanno né forma né volume propri in quanto occupano completamente il recipiente che li contiene.
Liquidi ed aeriformi per la loro tendenza a “fluire”, cioè a modificare la loro forma, vengono anche detti fluidi.
Lo stato aeriforme, a sua volta, può presentarsi come gas o come vapore, a seconda della temperatura alla quale si trova la sostanza. Se l’aeriforme si trova al di sotto della temperatura critica, può passare allo stato liquido o solido per sola compressione. In questo caso l’aeriforme viene detto vapore.
Se invece l’aeriforme si trova al di sopra della temperatura critica si parla di gas in quanto la sostanza rimane stabilmente allo stato aeriforme per quanto la si comprima.
Anche la temperatura critica è diversa per sostanze diverse: ad esempio l’elio, utilizzato per gonfiare i palloncini, in condizioni ambientali è un gas, la sua temperatura critica è infatti molto bassa, circa -268 °C, mentre l’acqua presente in atmosfera è in forma di vapore (la temperatura critica dell’acqua è vicina ai +374 °C).
Come possiamo spiegare le caratteristiche dei solidi, dei liquidi e dei gas? Anche in questo caso facciamo riferimento alla natura particellare della materia. Il modello che si presta a rappresentare la struttura degli stati fisici, noto come teoria cinetica - molecolare della materia, può essere così semplificato:
- tutta la materia è costituita da microscopiche particelle, gli atomi e le molecole;
- queste particelle sono in continuo movimento;
- la velocità con cui si muovono le particelle dipende dalla temperatura: più è alta, più veloce sarà il movimento;
- le particelle si attraggono tra di loro mediante forze attrattive che diventano sempre più deboli passando dallo stato solido, al liquido e all’aeriforme.
- solidi, liquidi e gas differiscono per la diversa libertà di movimento che hanno le particelle: nei solidi le particelle oscillano e vibrano, intorno a delle posizioni fisse; nei liquidi le molecole sono a contatto, ma hanno maggiore libertà di movimento; infine, per i gas la libertà di movimento è massima e il moto molecolare è assolutamente disordinato.

L'acqua nei tre stati di aggregazione

Da questo modello possiamo dedurre che lo stato fisico delle sostanze dipende dal modo in cui le particelle si aggregano: se da un lato le particelle tendono a mantenersi in uno stato di continuo movimento dall’altro tendono a legarsi tra di loro grazie alle forze attrattive che si instaurano tra di esse. La risultante di queste due tendenze opposte determina il modo con cui le particelle si aggregano nei tre stati fisici, che proprio per questo motivo vengono anche detti stati di aggregazione della materia.
Pertanto:
- nello stato solido le particelle sono disposte in modo ordinato e compatto. Le forze attrattive che si instaurano tra di esse sono stabili e ne impediscono lo spostamento, per cui le particelle vibrano attorno a posizioni fisse formando un’impalcatura rigida. Questo tipo di aggregazione spiega perché un solido è caratterizzato da volume e forma propri e non è comprimibile.
- Nello stato liquido le particelle, pur essendo in stretto contatto tra di loro, sono libere di muoversi scorrendo le une sulle altre. I legami che si formano non sono stabili ma si rompono e riformano continuamente consentendo alle particelle di cambiare velocemente posizione (hanno energia sufficiente per vincere almeno in parte le forze attrattive). Per questo motivo un liquido non ha una forma propria ma la adatta al contenitore in cui è posto. Non è però comprimibile e ha un volume proprio.
- Lo stato aeriforme è quello che presenta lo stato di massimo disordine. Le particelle sono molto distanti le une dalle altre, la loro energia cinetica è così elevata che non risentono più delle reciproche forze di attrazione e sono libere di muoversi occupando tutto lo spazio a loro disposizione. Questa mancanza di aggregazione giustifica il fatto che i gas non hanno né volume né forma propria e sono comprimibili.
Per concludere, se una sostanza è solida, liquida o aeriforme dipende da quanto si muovono le particelle. Provate a immaginarvi nella situazione delle particelle: siete ad un concerto in mezzo alla folla accalcata e non riuscite a muovervi, potete al massimo saltellare sul posto. E’ così che potete pensare alle particelle all’interno di una materia solida. Chi si trova nel prato sotto il palco riesce a saltellare scatenato, si muove di più anche se continua a interagire con tutti quelli che ha intorno, proprio come le particelle all’interno di un liquido. Ancora più scatenate sono le particelle all’interno dell’aria che respiriamo, come il pubblico del concerto se l’area dove si svolge permettesse a tutti di scorrazzare liberamente e fare capriole senza intralciare nessuno.
Altre proprietà fisiche della materia
[modifica | modifica sorgente]Oltre allo stato di aggregazione ogni sostanza presenta molte altre proprietà intrinseche che le rendono diversa dalle altre. Fra le proprietà fisiche intensive ricordiamo:
- il colore;
- la temperatura di fusione, a cui avviene il passaggio da stato solido a quello liquido;
- la temperatura di ebollizione, a cui avviene il passaggio dallo stato liquido a quello aeriforme;
- la conducibilità elettrica, che rappresenta la capacità di una sostanza essere percorsa da una corrente elettrica;
- la conducibilità termica, cioè la capacità di trasferire calore;
- la densità, cioè il rapporto tra massa e volume;
- la solubilità, rappresentata dal rapporto tra la quantità massima della sostanza che può essere sciolta ad una certa temperatura in 100 mL di solvente;
- la duttilità, cioè l’attitudine di una sostanza a lasciarsi ridurre in fili sottili senza spezzarsi (caratteristica di molti metalli);
- la malleabilità, cioè l’attitudine a lasciarsi ridurre in lamine sottili senza rompersi (anche questa tipica dei metalli);
- la viscosità, che misura la resistenza di un fluido allo scorrimento.
Queste proprietà fisiche non dipendono dalle dimensioni del campione in esame ma possono variare a seconda delle condizioni ambientali a cui vengono osservate, ad esempio la malleabilità e la duttilità aumentano con l’aumento di temperatura, la viscosità diminuisce. Molte di queste proprietà sono importanti per l’utilizzo tecnologico dei materiali.
Le principali proprietà fisiche estensive, che invece dipendono dalle dimensioni del campione, sono la massa, il volume, la superficie, la lunghezza. A differenza delle proprietà intensive, quelle estensive si possono sommare: se a 500 g d’acqua aggiungiamo 500 g di altra acqua alla fine avremo 1000 g, cioè 1 kg d’acqua (la massa è infatti una proprietà estensiva). Se consideriamo la densità (proprietà intensiva), aggiungendo ai primi 500 g d’acqua, la cui densità è pari a 1kg/dm3, altri 500 g d’acqua, la densità dei 1000 g risultanti sarà sempre di 1kg/dm3.
Le trasformazioni fisiche
[modifica | modifica sorgente]La materia subisce continue trasformazioni, pensiamo per esempio a quello che succede ad un cubetto di ghiaccio lasciato a temperatura ambiente che si trasforma in acqua liquida, oppure alla dilatazione dei solidi che si verifica con l’aumento della temperatura.
Quando le trasformazioni riguardano variazioni nella forma, nelle dimensioni o nello stato fisico della materia in esame, i cambiamenti si verificano soltanto nello stato di aggregazione delle particelle, mentre la composizione delle sostanze che la costituiscono rimane invariata. Si definiscono quindi:
trasformazioni fisiche le trasformazioni che avvengono senza variazione della composizione chimica delle sostanze coinvolte.
In altre parole, in una trasformazione fisica non si formano nuovi materiali e quindi le particelle presenti prima e dopo la trasformazione sono le stesse.
I passaggi di stato
[modifica | modifica sorgente]Tra le varie trasformazioni fisiche che la materia può subire la più importante è il cambiamento del proprio stato fisico che avviene quando è sottoposta a variazioni di temperatura e/o di pressione. Il cubetto di ghiaccio diventa acqua liquida a temperatura ambiente grazie all’aumento della temperatura. Il liquido sotto pressione contenuto in una bomboletta diventa gas quando lo facciamo uscire premendo l’erogatore a causa della diminuzione della pressione.

Le trasformazioni da uno stato fisico all’altro vengono dette passaggi di stato.
Essi sono:
- la fusione, il passaggio da solido a liquido;
- la solidificazione, il passaggio inverso, da liquido a solido;
- l’evaporazione, il passaggio da liquido ad aeriforme;
- la condensazione, il passaggio inverso, da aeriforme a liquido.

Alcune sostanze possono passare direttamente dallo stato solido a quello aeriforme con un passaggio di stato che viene chiamato sublimazione. L’esempio più comune di sublimazione è quello della naftalina, che viene usata come antitarme: le palline solide vengono poste all’interno degli armadi e si trasformano in vapore dall’odore caratteristico. Anche quello che viene chiamato “ghiaccio secco” (CO2 in forma solida) a temperatura ambiente sublima, passando direttamente da solido a gas.
Il passaggio inverso della sublimazione, da aeriforme a solido, è il brinamento. L’esempio più tipico di brinamento è quello che si può osservare in inverno, quando a causa delle basse temperature il vapor acqueo dell’atmosfera si trasforma direttamente in cristalli di ghiaccio sui fili d’erba nei campi.

Anche i passaggi di stato possono essere spiegati considerando il modello particellare. Le particelle di una sostanza solida sono unite strettamente tra loro e sono molto limitate nei loro movimenti. L’aumento di temperatura consente loro delle vibrazioni maggiori ma ancora fortemente limitate (possiamo spiegare in questo modo le dilatazioni più o meno ampie che si verificano nei materiali solidi con il riscaldamento). Quando si raggiunge una certa temperatura, quella di fusione, le vibrazioni riescono ad allentare le forze attrattive fino a consentire alle particelle di abbandonare la posizione fissa e di muoversi scorrendo le une sulle altre: si ha quindi un cambiamento dello stato di aggregazione delle particelle che si manifesta con il passaggio dallo stato solido allo stato liquido. Se si continua ad aumentare la temperatura una volta completata la fusione, i movimenti delle particelle diventeranno via via sempre più ampi fino a vincere completamente le forze di attrazione consentendo loro di sfuggire nell’ambiente circostante: si è verificato il passaggio allo stato aeriforme.
Il raffreddamento al contrario causa un rallentamento dei moti particellari, con conseguente aumento delle forze attrattive che costringono le particelle ad avvicinarsi.
Per il passaggio di stato da liquido ad aeriforme è importante distinguere tra evaporazione ed ebollizione. Se prendiamo ad esempio l’acqua essa evapora a qualsiasi temperatura mentre bolle solo alla sua temperatura di ebollizione, che è 100 °C alla pressione di 1 atm al livello medio del mare. In che cosa consiste la differenza? L’evaporazione è il passaggio dallo stato liquido a quello aeriforme che avviene in maniera lenta è che coinvolge solo la superficie libera del liquido. Possiamo verificarlo lasciando un bicchiere d’acqua a temperatura ambiente: le molecole si libereranno dalla superficie e finiranno nell’aria che circonda il bicchiere, il livello dell’acqua molto lentamente scenderà (dopo giorni potremmo anche trovare il bicchiere vuoto). L’ebollizione è invece il passaggio di stato turbolento che interessa tutta la massa del liquido in questione e avviene, per ogni valore di pressione, a una temperatura specifica, caratteristica di ciascuna sostanza (è una proprietà fisica intensiva). L’ebollizione dà luogo alla formazione di bolle in tutto il volume del liquido da cui si libera il vapore.

L’evaporazione è il passaggio dallo stato liquido a quello aeriforme che avviene dalla superficie libera di un liquido a qualsiasi temperatura sopra il punto di congelamento.
L’ebollizione è il passaggio dallo stato liquido a quello aeriforme che avviene ad una determinata temperatura, caratteristica di ogni sostanza, e interessa l’intera massa del liquido.

Pertanto solo alla temperatura di ebollizione le molecole acquisiscono l’energia cinetica necessaria per liberarsi dall'intera massa liquida anche partendo dal fondo del contenitore.
È altresì interessante analizzare la curva di riscaldamento di una sostanza pura come l’acqua e confrontarla con quella di una soluzione come l’acqua di mare.
Solo per le sostanze pure è possibile identificare le soste termiche che corrispondono a una temperatura specifica (punto di fusione e punto di ebollizione) che non varia durante la trasformazione di tutta la massa di sostanza anche se essa riceve energia termica dall'ambiente.
Ad esempio l’acqua (curva blu) possiede una sosta termica di fusione a 0°C e una sosta termica di ebollizione circa 7 volte più lunga a 100°C. In base alla teoria cinetica, si possono interpretare le soste termiche come periodi di tempo in cui il calore fornito viene utilizzato per vincere le forze di coesione tra le particelle e per questo non può manifestarsi attraverso l’aumento della temperatura (si chiama infatti calore latente ed è una proprietà intensiva della materia: per l’acqua è pari a 80 Kcal/g per la fusione e 540 Kcal/g per l’ebollizione, cioè una quantità circa 7 volte maggiore in quanto serve molta più energia per allontanare definitivamente le molecole rispetto a quella necessaria per indebolire le forze attrattive tra di esse).
Nella curva di riscaldamento dell’acqua di mare (curva rossa tratteggiata) invece non sono presenti soste termiche, ma la temperatura sale anche se lievemente, poiché si tratta di miscugli chimicamente eterogenei, come vedremo nel paragrafo 6 di questo capitolo.
Infine ricordiamo che il punto di fusione coincide con quello di solidificazione così come il punto di ebollizione coincide con quello di condensazione per una determinata sostanza pura, essendo le temperature dei passaggi di stato proprietà intensive della materia ed esse variano in funzione della pressione.
In particolare l’acqua bolle a una temperatura minore di 100°C in montagna, dove la pressione atmosferica è minore in quanto diminuisce con la quota. Questo fatto si può spiegare considerando la diminuzione della tensione di vapore sulla superficie del liquido, cioè la pressione esercitata dal vapore in equilibrio con il proprio liquido puro, che aumenta con l’aumentare della temperatura. Se diminuisce la pressione atmosferica, basterà una temperatura minore per raggiungere una tensione di vapore che uguagli la pressione esterna permettendo l’ebollizione. Al contrario una pressione elevata (come accade nella pentola a pressione) contrasta l’espansione tipica del passaggio di stato liquido-vapore, per cui occorrono temperature più alte. Il passaggio solido-liquido invece non è solitamente influenzato dall’aumento di pressione essendoci poco aumento di volume, con l’eccezione dell’acqua, che a differenza delle altre sostanze aumenta di volume quando solidifica (la densità massima dell’acqua è a 4°C ed è il motivo per cui il ghiaccio galleggia). Per questo motivo se il ghiaccio è sottoposto a forti pressioni fonde a temperature inferiori a 0°C.
Esempi di altre trasformazioni fisiche
[modifica | modifica sorgente]La maggior parte delle trasformazioni fisiche che osserviamo, o che operiamo noi stessi, nell’ambiente che ci circonda, sono riconducibili ai passaggi di stato, pensiamo ad esempio alla formazione delle nuvole o ad una candela accesa che fonde.
Molte delle trasformazioni fisiche che non coinvolgono i passaggi di stato riguardano variazioni nella forma e nelle dimensioni della materia: quando sbucciamo una mela, la tagliamo a fette oppure la centrifughiamo operiamo delle trasformazioni fisiche. Possiamo ricondurre a questo tipo di trasformazioni la dilatazione termica di un solido, la riduzione di un lingotto di rame in fili o in lamine sottili, la rottura di un vetro.
Altri esempi di trasformazioni fisiche sono:
- la dissoluzione di un solido in acqua: come vedremo nel paragrafo 6, questo processo porta alla formazione di una soluzione ed è favorito dall’aumento di temperatura, ma non cambia la composizione della materia, in quanto i soluti si sciolgono nel solvente, ma la trasformazione è reversibile semplicemente diminuendo la temperatura.
- La lavorazione dei metalli: la riduzione di un lingotto di metallo in lamine sottili o in fili grazie alla malleabilità e duttilità che caratterizza la maggior parte dei metalli.
- L'effetto Joule, cioè il fenomeno per cui il passaggio di corrente elettrica, facendo resistenza con il conduttore, produce calore (come ad esempio il surriscaldamento di un filamento di tungsteno di una lampadina ad incandescenza che produce luce).
- L'induzione magnetica, cioè il fenomeno per cui un ago si magnetizza se viene avvicinato ad una calamita.
Le trasformazioni chimiche: le reazioni chimiche
[modifica | modifica sorgente]Le trasformazioni chimiche, chiamate semplicemente reazioni, sono trasformazioni della materia che avvengono con una variazione della composizione chimica delle sostanze coinvolte che si trasformano in nuove sostanze. Sono trasformazioni che riguardano la natura delle sostanze e quindi le particelle (molecole) presenti prima dell’interazione sono differenti da quelle presenti dopo la trasformazione.
Le sostanze presenti all’inizio della reazione vengono dette reagenti, le sostanze che si ottengono alla fine sono i prodotti.
Il decorso di una reazione chimica viene rappresentato simbolicamente in questo modo:

in cui reagenti e prodotti vengono indicati normalmente mediante le formule chimiche che li rappresentano. Tale scrittura simbolica è detta equazione chimica e si può leggere “i reagenti XX reagiscono per dare i prodotti YY”.
La reazione comporta un nuovo riarrangiamento degli atomi presenti nelle molecole iniziali con rottura e formazione di legami chimici tra atomi. Si capirà meglio come avvengono le reazioni chimiche dopo aver approfondito la conoscenza della struttura atomica e dei legami chimici (legame covalente, ionico e metallico). Per ora consideriamo alcuni aspetti fondamentali:
- nelle reazioni chimiche si rompono e si riformano legami intramolecolari; nelle trasformazioni fisiche si rompono e formano invece legami intermolecolari (che abbiamo chiamato in precedenza genericamente “forze attrattive” da cui dipende lo stato di aggregazione);
- le reazioni chimiche non creano né distruggono atomi e non non modificano mai la natura degli atomi presenti ma soltanto il modo in cui si legano tra loro: se consideriamo ad esempio la reazione di decomposizione dell’acqua che avviene con l’elettrolisi, le molecole d’acqua (H2O) presenti all’inizio (reagenti) sono costituite da due atomi di idrogeno legati ad un atomo di ossigeno; nel corso della reazione questi legami si rompono e si formano nuovi legami fra atomi di idrogeno e fra atomi di ossigeno che portano alla formazione delle molecole biatomiche dell’idrogeno (H2) e dell’ossigeno (O2), prodotti della reazione;
- le reazioni nucleari non fanno parte delle reazioni chimiche in quanto comportano un cambiamento nella natura degli atomi (la trasformazione dei nuclei atomici).
Come riconoscere una reazione chimica
[modifica | modifica sorgente]Le trasformazioni profonde della natura della materia non sono facilmente osservabili. Tuttavia ci sono delle evidenze sperimentali che ci consentono di capire se sta avvenendo una reazione chimica e di seguirne l’andamento:
- il cambiamento di colore (es. formazione della ruggine);
- lo sviluppo di gas (es. aspirina effervescente nell’acqua);
- la formazione di un solido, che nel linguaggio chimico si chiama precipitazione (es. la formazione di stalattiti e stalagmiti);
- la scomparsa di un solido (es. l’erosione della roccia calcarea da parte dell’acqua piovana);
- lo sviluppo o l’assorbimento di calore senza riscaldare o raffreddare (es. lo sviluppo di calore nella combustione o mescolando soda caustica e acido cloridrico);
- l’emissione di luce (es. fiamma che si osserva nella combustione);
- l’emanazione di gas profumati o maleodoranti (es. produzione di acido solfidrico dal caratteristico odore di uova marce nei processi di decomposizione anaerobica della materia organica)
Queste evidenze, che rappresentano gli aspetti qualitativi delle reazioni, possono non essere immediatamente riconoscibili se osservate nell'ambiente, dove avvengono simultaneamente moltissime reazioni e trasformazioni fisiche, ma sono facilmente evidenziabili nelle reazioni in laboratorio che vengono fatte avvenire in provetta, che sono fatte apposta per favorire l’osservazione.
Le reazioni chimiche presentano anche degli aspetti quantitativi di cui si parlerà nei prossimi moduli.
-
Filo di ferro arrugginito
-
Ferro fuso
-
Albume denaturato dal calore
-
La combustione del metano
-
Sviluppo di bollicine (effervescenza)
La materia: sistemi omogenei ed eterogenei
[modifica | modifica sorgente]Come evidenziato all'inizio del modulo, le sostanze pure non sono la regola nel mondo che ci circonda: nella maggior parte dei casi la materia si presenta come un sistema formato da due o più sostanze. Mescolanze di questo tipo si chiamano miscugli (o miscele).
Un miscuglio è un sistema costituito da due o più sostanze pure.
A differenza delle sostanze pure i miscugli non hanno delle caratteristiche ben definite: ad esempio sappiamo che l’acqua pura solidifica a 0° C ma qual è la temperatura di congelamento dell’acqua salata? Non c’è una risposta univoca, la temperatura varia in dipendenza della composizione della miscela di acqua e sale.
I miscugli possono essere omogenei o eterogenei. Che cosa significa? Per capire meglio questo concetto partiamo da alcune semplici osservazioni che possiamo fare nella vita di tutti i giorni. Cosa succede versando olio in un bicchiere che contiene acqua? I due liquidi tendono a stratificarsi restando separati: l’olio si porta in superficie, l’acqua rimane nella parte inferiore. Anche un cubetto di ghiaccio aggiunto ad un bicchiere d’acqua galleggia in superficie. Se consideriamo il sistema contenuto nel bicchiere, nel caso dell’acqua e olio diciamo che il sistema è costituito da due fasi liquide, nel caso di acqua e ghiaccio da una fase liquida e una fase solida.

Una fase è una porzione di un sistema delimitata e fisicamente distinguibile che presenta le proprietà intensive uniformi in ogni sua parte.
In altri termini, possiamo avere due fasi quando due sostanze diverse sono nello stesso stato fisico (acqua e olio) o quando la stessa sostanza è presente in due stati fisici diversi (in questo caso il sistema è fisicamente eterogeneo ma chimicamente omogeneo, si tratta della stessa sostanza).
Un sistema è fisicamente omogeneo quando presenta un’unica fase, ad esempio un bicchiere d’acqua, mentre è eterogeneo quando è costituito da due o più fasi: un bicchiere d’acqua frizzante è costituito da due fasi, quella liquida dell’acqua e quella gassosa delle bollicine di diossido di carbonio (CO2). Se aggiungiamo anche un cubetto di ghiaccio le fasi diventano tre. In questo caso abbiamo a che fare con un miscuglio, perché sono presenti due diverse sostanze.
I miscugli dal punto di vista chimico sono sempre eterogenei in quanto formati da più sostanze. Dal punto di vista fisico:
un miscuglio è omogeneo se si presenta in un’unica fase.
In pratica, un miscuglio è omogeneo quando le sostanze che lo costituiscono si mescolano in modo così uniforme che non sono distinguibili neanche al microscopio. Questo tipi di miscugli vengono anche detti soluzioni. L’acqua del mare è un esempio di miscuglio omogeneo.
I miscugli omogenei, essendo formati da un’unica fase fisica, hanno le stesse proprietà intensive (densità, colore, punto di fusione,...) in ogni loro parte.
Un miscuglio è eterogeneo se si presenta in due o più fasi facilmente distinguibili.
Le sostanze che costituiscono un miscuglio eterogeneo sono distinguibili a occhio nudo o con l’ausilio di un microscopio; in questi miscugli le proprietà intensive sono diverse in ogni punto (ogni componente del miscuglio rappresenta una fase del sistema che conserva le proprie caratteristiche). Alcuni miscugli eterogenei sono chiaramente distinguibili, come nel caso dell’acqua e olio, altre volte bisogna ricorrere ad un microscopio per osservare le caratteristiche non uniformi. Il latte è un tipico esempio di miscuglio che a prima vista sembra omogeneo ma in realtà non lo è: se ne osserviamo una goccia al microscopio si notano piccole goccioline di grasso immerse in un liquido trasparente.
Riepilogando, possiamo classificare tutta la materia nel seguente modo:

Oltre che in base alla loro natura omogenea o eterogenea, i miscugli possono essere classificati anche in base allo stato fisico dei loro componenti:
- miscugli solido-liquido
- miscugli liquido-liquido
- miscugli gas-liquido o liquido-gas
- miscugli gas-solido
- miscugli gas-gas
- miscugli solido-solido
Sostanze pure
[modifica | modifica sorgente]Le sostanze pure rappresentano un sistema chimicamente omogeneo nel senso che sono costituite da un singolo materiale e quindi non sono separabili con gli ordinari mezzi fisici.
Come abbiamo visto in precedenza, esse sono distinte in sostanze elementari, o elementi, se non sono trasformabili in sostanze ancora più semplici e in sostanze composte, o composti, se sono divisibili in sostanze elementari attraverso trasformazioni chimiche o reazioni.

Abbiamo già evidenziato più volte che in natura non si trovano normalmente sostanze pure. Prendiamo ad esempio l’acqua: quella che beviamo non è una sostanza pura, in quanto contiene sali minerali disciolti, mentre lo sono l’acqua distillata, ottenuta per distillazione e usata nei laboratori di chimica, e l’acqua demineralizzata, che si può ottenere per filtrazione attraverso resine a scambio ionico e viene usata ad esempio nel ferro da stiro e nel radiatore delle automobili per evitare le incrostazioni. L’acqua demineralizzata in realtà è “quasi” pura, presenta infatti ancora tracce di altre sostanze e impurità come gas disciolti e batteri. Anche quando utilizziamo delle tecniche di separazione (vedi paragrafo 3.6.4) per ottenere delle sostanze pure, difficilmente riusciamo a eliminare ogni traccia di impurità.

Come detto in precedenza, l’acqua è un composto, caratterizzata da una composizione definita e costante, rappresentata attraverso la formula chimica H2O.
Tale formula fornisce due tipi di informazioni: una qualitativa, cioè quali elementi costituiscono il composto (in questo caso, idrogeno e ossigeno) e l’altra quantitativa, cioè quanti atomi di ciascun elemento formano il composto, che in questo caso si può chiamare anche molecola intesa come raggruppamento di atomi (nell’acqua due atomi di idrogeno combinati con un atomo di ossigeno formano la molecola H2O).
L’acqua è divisibile nei suoi elementi costituenti (idrogeno e ossigeno) attraverso l’elettrolisi.

Idrogeno e ossigeno non sono invece trasformabili in sostanze più semplici, per cui sono sostanze elementari o elementi. Tutti i 118 elementi conosciuti, 92 naturali e i rimanenti artificiali, sono raggruppati nella Tavola Periodica degli Elementi, nella quale sono indicati con il loro simbolo convenzionale (ricordiamo che il simbolo dell’idrogeno è H e quello dell’ossigeno è O). Questa tabella rappresenta l'abbondanza degli elementi nell'universo.
L’atomo è la più piccola parte di un elemento che ne manifesta le proprietà chimiche tipiche. Alcuni elementi, tra cui H e O, esistono in natura sotto forma di molecole, cioè sono stabili se due atomi dello stesso elemento sono legati tra loro, per cui si possono rappresentare rispettivamente attraverso la formula H2 e O2, in cui l’indice “2”, posto in basso a destra dell’elemento a cui fa riferimento, ne indica il numero di atomi nella molecola, che in questo caso è detta “biatomica”.
Quindi esistono molecole formate da atomi uguali (le molecole degli elementi) e molecole formate da atomi diversi (le molecole dei composti). Tutte hanno dimensioni molto piccole, dell’ordine di grandezza del nanometro, cioè un miliardesimo di metro (la molecola dell’acqua ad esempio ha un diametro di circa 0,2 nm).
E’ molto importante scrivere correttamente le formule, poiché esse identificano le sostanze pure con proprietà chimiche caratteristiche. Ad esempio la formula dell’acqua H2O assomiglia molto a quella dell’acqua ossigenata H2O2, ma i due composti hanno proprietà molto diverse, tanto che la prima è uno dei costituenti più importanti degli organismi viventi, mentre la seconda ha notevoli proprietà ossidative che ne caratterizzano l’impiego come disinfettante e non può essere assolutamente bevuta (è altamente tossica se ingerita!). Un altro esempio riferito ad un elemento può essere la formula dell’ossigeno che sappiamo essere O2, la molecola biatomica presente nella bassa atmosfera e indispensabile per la vita (respirazione cellulare), ma esiste anche la molecola triatomica dell’ozono O3, che si forma nella stratosfera a circa 20 km di quota per l’azione dei raggi ultravioletti del Sole. ![]() Ozono e smog
Ozono e smog ![]()
La formula chimica di una sostanza quindi, sia essa una sostanza elementare come idrogeno e ossigeno oppure un composto come l’acqua, identifica in modo univoco la sostanza stessa, perciò non deve essere assolutamente modificata.Non bisogna dimenticare che in natura i sistemi sono formati da un numero molto elevato di particelle (atomi, molecole, ioni), che si può indicare anteponendo un coefficiente numerico davanti alla formula (ad esempio in una goccia d’acqua sono presenti circa 1021 molecole, cioè mille miliardi di miliardi!!!!!).
Anche una sostanza pura può formare un sistema fisicamente eterogeneo nel caso in cui siano presenti due fasi: è l’esempio di un bicchiere d’acqua con un cubetto di ghiaccio.
Miscugli eterogenei
[modifica | modifica sorgente]I miscugli eterogenei possono presentare aspetti assai diversi al variare dello stato di aggregazione dei costituenti. Quando mescoliamo ad un liquido un solido che non è in grado di sciogliersi in esso si ottiene una sospensione. Consideriamo ad esempio un miscuglio di acqua e farina: la farina rimane sospesa nell’acqua e, se lasciata a riposo, si deposita sul fondo. La fase solida rimane comunque sempre distinguibile da quella liquida, di conseguenza la sospensione appare torbida [fig. 3.xx].


Si forma un gel quando il solido nel liquido forma una microscopica rete che non consente più al liquido di fluire liberamente. Sono gel la gelatina, i budini e caramelle gommose. Un miscuglio di questo tipo è semisolido poiché presenta caratteristiche intermedie fra liquido e solido. Un miscuglio di questo tipo è semisolido poiché presenta caratteristiche intermedie fra liquido e solido. Si tratta in ogni caso di un miscuglio eterogeneo, anche se solo un‘osservazione al microscopio elettronico consente di distinguere visivamente le due fasi. I gel assieme ad altri tipi di miscugli eterogenei appartengono ad una categoria particolare, i colloidi.
I colloidi potrebbero essere scambiati per soluzioni: in realtà sono sistemi bifasici che presentano proprietà intermedie tra un miscuglio eterogeneo (sospensione) e uno omogeneo (soluzione). La fase disperdente è simile ad un solvente e quando prevale il colloide si chiama “sol”, come il citosol delle cellule e l’albume dell’uovo, mentre la fase dispersa è simile ad un soluto, con dimensione delle particelle compresa tra 1 micrometro e 1 nanometro, e quando prevale il colloide si chiama “gel”.Per distinguere i colloidi dalle soluzioni (miscugli omogenei) si può ricorrere alla luce: se facciamo passare un raggio di luce attraverso una soluzione questo la attraverserà completamente, mentre nel gel il raggio viene deviato dalle particelle solide e quindi non attraversa il miscuglio (questo fenomeno viene detto effetto Tyndall). [fig. 3.xx].
Quando due liquidi mescolati assieme si stratificano in due fasi ben distinte, come accade per esempio all’acqua e all’olio, si dicono immiscibili. Mescolando energicamente due liquidi immiscibili si forma un’emulsione, in cui i due componenti vengono ridotti in piccole goccioline intimamente mescolate tra loro rendendo difficile separare le due fasi. Le emulsioni sono particolarmente utilizzate in cucina (la maionese è un esempio di emulsione di olio, uovo e succo di limone) o in cosmetica (tutte le creme cosmetiche sono emulsioni di particolari sostanze a base oleosa in acqua), dove vengono mantenute stabili grazie alla presenza di altre sostanze chimiche (nella maionese questo ruolo è svolto dalla lecitina presente nel tuorlo). Senza queste sostanze emulsionanti le due fasi tendono a separarsi in poco tempo, come possiamo verificare molto facilmente lasciando a riposo un miscuglio di acqua e olio dopo averlo mescolato vigorosamente. Anche le emulsioni fanno parte dei sistemi colloidali.
Abbiamo già visto che anche un gas e un liquido possono formare dei miscugli eterogenei, come nel caso dell’acqua frizzante. Quando le bollicine di gas rimangono intrappolate nel liquido il cui sono disperse si forma una schiuma. Le schiume non sempre rimangono stabili a lungo, in quanto le bollicine di gas tendono a liberarsi dalla componente liquida. In cucina ci capita spesso di creare delle schiume che si mantengono nel tempo, pensiamo alla panna montata, che è appunto una schiuma formata da panna e aria, o agli albumi montati a neve. La schiuma di albumi montati e zucchero può essere cotta e trasformata in meringa, che è una schiuma solida. A differenza delle schiume gas-liquido, le schiume gas-solido (più semplicemente schiume solide) si mantengono nel tempo. Come esempi di schiume solide possiamo citare il pane lievitato, le spugne, la pietra pomice o anche materiali artificiali come il polistirolo espanso e la gommapiuma.
Anche la nebbia è un esempio di miscuglio di liquido-gas: in questo caso il gas (aria) rappresenta la fase prevalente in cui sono disperse le goccioline di liquido (vapore acqueo), al contrario della schiuma (bollicine di gas trattenute in un liquido).
Anche il fumo è un miscuglio eterogeneo di un solido e un gas, formato dalla sospensione nel mezzo gassoso di finissime particelle solide, che possono essere messe in evidenza applicando un filtro che le trattiene.
Come ultimo esempio di miscugli solido-solido possiamo citare alcune rocce, la più tipica è il granito, in cui la natura eterogenea del miscuglio dei vari minerali è chiaramente visibile a occhio nudo.
-
La maionese è una emulsione tra sostanze liquide
-
Fumo generato dalla combustione di idrocarburi
-
Schiuma: un miscuglio eterogeneo tra liquido e gas
-
La nebbia
-
Il granito è un miscuglio eterogeneo tra solidi
Miscugli omogenei
[modifica | modifica sorgente]Abbiamo visto che i miscugli omogenei sono caratterizzati da un'unica fase fisica. Essi vengono denominati comunemente soluzioni. Le soluzioni hanno un’enorme importanza: sono soluzioni l’aria che respiriamo, l’acqua che beviamo, molti liquidi biologici.
In una soluzione la sostanza più abbondante è detta solvente, quelle meno abbondanti soluti

Se i componenti di una soluzione inizialmente si trovano in fasi diverse, ad esempio acqua e zucchero, il soluto è anche il componente che cambia di fase nella soluzione.
In chimica si usa dire che “il simile scioglie il simile”: in base alle proprietà chimiche di entrambi i componenti e alla loro affinità, il solvente deve essere in grado di interagire con il soluto, nel senso che deve poter circondare completamente le particelle di soluto mediante la creazione di forze intermolecolari o di tipo elettrostatico più o meno intense. Il solvente deve “solvatare” completamente il soluto e nel caso dell’acqua, considerata il solvente universale per la sua abbondanza, deve “idratare” il soluto che abbia caratteristiche idrofile. Una sostanza che si scioglie facilmente in un solvente è detta solubile, mentre se non si scioglie viene definita insolubile.
Anche le sostanze solubili non possono essere miscelate con il solvente in tutti i rapporti possibili.
Una soluzione è detta satura se contiene la massima quantità possibile di soluto e si è venuto a formare il corpo di fondo.
Nel momento in cui si forma il corpo di fondo il miscuglio non è più omogeneo, si evidenzia una seconda fase.
La solubilità è la quantità massima di soluto che può sciogliersi in una data quantità di solvente a una certa temperatura. La solubilità dipende dalla natura chimica del soluto e dalla temperatura della soluzione. Nel caso dei soluti solidi la solubilità generalmente aumenta con la temperatura, come sappiamo intuitivamente: è molto facile sciogliere un cucchiaino di zucchero nel caffè caldo, impossibile scioglierlo completamente se il caffè si raffredda. La solubilità dei gas nei liquidi invece diminuisce con l’aumento della temperatura.
Le proprietà di una soluzione variano in modo continuo al variare del rapporto quantitativo tra soluto e solvente ma dipendono per la maggior parte dalla natura del solvente e del soluto: l’acqua zuccherata è dolce e incolore, sarà più o meno dolce a seconda della quantità di zucchero ma avrà comunque questa proprietà. Analogamente una soluzione di acqua e sale sarà sempre salata.
Alcune proprietà delle soluzioni dipendono invece solo dal numero di particelle di soluto presenti in soluzione e non dalla natura chimica del soluto né del solvente. Queste proprietà, che verranno approfondite in seguito, sono dette proprietà colligative. Fra la proprietà colligative rientrano ad esempio l’abbassamento del punto di congelamento: una soluzione di acqua e sale e una di acqua e zucchero congelano alla stessa temperatura se contengono lo stesso numero di particelle per unità di volume.

Le soluzioni sono quindi dei sistemi monofasici e si distinguono in:
Soluzioni gassose
[modifica | modifica sorgente]Costituite da due o più gas o vapori diffusi uno nell'altro. I gas sono sempre perfettamente miscibili, quindi un sistema formato da più gas è sempre una soluzione. L’esempio più comune di soluzione gassosa è l’aria, formata da azoto (N2), ossigeno (O2) e altri gas in percentuale minore.
Soluzioni liquide
[modifica | modifica sorgente]
Costituite da un gas, un liquido o un solido disciolte in un liquido. Tutta l’acqua potabile, ma anche l’acqua marina, contengono disciolte molte sostanze solide ma anche una certa quantità di gas presenti nell’aria, ossigeno e diossido di carbonio. Le bevande alcoliche sono soluzioni di due liquidi perfettamente miscibili, l’acqua e l’alcol etilico. L'acqua zuccherata e l'acqua di mare sono soluzioni solido-liquido. Di particolare interesse sono le soluzioni acquose, cioè quelle in cui il solvente è l'acqua. La maggior parte delle reazioni avviene in soluzione acquosa, in particolare quelle che sono alla base dei processi biologici che avvengono nelle cellule viventi.
Soluzioni solide
[modifica | modifica sorgente]Costituite da un solido disciolto in un altro. Si formano a partire da miscele fuse dei componenti che, una volta raffreddate, danno origine ad sistema omogeneo. Un esempio di questo tipo di soluzioni sono le leghe metalliche come l’ottone, formato da rame e zinco (elementi).
Tecniche di separazione
[modifica | modifica sorgente]L’uomo, fin dall'antichità, ha utilizzato i materiali presenti in natura per i propri scopi. Tuttavia spesso ha dovuto estrarre le sostanze che gli servivano dai miscugli in cui erano presenti. Ha imparato presto a estrarre il sale dall'acqua di mare, l’olio dalle olive, i metalli dai minerali in cui erano contenuti. Queste tecniche si basano su processi chimico-fisici anche molto complessi, all'epoca completamente sconosciuti.
Al giorno d’oggi tecniche di separazione vengono applicate molto di frequente sia in laboratorio che in ambito industriale per isolare le sostanze contenute in una miscela e poterle poi utilizzare, in base alle caratteristiche specifiche, come materiali.
Le tecniche di separazione permettono la separazione dei singoli componenti del miscuglio in base alle loro specifiche caratteristiche chimico-fisiche.
In base al tipo di miscuglio da separare bisogna scegliere una tecnica di separazione mirata. In generale i miscugli eterogenei sono più semplici da separare rispetto alle soluzioni.
Di seguito vengono descritti brevemente le principali tecniche di separazione e il principio fisico su cui si basano.
Filtrazione
[modifica | modifica sorgente]

È un metodo di separazione che consente di separare una fase solida (precipitato) da una fase liquida (filtrato) in un sistema eterogeneo. Viene utilizzato un filtro adeguato costituito da un materiale poroso permeabile soltanto al liquido. Per filtrazione si possono separare anche particelle solide disperse in un gas (è quello che avviene ad esempio attraverso il filtro delle sigarette).
Nella vita di tutti i giorni i filtri possono essere costituiti da materiali vari. In laboratorio si usa la carta da filtro, che si può scegliere fra diversi tipi in base alle dimensioni dei fori (che non si vedono a occhio nudo).
In laboratorio si utilizzano due metodi di filtrazione: per gravità e per aspirazione.
Nella filtrazione per gravità la carta da filtro opportunamente piegata viene posta all'interno di un imbuto di vetro appoggiato ad un supporto metallico. Il miscuglio viene versato nell’imbuto, le particelle solide vengono trattenute dal filtro e il filtrato viene raccolto in un recipiente posto sotto l’imbuto. In questo caso il solido raccolto risulta “bagnato”, contiene infatti ancora una parte di solvente. Il filtrato, se le dimensioni del filtro sono adeguate, si presenta privo di impurezze insolubili. [fig. 3.xx]
Per aumentare la velocità di filtrazione si può effettuare la filtrazione per aspirazione: si utilizza in questo caso un apposito imbuto di porcellana e una beuta da vuoto all’interno della quale si crea il vuoto con una pompa meccanica. In questo modo la componente liquida del miscuglio viene rapidamente aspirato all’interno della beuta e il precipitato raccolto nel filtro all’interno dell’imbuto risulta asciutto e cristallino.
Decantazione
[modifica | modifica sorgente]
È una delle tecniche più semplici, applicabile ai miscugli eterogenei solido-liquido, liquido-liquido e gas solido. Sfrutta la diversa densità delle componenti del sistema e consiste semplicemente nel lasciare depositare sul fondo la componente più pesante del miscuglio fino alla separazione completa.
Centrifugazione
[modifica | modifica sorgente]
In questo caso si sfrutta la forza centrifuga (come quella che viene applicata ai vestiti nel cestello della lavatrice) all’interno di un apparecchio, detto appunto centrifuga da laboratorio, per separare velocemente miscugli eterogenei solido-liquido, in particolare quando le particelle solide sono particolarmente piccole e tendono a rimanere in sospensione [fig. 3.xx]. La sospensione viene posta all’interno di provette e inserite nell’apparecchio e qui sottoposte a una rotazione di 4000-5000 giri al minuto. La centrifuga fornisce accelerazioni superiori a quella di gravità, consentendo una stratificazione più rapida: in questo modo il precipitato viene spinto e compattato verso il fondo della provetta, la fase liquida rimane in superficie come surnatante.
Estrazione con solvente
[modifica | modifica sorgente]
In questo caso si sfrutta la diversa solubilità dello stesso soluto in due diversi solventi. Si usa solitamente per estrarre da soluzioni acquose sostanze poco solubili in acqua ma maggiormente solubili in altri solventi; questi ultimi a loro volta non devono essere miscibili con l’acqua (per esempio l’etere di petrolio o il tetracloruro di carbonio). Si utilizza un particolare imbuto separatore [fig. 3.xx] in cui la soluzione acquosa, che è più densa e si dispone nella parte inferiore, viene messa a contatto con l’altro solvente: si verifica così il passaggio del soluto da una fase liquida all’altra. Attraverso il rubinetto posto alla base dell’imbuto si raccoglie prima tutta la fase acquosa, poi si cambia recipiente e si procede a raccogliere la soluzione con la sostanza estratta. Se si vuole separare il soluto dalla seconda soluzione si deve procedere con un'altra tecnica, la distillazione.
Distillazione
[modifica | modifica sorgente]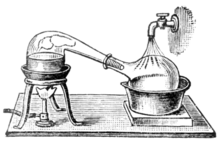
La distillazione consente di separare i componenti di una soluzione sfruttando la loro diversa volatilità (cioè la tendenza di una sostanza ad evaporare: più è basso il punto di ebollizione di una sostanza, più alta sarà la sua volatilità). E’ una tecnica molto utilizzata sia in laboratorio che a livello industriale, per separare due liquidi miscibili. La separazione avviene facendo evaporare le sostanze in base alla specifica temperatura di ebollizione (si riscalda la miscela fino ad arrivare al punto di ebollizione della prima sostanza), per poi condensarle all’interno di un tubo refrigerante e raccoglierle come distillato. Per distillazione si possono separare ad esempio i miscugli di acqua ed alcol etilico: i liquori come la grappa, il brandy e il whisky vengono detti distillati proprio perché sono ottenuti mediante un processo di distillazione.
Per distillazione è possibile anche separare il solvente dai soluti oppure i componenti di una miscela gassosa dopo averla liquefatta: si può separare in questo modo ad esempio l’azoto dall’ossigeno previa liquefazione dell’aria.
Esistono diverse tecniche di distillazione che vengono utilizzate in base alle caratteristiche delle sostanze da separare. Le principali sono la distillazione semplice, per separare liquidi con punti di ebollizione al di sotto dei 150°C da soluti non volatili, oppure un liquido da un altro nel caso in cui le temperature di ebollizione differiscano di almeno 25°C. Nel caso di componenti liquidi con una differenza nelle temperature di ebollizione di meno di 25 °C si usa la distillazione frazionata.![]() La distillazione frazionata
La distillazione frazionata ![]()
Cromatografia
[modifica | modifica sorgente]
È una particolare tecnica di separazione che deve il suo nome (dal greco khrôma, “colore”) al fatto che per la prima volta è stata utilizzata da un chimico russo per separare i pigmenti colorati estratti dalle foglie. Nata come tecnica di separazione, è diventata anche tecnica analitica (in grado cioè di identificare la presenza di sostanze incognite) perché ben si presta a separare, rivelandoli quindi, i componenti di miscugli anche molto complessi. La tecnica si basa su un opportuno solvente, chiamato eluente o fase mobile, che trascina i componenti del miscuglio attraverso una fase fissa, rappresentata dal supporto. La diversa velocità con cui i componenti del miscuglio migrano lungo la fase fissa trascinati dell'eluente consente di separarli. In base al tipo di supporto utilizzato possiamo avere la cromatografia su colonna, in cui la fase fissa è rappresentata da una colonna di vetro, con un rubinetto alla base, riempita di materiale poroso (silice, cellulosa, allumina o carbone attivo): la fase mobile con il miscuglio vengono inseriti in alto nella colonna; l’eluente trascina i vari componenti attraverso la fase fissa con velocità diverse così avviene la separazione; ogni componente del miscuglio, grazie al rubinetto posto in basso, viene raccolto separatamente [fig. 3.xx]. Nella cromatografia su carta la fase stazionaria è una striscia di carta da filtro su cui vengono deposte ad un centimetro dall’estremità inferiore (si dice “caricate”) mediante un capillare di vetro, alcune gocce del miscuglio da separare. Dopo che le gocce si sono asciugate per evaporazione del solvente, la striscia viene appesa all’interno di un apposito contenitore con un coperchio a tenuta con il campione verso il basso. La fase mobile è posta sul fondo del contenitore in modo che la carta vi peschi con il bordo inferiore: salendo per capillarità, l’eluente trascinerà i componenti del miscuglio lungo la striscia di carta separandoli. Simile alla precedente è la cromatografia su strato sottile o TLC (Thin Layer Chromatography) ma al posto della carta come fase fissa si usano lastre di vetro ricoperte da una sostanza porosa, silice o allumina [inserire immagine].
Altri tipi di miscugli e relativi metodi di separazione
[modifica | modifica sorgente]Vengono qui di seguito elencati alcuni esempi di miscugli eterogenei con il loro metodo di separazione delle fasi:
- solido/solido: ghiaia e sabbia, separabili con un setaccio, oppure limatura di ferro e zolfo, separabili con l’utilizzo di una calamita;
- solido/liquido: sabbia e acqua, separabili per filtrazione, oppure argilla e acqua (sospensione), separabili per decantazione;
- solido/aeriforme: fumo, i cui componenti solidi sono separabili con la carta da filtro;
- liquido/liquido: acqua e olio, separabili con imbuto separatore in quanto stratificati, oppure latte o sangue, i cui componenti sono separabili per centrifugazione in quanto hanno diversa densità ma non sono stratificati;
- liquido/aeriforme: acqua e bibite gassate e miscugli acqua-aria, chiamati nebbia se prevale l’aria e schiuma se prevale l’acqua.
Attività e materiale utile allo studio
[modifica | modifica sorgente]- Esercizi suddivisi per conoscenze e competenze
- Esercizi suddivisi per argomenti
- Presentazione (in pdf)
- Versione più sintetica
- Mappa concettuale e sintesi
- Laboratorio: la densità
- Laboratorio: separazione di un miscuglio eterogeneo ed omogeneo (su farelaboratorio.accademiadellescienze.it)
- CLIL
- Altro materiale per il docente











