Chimica per il liceo/La tavola periodica e i primi modelli atomici: differenze tra le versioni
mNessun oggetto della modifica |
Nessun oggetto della modifica |
||
| Riga 7: | Riga 7: | ||
Quando Mendeleev propose la sua Tavola periodica erano note le masse atomiche, le caratteristiche e la reattività di 63 elementi (attualmente ne conosciamo 118): egli ordinò orizzontalmente gli elementi conosciuti in base alla loro massa atomica crescente, andando a capo quando giungeva a elementi con caratteristiche simili. Nel sistema periodico elaborato da Mendeleev, ad esempio, la prima "riga" (più correttamente si parla di ''periodo'') comprende un solo elemento: l'idrogeno (H); la seconda "riga" inizia con il litio (Li) e si chiude con il fluoro (F), in quanto il sodio (Na), che ha caratteristiche simili al litio, apre la "riga" successiva. È bene ricordare che i gas nobili, che nelle moderne Tavole periodiche chiudono ogni periodo, verranno scoperti solo alla fine del XIX secolo. |
Quando Mendeleev propose la sua Tavola periodica erano note le masse atomiche, le caratteristiche e la reattività di 63 elementi (attualmente ne conosciamo 118): egli ordinò orizzontalmente gli elementi conosciuti in base alla loro massa atomica crescente, andando a capo quando giungeva a elementi con caratteristiche simili. Nel sistema periodico elaborato da Mendeleev, ad esempio, la prima "riga" (più correttamente si parla di ''periodo'') comprende un solo elemento: l'idrogeno (H); la seconda "riga" inizia con il litio (Li) e si chiude con il fluoro (F), in quanto il sodio (Na), che ha caratteristiche simili al litio, apre la "riga" successiva. È bene ricordare che i gas nobili, che nelle moderne Tavole periodiche chiudono ogni periodo, verranno scoperti solo alla fine del XIX secolo. |
||
In questo sistema gli elementi chimici non erano solo ordinati in base alla propria massa atomica, ma anche |
In questo sistema gli elementi chimici non erano solo ordinati in base alla propria massa atomica, ma anche incolonnati in ''gruppi'' con caratteristiche chimiche simili, come mostrato in figura 2. |
||
[[File:Periodic table by Mendeleev, 1871.svg|miniatura|623x623px|'''Figura 2.''' Tavola periodica Mendeleev (versione del 1871).]] |
[[File:Periodic table by Mendeleev, 1871.svg|miniatura|623x623px|'''Figura 2.''' Tavola periodica Mendeleev (versione del 1871).]] |
||
Come si è detto precedentemente, il sistema periodico elaborato da Mendeleev permise anche di <u>ipotizzare l'esistenza di elementi non ancora scoperti</u> e di prevederne le principali caratteristiche e proprietà. Ad esempio, Mendeleev osservò che sebbene in base alla sua massa atomica il titanio (Ti) avrebbe dovuto seguire il calcio (Ca), le sue caratteristiche differivano significativamente da quelle del boro (B) e dell'alluminio (Al), pertanto lasciò una casella vuota ipotizzando l'esistenza di un elemento ancora sconosciuto, che denominò eka-alluminio. In modo analogo, Mendeleev predisse l'esistenza anche di altri due elementi sconosciuti che denominò provvisoriamente eka-boro e eka-silicio. Non passarono molti anni, prima che l'effettiva esistenza di tali elementi |
Come si è detto precedentemente, il sistema periodico elaborato da Mendeleev permise anche di <u>ipotizzare l'esistenza di elementi non ancora scoperti</u> e di prevederne le principali caratteristiche e proprietà. Ad esempio, Mendeleev osservò che sebbene in base alla sua massa atomica il titanio (Ti) avrebbe dovuto seguire il calcio (Ca), le sue caratteristiche differivano significativamente da quelle del boro (B) e dell'alluminio (Al), pertanto lasciò una casella vuota ipotizzando l'esistenza di un elemento ancora sconosciuto, che denominò eka-alluminio. In modo analogo, Mendeleev predisse l'esistenza anche di altri due elementi sconosciuti che denominò provvisoriamente eka-boro e eka-silicio. Non passarono molti anni, prima che l'effettiva esistenza di tali elementi vennisse confermata: oggi questi elementi sono rispettivamente noti come gallio (Ga, scoperto nel 1875), scandio (Sc, scoperto nel 1879) e germanio (Ge, scoperto nel 1886). |
||
È giusto ricordare che nello stesso periodo anche il chimico tedesco Julius Lothar '''[[w:Julius_Lothar_Meyer|Meyer]]''' giunse a conclusioni molto simili a quelle di Mendeleev, ma pubblicò la sua versione della Tavola periodica (praticamente identica a quella elaborata dal chimico russo) solo alcuni mesi dopo. Sebbene oggi la Tavola periodica sia esclusivamente associata al nome di Mendeleev, il lavoro di Meyer fornì un avallo significativo e ne facilitò l'accettazione da parte della comunità scientifica internazionale. In riconoscimento di ciò, nel 1882, la prestigiosa associazione scientifica britannica Royal Society attribuì la medaglia Davy, un importante premio rilasciato annualmente agli scienziati che si sono distinti nel settore della chimica, sia a Mendeleev che a Meyer. |
È giusto ricordare che nello stesso periodo anche il chimico tedesco Julius Lothar '''[[w:Julius_Lothar_Meyer|Meyer]]''' giunse a conclusioni molto simili a quelle di Mendeleev, ma pubblicò la sua versione della Tavola periodica (praticamente identica a quella elaborata dal chimico russo) solo alcuni mesi dopo. Sebbene oggi la Tavola periodica sia esclusivamente associata al nome di Mendeleev, il lavoro di Meyer fornì un avallo significativo e ne facilitò l'accettazione da parte della comunità scientifica internazionale. In riconoscimento di ciò, nel 1882, la prestigiosa associazione scientifica britannica Royal Society attribuì la medaglia Davy, un importante premio rilasciato annualmente agli scienziati che si sono distinti nel settore della chimica, sia a Mendeleev che a Meyer. |
||
La Tavola periodica elaborata da Mendeleev non riusciva tuttavia a spiegare alcune irregolarità nelle masse atomiche |
La Tavola periodica elaborata da Mendeleev non riusciva tuttavia a spiegare alcune irregolarità nelle masse atomiche che lo costrinsero, in alcuni casi, a scambiare la posizione di elementi adiacenti per posizionarli correttamente nella colonna di altri elementi con analoghe proprietà chimiche, come ad esempio nel caso dello iodio (I) e del tellurio (Te) o del nichel (Ni) e del cobalto (Co). Sarà solo con la scoperta del nucleo atomico, avvenuta nella prima metà del XX secolo, che si comprese che il corretto ordinamento degli elementi chimici dovesse basarsi non tanto sulle loro masse atomiche, quanto piuttosto sui loro numeri atomici (ossia sul numero di protoni presenti nel nucleo), in particolare grazie ai contributi sperimentali del fisico inglese Henry G. J. '''[[w:Henry_Moseley|Moseley]]'''. |
||
== La natura elettrica della materia == |
== La natura elettrica della materia == |
||
| Riga 19: | Riga 19: | ||
Tra il VII e il VI secolo a.C., il filosofo greco '''[[w:Talete|Talete]]''' aveva scoperto che strofinando l'ambra (figura 3) su un panno di lana, questa resina fossile acquisiva la capacità di attirare a sé oggetti leggeri, come frammenti di paglia o capelli. Un effetto analogo ma contrario si può osservare strofinando su un panno di lana una bacchetta di vetro. Quando nel XVI secolo il fisico inglese William '''[[w:William_Gilbert|Gilbert]]''' si dedicò allo studio e alla catalogazione di materiali in grado di comportarsi come l'ambra e il vetro, per indicare le proprietà manifestate da tali materiali coniò il nuovo aggettivo ''elettrico'', proprio ispirandosi al termine greco per indicare l'''ambra'', ovvero ''elektron'' (ἤλεκτρον). |
Tra il VII e il VI secolo a.C., il filosofo greco '''[[w:Talete|Talete]]''' aveva scoperto che strofinando l'ambra (figura 3) su un panno di lana, questa resina fossile acquisiva la capacità di attirare a sé oggetti leggeri, come frammenti di paglia o capelli. Un effetto analogo ma contrario si può osservare strofinando su un panno di lana una bacchetta di vetro. Quando nel XVI secolo il fisico inglese William '''[[w:William_Gilbert|Gilbert]]''' si dedicò allo studio e alla catalogazione di materiali in grado di comportarsi come l'ambra e il vetro, per indicare le proprietà manifestate da tali materiali coniò il nuovo aggettivo ''elettrico'', proprio ispirandosi al termine greco per indicare l'''ambra'', ovvero ''elektron'' (ἤλεκτρον). |
||
Mediante lo strofinio è possibile caricare elettricamente un corpo, sfruttando l'energia cinetica per strappare cariche ai materiali in oggetto; per convenzione, i materiali che |
Mediante lo strofinio è possibile caricare elettricamente un corpo, sfruttando l'energia cinetica per strappare cariche ai materiali in oggetto; per convenzione, i materiali che in seguito a strofinio presentano un comportamento analogo a quello dell'ambra, come ad esempio la plastica, sono definiti '''negativi''', mentre quelli che si comportano come il vetro sono definiti '''positivi'''. Due oggetti che presentano cariche elettriche opposte si attraggono, mentre due oggetti che hanno la stessa carica si respingono, come mostrato in figura 4. |
||
[[File:Interazioni tra cariche elettriche.svg|miniatura| |
[[File:Interazioni tra cariche elettriche.svg|miniatura|620x620px|'''Figura 4.''' Interazione tra cariche elettriche: (A) se le cariche sono di segno opposto si attraggono; (B) se sono dello stesso segno si respingono.|sinistra]]{{Clear}} |
||
== La scoperta dell'elettrone e il modello atomico di Thomson == |
== La scoperta dell'elettrone e il modello atomico di Thomson == |
||
Nel corso del XVIII e del XIX secolo, numerosi scienziati si dedicarono allo studio delle proprietà elettriche della materia e alle applicazioni tecnologiche dell'elettricità, come il fisico italiano Alessandro '''[[w:Alessandro_Volta|Volta]]''', inventore della prima pila elettrica della storia |
Nel corso del XVIII e del XIX secolo, numerosi scienziati si dedicarono allo studio delle proprietà elettriche della materia e alle applicazioni tecnologiche dell'elettricità, come il fisico italiano Alessandro '''[[w:Alessandro_Volta|Volta]]''', inventore della prima pila elettrica della storia, il fisico americano Benjamin '''[[w:Benjamin_Franklin|Franklin]]''' che, per spiegare i fenomeni elettrici, ipotizzò l’esistenza di un ''fluido elettrico'' costituito da particelle dotate di cariche opposte e il chimico svedese Jöns Jacob '''[[w:Jöns_Jacob_Berzelius|Berzelius]]''' che tentò di accordare le osservazioni fisiche sull'elettricità con la teoria atomica della materia, proponendo che ogni atomo possedesse al suo interno entrambi i tipi di carica (positiva e negativa) e che l'elettrizzazione della materia avvenisse in seguito ad uno scambio di queste cariche. Bisognerà però attendere la fine del XIX secolo per identificare le prime particelle subatomiche dotate di carica elettrica: gli ''elettroni''. |
||
[[File:JJ Thomson (Nobel).jpg|sinistra|miniatura|'''Figura 5.''' Sir Joseph John Thomson (1856–1940), premio Nobel per la Fisica nel 1906.|232x232px]] |
[[File:JJ Thomson (Nobel).jpg|sinistra|miniatura|'''Figura 5.''' Sir Joseph John Thomson (1856–1940), premio Nobel per la Fisica nel 1906.|232x232px]] |
||
[[File:Crookes tube-in use-lateral view-standing cross prPNr°11.jpg|miniatura|244x244px|'''Figura 6.''' Tubo di Crookes.]] |
[[File:Crookes tube-in use-lateral view-standing cross prPNr°11.jpg|miniatura|244x244px|'''Figura 6.''' Tubo di Crookes.]] |
||
Nel 1897, il fisico inglese Joseph J. '''[[w:Joseph_John_Thomson|Thomson]]''' (figura 5), dimostrò l'esistenza dell''''elettrone''', compiendo esperimenti con il '''tubo di Crookes''' (figura 6), un ampolla di vetro contenente un gas rarefatto (grazie al collegamento a una pompa a vuoto) in cui sono fissate due piastre metalliche (o <dfn>elettrodi</dfn>) |
Nel 1897, il fisico inglese Joseph J. '''[[w:Joseph_John_Thomson|Thomson]]''' (figura 5), dimostrò l'esistenza dell''''elettrone''', compiendo esperimenti con il '''tubo di Crookes''' (figura 6), un ampolla di vetro contenente un gas rarefatto (grazie al collegamento a una pompa a vuoto) in cui sono fissate due piastre metalliche (o <dfn>elettrodi</dfn>): una, detta ''catodo'', è collegata al polo negativo di un generatore elettrico e l’altra, detta ''anodo'', è collegata al polo positivo. |
||
Portando la pressione del gas all'interno del tubo a valori molto bassi (circa un milione di volte minore di quella atmosferica) e applicando un'elevata differenza di potenziale elettrico, è possibile osservare l'emissione di raggi luminosi che partono dal catodo (per questo motivo sono stati chiamati ''raggi catodici'') e si propagano in linea retta, attraversando l'anodo, che è forato, fino a raggiungere l'estremità opposta del tubo, dove determinano una tenue fluorescenza sul vetro. I raggi catodici inoltre possono essere deviati utilizzando due ulteriori piastre metalliche che generano un campo elettrico ad essi perpendicolare: come mostrato in figura 7, i raggi catodici vengono attirati dalla piastra positiva e respinti da quella negativa, dimostrando la loro natura elettrica negativa. |
Portando la pressione del gas all'interno del tubo a valori molto bassi (circa un milione di volte minore di quella atmosferica) e applicando un'elevata differenza di potenziale elettrico, è possibile osservare l'emissione di raggi luminosi che partono dal catodo (per questo motivo sono stati chiamati ''raggi catodici'') e si propagano in linea retta, attraversando l'anodo, che è forato, fino a raggiungere l'estremità opposta del tubo, dove determinano una tenue fluorescenza sul vetro. I raggi catodici inoltre possono essere deviati utilizzando due ulteriori piastre metalliche che generano un campo elettrico ad essi perpendicolare: come mostrato in figura 7, i raggi catodici vengono attirati dalla piastra positiva e respinti da quella negativa, dimostrando la loro natura elettrica negativa. |
||
[[File:Plum pudding atom.svg|miniatura| |
[[File:Plum pudding atom.svg|miniatura|140x140px|'''Figura 9.''' Il modello atomico "a panettone" proposto da Thomson.]][[File:Thomson cathode ray exp.gif|centro|miniatura|422x422px|'''Figura 7.''' Deviazione dei raggi catodici, quando si applica un campo elettrico perpendicolare al fascio.]]Attraverso vari esperimenti che utilizzavano sia campi elettrici, sia campi magnetici, Thomson fu in grado di dimostrare che i raggi catodici erano formati da particelle dotate di massa e inoltre di determinarne il rapporto carica/massa: i risultati ottenuti gli fecero inoltre ipotizzare che tali particelle negative dovessero avere una massa molto più piccola di quella dell'atomo più leggero, ovvero l'idrogeno, e che fossero una componente fondamentale di tutti gli atomi. Le particelle individuate da Thomson vennero chiamate '''elettroni''' e la loro scoperta gli valse il premio Nobel per la Fisica nel 1906. |
||
Il valore preciso della carica elettrica (-1,6<math>\cdot</math>10<sup>-19</sup> C) e |
Il valore preciso della carica elettrica (-1,6<math>\cdot</math>10<sup>-19</sup> C) e della massa (9,109<math>\cdot</math>10<sup>-31</sup> kg) dell'elettrone vennero poi determinati dal fisico statunitense Robert '''[[w:Robert_Millikan|Millikan]]''', nel 1909, confermando che tale particella ha una massa circa 2000 inferiore rispetto a quella dell'atomo di idrogeno. |
||
[[File:Jersey Christmas pudding podîn d'flieu.jpg|miniatura|186x186px|'''Figura 8.''' Plum (o Christmas) pudding.|sinistra]] |
[[File:Jersey Christmas pudding podîn d'flieu.jpg|miniatura|186x186px|'''Figura 8.''' Plum (o Christmas) pudding.|sinistra]] |
||
Dopo aver scoperto l'elettrone, nel 1904, Thomson propose il primo modello atomico moderno e basato su dati sperimentali, noto come "'''modello a panettone'''", o in inglese ''plum pudding model'' (il plum o Christmas pudding è un tipico dolce inglese natalizio che, come il nostro panettone tradizionale, contiene canditi e uva passa, figura 8). Tale modello ipotizza che l'atomo sia una sfera di carica positiva, a cui è associata anche la massa (essendo la massa dell'elettrone molto inferiore rispetto a quella di un atomo), diffusa in tutto il volume, al cui interno sono distribuiti gli elettroni (cariche negative) a distanza regolare, in modo da minimizzare la repulsione reciproca (figura 9). Tale modello viene definito "a panettone" in quanto l'impasto rappresenta la |
Dopo aver scoperto l'elettrone, nel 1904, Thomson propose il primo modello atomico moderno e basato su dati sperimentali, noto come "'''modello a panettone'''", o in inglese ''plum pudding model'' (il plum o Christmas pudding è un tipico dolce inglese natalizio che, come il nostro panettone tradizionale, contiene canditi e uva passa, figura 8). Tale modello ipotizza che l'atomo sia una sfera di carica positiva, a cui è associata anche la massa (essendo la massa dell'elettrone molto inferiore rispetto a quella di un atomo), diffusa in tutto il volume, al cui interno sono distribuiti gli elettroni (cariche negative) a distanza regolare, in modo da minimizzare la repulsione reciproca (figura 9). Tale modello viene definito "a panettone" in quanto l'impasto rappresenta la carica positiva diffusa in tutto il volume, mentre le uvette e i canditi distribuiti al suo interno rappresentano gli elettroni negativi.{{Clear}} |
||
== L'esperimento di Rutherford e il modello atomico planetario == |
== L'esperimento di Rutherford e il modello atomico planetario == |
||
| Riga 51: | Riga 38: | ||
A partire dal 1908, vennero condotti una serie di esperimenti, ideati e diretti dal chimico e fisico neozelandese Ernest '''[[w:Ernest_Rutherford|Rutherford]]''' (figura 10), in collaborazione con i fisici Hans '''[[w:Hans_Wilhelm_Geiger|Geiger]]''' ed Ernest '''[[w:Ernest_Marsden|Marsden]]''', volti a indagare la struttura dell'atomo, che permisero di scoprire l'esistenza del '''nucleo''' dove sono concentrate tutta carica positiva e la maggior parte della massa atomica. |
A partire dal 1908, vennero condotti una serie di esperimenti, ideati e diretti dal chimico e fisico neozelandese Ernest '''[[w:Ernest_Rutherford|Rutherford]]''' (figura 10), in collaborazione con i fisici Hans '''[[w:Hans_Wilhelm_Geiger|Geiger]]''' ed Ernest '''[[w:Ernest_Marsden|Marsden]]''', volti a indagare la struttura dell'atomo, che permisero di scoprire l'esistenza del '''nucleo''' dove sono concentrate tutta carica positiva e la maggior parte della massa atomica. |
||
In tali esperimenti, Rutherford bombardò una sottile lamina d'oro, |
In tali esperimenti, Rutherford bombardò una sottile lamina d'oro, dello spessore di circa 0,004 mm, con delle ''particelle α'' (alfa) emesse ad alta velocità da una fonte radioattiva; tali particelle sono dotate di massa (circa pari a quella di un atomo di elio e oltre 7000 volte maggiore di quella di un elettrone) e di carica elettrica positiva, doppia rispetto a quella dell'elettrone, ma di segno opposto. Per rilevare la presenza delle particelle α, che sono invisibili all'occhio umano, e studiarne pertanto il tragitto quando interagivano con la lamina d'oro, utilizzò un particolare schermo fluorescente, come mostrato in figura 11. [[File:Rutherford gold foil experiment results.svg|miniatura|'''Figura 12.''' Interazione tra particelle α e atomi d'oro secondo il modello atomico di Thomson (in alto) e quello di Rutherford (in basso).|294x294px]][[File:Scatteringrutherford.jpg|centro|miniatura|370x370px|'''Figura 11.''' Schema dell’apparato sperimentale utilizzato da Rutherford e dai suoi collaboratori per indagare la struttura dell’atomo.]]Gli scienziati osservarono che: |
||
* la maggior parte delle particelle α attraversava la sottile lamina d'oro in linea retta, senza cioè subire alcuna deviazione; |
* la maggior parte delle particelle α attraversava la sottile lamina d'oro in linea retta, senza cioè subire alcuna deviazione; |
||
| Riga 58: | Riga 45: | ||
In base alle osservazioni e ai calcoli effettuati, Rutherford comprese che il modello proposto da Thomson non potesse essere valido (figura 12), in quanto le particelle alfa avrebbero dovuto attraversare tutte in linea retta la lamina d'oro senza subire alcuna deviazione o venendo solo leggermente deviate, per l'interazione con il debole campo elettrico generato dagli atomi (si ricordi che nel modello di Thomson la carica e la massa sono diffuse in tutto il volume dell'atomo, che di conseguenza ha una densità sia di massa sia di carica molto bassa). Ipotizzò quindi un modello "planetario" in cui la carica positiva era concentrata in un piccolo spazio centrale, il nucleo, e le cariche negative si muovevano in qualche modo (non precisò come) ad una certa distanza dal nucleo. {{Clear}} |
In base alle osservazioni e ai calcoli effettuati, Rutherford comprese che il modello proposto da Thomson non potesse essere valido (figura 12), in quanto le particelle alfa avrebbero dovuto attraversare tutte in linea retta la lamina d'oro senza subire alcuna deviazione o venendo solo leggermente deviate, per l'interazione con il debole campo elettrico generato dagli atomi (si ricordi che nel modello di Thomson la carica e la massa sono diffuse in tutto il volume dell'atomo, che di conseguenza ha una densità sia di massa sia di carica molto bassa). Ipotizzò quindi un modello "planetario" in cui la carica positiva era concentrata in un piccolo spazio centrale, il nucleo, e le cariche negative si muovevano in qualche modo (non precisò come) ad una certa distanza dal nucleo. {{Clear}} |
||
== Numero atomico, numero di massa e isotopi == |
== Numero atomico, numero di massa e isotopi == |
||
[[File:Atomo di carbonio.svg|miniatura|345x345px|Struttura semplificata dell'atomo di carbonio]]L’atomo è l’unità fondamentale della materia e tutti gli atomi sono formati dalle stesse categorie di subparticelle: il nucleo è costituito da '''protoni,''' particelle dotate di <u>massa e carica positiva,</u> e '''neutroni,''' particelle <u>neutre</u> dotate di una <u>massa</u> paragonabile a quella dei protoni); attorno al nucleo si muovono gli '''elettroni,''' particelle con carica negativa pari in quantità |
[[File:Atomo di carbonio.svg|miniatura|345x345px|Struttura semplificata dell'atomo di carbonio]]L’atomo è l’unità fondamentale della materia e tutti gli atomi sono formati dalle stesse categorie di subparticelle: il nucleo è costituito da '''protoni,''' particelle dotate di <u>massa e carica positiva,</u> e '''neutroni,''' particelle <u>neutre</u> (prive di carica) dotate di una <u>massa</u> paragonabile a quella dei protoni); attorno al nucleo si muovono gli '''elettroni,''' particelle con carica negativa pari in quantità a quella del protone ma di segno opposto e massa trascurabile rispetto a quella di un protone o di un neutrone (circa 1/2000). Il numero di elettroni eguaglia il numero di protoni: l’atomo, infatti, è, per definizione, una entità neutra. Il '''numero di protoni''' (e, quindi, di elettroni) viene indicato come '''numero atomico'''. |
||
Le varie specie atomiche differiscono, in primo luogo, per il numero atomico e sono ordinate sulla tavola periodica secondo il numero atomico crescente. |
Le varie specie atomiche differiscono, in primo luogo, per il numero atomico e sono ordinate sulla tavola periodica secondo il numero atomico crescente. |
||
Versione delle 09:31, 14 dic 2021
La Tavola periodica e i primi modelli atomici
La Tavola periodica di Mendeleev

Nel corso del XIX secolo numerosi chimici si sono interessati alla ricerca di un sistema ordinato e razionale per classificare gli elementi chimici. Grazie a tutte le conoscenze acquisite sulle proprietà e le caratteristiche chimiche e fisiche degli elementi e al fondamentale contributo del chimico italiano Stanislao Cannizzaro nella determinazione delle masse atomiche (all'epoca chiamate pesi atomici), nel 1869 il chimico russo Dmitrij Ivanovič Mendeleev (nato nel cuore della Siberia nel 1834 e morto a San Pietroburgo nel 1907; figura 1) propose un sistema periodico che non solo classificava razionalmente gli elementi fino ad allora conosciuti, mettendo in evidenza il ripetersi a intervalli regolari di determinate proprietà chimiche, ma al contempo permetteva di prevedere le caratteristiche di elementi non ancora scoperti.
Quando Mendeleev propose la sua Tavola periodica erano note le masse atomiche, le caratteristiche e la reattività di 63 elementi (attualmente ne conosciamo 118): egli ordinò orizzontalmente gli elementi conosciuti in base alla loro massa atomica crescente, andando a capo quando giungeva a elementi con caratteristiche simili. Nel sistema periodico elaborato da Mendeleev, ad esempio, la prima "riga" (più correttamente si parla di periodo) comprende un solo elemento: l'idrogeno (H); la seconda "riga" inizia con il litio (Li) e si chiude con il fluoro (F), in quanto il sodio (Na), che ha caratteristiche simili al litio, apre la "riga" successiva. È bene ricordare che i gas nobili, che nelle moderne Tavole periodiche chiudono ogni periodo, verranno scoperti solo alla fine del XIX secolo.
In questo sistema gli elementi chimici non erano solo ordinati in base alla propria massa atomica, ma anche incolonnati in gruppi con caratteristiche chimiche simili, come mostrato in figura 2.
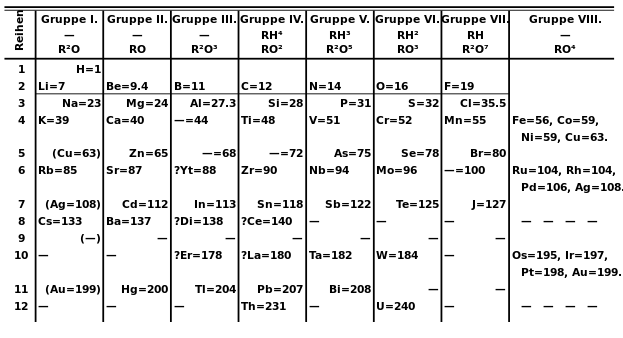
Come si è detto precedentemente, il sistema periodico elaborato da Mendeleev permise anche di ipotizzare l'esistenza di elementi non ancora scoperti e di prevederne le principali caratteristiche e proprietà. Ad esempio, Mendeleev osservò che sebbene in base alla sua massa atomica il titanio (Ti) avrebbe dovuto seguire il calcio (Ca), le sue caratteristiche differivano significativamente da quelle del boro (B) e dell'alluminio (Al), pertanto lasciò una casella vuota ipotizzando l'esistenza di un elemento ancora sconosciuto, che denominò eka-alluminio. In modo analogo, Mendeleev predisse l'esistenza anche di altri due elementi sconosciuti che denominò provvisoriamente eka-boro e eka-silicio. Non passarono molti anni, prima che l'effettiva esistenza di tali elementi vennisse confermata: oggi questi elementi sono rispettivamente noti come gallio (Ga, scoperto nel 1875), scandio (Sc, scoperto nel 1879) e germanio (Ge, scoperto nel 1886).
È giusto ricordare che nello stesso periodo anche il chimico tedesco Julius Lothar Meyer giunse a conclusioni molto simili a quelle di Mendeleev, ma pubblicò la sua versione della Tavola periodica (praticamente identica a quella elaborata dal chimico russo) solo alcuni mesi dopo. Sebbene oggi la Tavola periodica sia esclusivamente associata al nome di Mendeleev, il lavoro di Meyer fornì un avallo significativo e ne facilitò l'accettazione da parte della comunità scientifica internazionale. In riconoscimento di ciò, nel 1882, la prestigiosa associazione scientifica britannica Royal Society attribuì la medaglia Davy, un importante premio rilasciato annualmente agli scienziati che si sono distinti nel settore della chimica, sia a Mendeleev che a Meyer.
La Tavola periodica elaborata da Mendeleev non riusciva tuttavia a spiegare alcune irregolarità nelle masse atomiche che lo costrinsero, in alcuni casi, a scambiare la posizione di elementi adiacenti per posizionarli correttamente nella colonna di altri elementi con analoghe proprietà chimiche, come ad esempio nel caso dello iodio (I) e del tellurio (Te) o del nichel (Ni) e del cobalto (Co). Sarà solo con la scoperta del nucleo atomico, avvenuta nella prima metà del XX secolo, che si comprese che il corretto ordinamento degli elementi chimici dovesse basarsi non tanto sulle loro masse atomiche, quanto piuttosto sui loro numeri atomici (ossia sul numero di protoni presenti nel nucleo), in particolare grazie ai contributi sperimentali del fisico inglese Henry G. J. Moseley.
La natura elettrica della materia

Tra il VII e il VI secolo a.C., il filosofo greco Talete aveva scoperto che strofinando l'ambra (figura 3) su un panno di lana, questa resina fossile acquisiva la capacità di attirare a sé oggetti leggeri, come frammenti di paglia o capelli. Un effetto analogo ma contrario si può osservare strofinando su un panno di lana una bacchetta di vetro. Quando nel XVI secolo il fisico inglese William Gilbert si dedicò allo studio e alla catalogazione di materiali in grado di comportarsi come l'ambra e il vetro, per indicare le proprietà manifestate da tali materiali coniò il nuovo aggettivo elettrico, proprio ispirandosi al termine greco per indicare l'ambra, ovvero elektron (ἤλεκτρον).
Mediante lo strofinio è possibile caricare elettricamente un corpo, sfruttando l'energia cinetica per strappare cariche ai materiali in oggetto; per convenzione, i materiali che in seguito a strofinio presentano un comportamento analogo a quello dell'ambra, come ad esempio la plastica, sono definiti negativi, mentre quelli che si comportano come il vetro sono definiti positivi. Due oggetti che presentano cariche elettriche opposte si attraggono, mentre due oggetti che hanno la stessa carica si respingono, come mostrato in figura 4.

La scoperta dell'elettrone e il modello atomico di Thomson
Nel corso del XVIII e del XIX secolo, numerosi scienziati si dedicarono allo studio delle proprietà elettriche della materia e alle applicazioni tecnologiche dell'elettricità, come il fisico italiano Alessandro Volta, inventore della prima pila elettrica della storia, il fisico americano Benjamin Franklin che, per spiegare i fenomeni elettrici, ipotizzò l’esistenza di un fluido elettrico costituito da particelle dotate di cariche opposte e il chimico svedese Jöns Jacob Berzelius che tentò di accordare le osservazioni fisiche sull'elettricità con la teoria atomica della materia, proponendo che ogni atomo possedesse al suo interno entrambi i tipi di carica (positiva e negativa) e che l'elettrizzazione della materia avvenisse in seguito ad uno scambio di queste cariche. Bisognerà però attendere la fine del XIX secolo per identificare le prime particelle subatomiche dotate di carica elettrica: gli elettroni.


Nel 1897, il fisico inglese Joseph J. Thomson (figura 5), dimostrò l'esistenza dell'elettrone, compiendo esperimenti con il tubo di Crookes (figura 6), un ampolla di vetro contenente un gas rarefatto (grazie al collegamento a una pompa a vuoto) in cui sono fissate due piastre metalliche (o elettrodi): una, detta catodo, è collegata al polo negativo di un generatore elettrico e l’altra, detta anodo, è collegata al polo positivo.
Portando la pressione del gas all'interno del tubo a valori molto bassi (circa un milione di volte minore di quella atmosferica) e applicando un'elevata differenza di potenziale elettrico, è possibile osservare l'emissione di raggi luminosi che partono dal catodo (per questo motivo sono stati chiamati raggi catodici) e si propagano in linea retta, attraversando l'anodo, che è forato, fino a raggiungere l'estremità opposta del tubo, dove determinano una tenue fluorescenza sul vetro. I raggi catodici inoltre possono essere deviati utilizzando due ulteriori piastre metalliche che generano un campo elettrico ad essi perpendicolare: come mostrato in figura 7, i raggi catodici vengono attirati dalla piastra positiva e respinti da quella negativa, dimostrando la loro natura elettrica negativa.


Attraverso vari esperimenti che utilizzavano sia campi elettrici, sia campi magnetici, Thomson fu in grado di dimostrare che i raggi catodici erano formati da particelle dotate di massa e inoltre di determinarne il rapporto carica/massa: i risultati ottenuti gli fecero inoltre ipotizzare che tali particelle negative dovessero avere una massa molto più piccola di quella dell'atomo più leggero, ovvero l'idrogeno, e che fossero una componente fondamentale di tutti gli atomi. Le particelle individuate da Thomson vennero chiamate elettroni e la loro scoperta gli valse il premio Nobel per la Fisica nel 1906.
Il valore preciso della carica elettrica (-1,610-19 C) e della massa (9,10910-31 kg) dell'elettrone vennero poi determinati dal fisico statunitense Robert Millikan, nel 1909, confermando che tale particella ha una massa circa 2000 inferiore rispetto a quella dell'atomo di idrogeno.

Dopo aver scoperto l'elettrone, nel 1904, Thomson propose il primo modello atomico moderno e basato su dati sperimentali, noto come "modello a panettone", o in inglese plum pudding model (il plum o Christmas pudding è un tipico dolce inglese natalizio che, come il nostro panettone tradizionale, contiene canditi e uva passa, figura 8). Tale modello ipotizza che l'atomo sia una sfera di carica positiva, a cui è associata anche la massa (essendo la massa dell'elettrone molto inferiore rispetto a quella di un atomo), diffusa in tutto il volume, al cui interno sono distribuiti gli elettroni (cariche negative) a distanza regolare, in modo da minimizzare la repulsione reciproca (figura 9). Tale modello viene definito "a panettone" in quanto l'impasto rappresenta la carica positiva diffusa in tutto il volume, mentre le uvette e i canditi distribuiti al suo interno rappresentano gli elettroni negativi.
L'esperimento di Rutherford e il modello atomico planetario

A partire dal 1908, vennero condotti una serie di esperimenti, ideati e diretti dal chimico e fisico neozelandese Ernest Rutherford (figura 10), in collaborazione con i fisici Hans Geiger ed Ernest Marsden, volti a indagare la struttura dell'atomo, che permisero di scoprire l'esistenza del nucleo dove sono concentrate tutta carica positiva e la maggior parte della massa atomica.
In tali esperimenti, Rutherford bombardò una sottile lamina d'oro, dello spessore di circa 0,004 mm, con delle particelle α (alfa) emesse ad alta velocità da una fonte radioattiva; tali particelle sono dotate di massa (circa pari a quella di un atomo di elio e oltre 7000 volte maggiore di quella di un elettrone) e di carica elettrica positiva, doppia rispetto a quella dell'elettrone, ma di segno opposto. Per rilevare la presenza delle particelle α, che sono invisibili all'occhio umano, e studiarne pertanto il tragitto quando interagivano con la lamina d'oro, utilizzò un particolare schermo fluorescente, come mostrato in figura 11.


Gli scienziati osservarono che:
- la maggior parte delle particelle α attraversava la sottile lamina d'oro in linea retta, senza cioè subire alcuna deviazione;
- una piccola ma significativa frazione di particelle veniva deviata e addirittura alcune particelle (circa 1 ogni 8000) venivano rimbalzate all'indietro.
In base alle osservazioni e ai calcoli effettuati, Rutherford comprese che il modello proposto da Thomson non potesse essere valido (figura 12), in quanto le particelle alfa avrebbero dovuto attraversare tutte in linea retta la lamina d'oro senza subire alcuna deviazione o venendo solo leggermente deviate, per l'interazione con il debole campo elettrico generato dagli atomi (si ricordi che nel modello di Thomson la carica e la massa sono diffuse in tutto il volume dell'atomo, che di conseguenza ha una densità sia di massa sia di carica molto bassa). Ipotizzò quindi un modello "planetario" in cui la carica positiva era concentrata in un piccolo spazio centrale, il nucleo, e le cariche negative si muovevano in qualche modo (non precisò come) ad una certa distanza dal nucleo.
Numero atomico, numero di massa e isotopi

L’atomo è l’unità fondamentale della materia e tutti gli atomi sono formati dalle stesse categorie di subparticelle: il nucleo è costituito da protoni, particelle dotate di massa e carica positiva, e neutroni, particelle neutre (prive di carica) dotate di una massa paragonabile a quella dei protoni); attorno al nucleo si muovono gli elettroni, particelle con carica negativa pari in quantità a quella del protone ma di segno opposto e massa trascurabile rispetto a quella di un protone o di un neutrone (circa 1/2000). Il numero di elettroni eguaglia il numero di protoni: l’atomo, infatti, è, per definizione, una entità neutra. Il numero di protoni (e, quindi, di elettroni) viene indicato come numero atomico.
Le varie specie atomiche differiscono, in primo luogo, per il numero atomico e sono ordinate sulla tavola periodica secondo il numero atomico crescente.
I neutroni svolgono un ruolo determinante nella costituzione del nucleo in quanto si interpongono tra i protoni impedendo loro di respingersi: sono i neutroni, quindi, a conferire al nucleo compattezza e densità e, assieme ai protoni, costituiscono la massa dell’intero atomo. Gli elettroni incidono in misura trascurabile sulla massa dell’atomo ma circoscrivono e determinano il volume dell’atomo in toto; per comprendere le proporzioni volumetriche tra il nucleo e l’intero atomo potremmo considerare questo paragone: se il nucleo avesse le dimensioni di un nocciolo di ciliegia, l’intero atomo sarebbe grande quanto il duomo di Milano.
E’ intuibile che, all’aumentare del numero dei protoni, cresce in misura pressoché proporzionale anche il numero dei neutroni: se, però, il numero dei protoni è esclusivo di una determinata specie atomica, il numero dei neutroni può variare nell’ambito della stessa specie atomica.
A conferma di quanto ho affermato, possiamo verificare che in Tavola periodica viene riportato in modo evidente il numero atomico mentre non riusciamo a individuare in alcun modo il numero dei neutroni. Bisogna subito chiarire che piuttosto che considerare il numero assoluto di neutroni appartenenti all’atomo di una determinata specie in una particolare circostanza costitutiva, si è preferito considerare la somma di protoni e neutroni, ovvero il cosiddetto numero di massa. Ribadisco: se il numero atomico è caratteristico di una specie atomica, il numero di neutroni può essere diverso di qualche unità nell’ambito della stessa specie atomica e determinare più numeri di massa per la stessa specie atomica. Sarebbe ingombrante quanto inutile e superfluo riportare in tavola periodica tutti i possibili numeri di massa di una determinata specie, dal momento che, come vedremo in seguito, troviamo “traccia” del numero di massa in una fondamentale grandezza denominata massa atomica, necessariamente riportata in tavola periodica.
Atomi della stessa specie con diverso numero di massa vengono denominati isotopi (dal greco ίσος τόπος, stesso luogo).

Vengono di seguito rappresentati gli isotopi dell’idrogeno (vedi disegno accanto) e quelli del carbonio.
Il nucleo dell’idrogeno è, di fatto, un protone e, quindi, nella sua costituzione non dovrebbe rientrare alcun neutrone: in natura, tuttavia, esiste una piccola percentuale di deuterio e trizio che presentano rispettivamente un neutrone e due neutroni.
1H idrogeno propriamente detto 2H deuterio 3H trizio
Il numero in alto a sinistra rispetto al simbolo rappresenta il numero di massa, comprensivo, come si è detto, del numero atomico, che per l’idrogeno è uno: possiamo, quindi, verificare che l’idrogeno propriamente detto non presenta alcun neutrone a costituire il proprio nucleo, il deuterio ne presenta uno e il trizio due.
12C 13C 14C
Il carbonio - 12 ha un nucleo costituito da sei protoni e sei neutroni, il carbonio – 13 ha sette neutroni mentre il carbonio - 14 presenta otto neutroni: quest’ultimo è l’isotopo più pesante del carbonio ed è radioattivo
-
Il numero atomica si indica con Z
-
Il numero di massa si indica con A
-
Esempi di isotopi dello zinco, del rame e del nichel. In nero quelli stabili, in colore quelli radioattivi
In particolari condizioni, un atomo può acquistare o perdere elettroni. Quando un atomo perde uno o più elettroni non è più elettricamente neutro, perché la carica positiva del nucleo non è bilanciata da quella degli elettroni; si dice che l’atomo è diventato uno ione positivo o catione. Quando un atomo acquista uno o più elettroni non è più elettricamente neutro, per cui si dice che l’atomo è diventato uno ione negativo o anione.
La Tavola periodica moderna

La moderna tavola periodica ordina gli atomi in righe, dette periodi, e colonne, dette gruppi.
Gli atomi sono ordinati in sequenza in base al numero atomico (Z) cioè in base al numero di protoni, poiché sono principalmente i protoni a determinare le caratteristiche chimiche dell'atomo.
Nella tavola periodica tutti gli atomi sono considerati neutri, quindi, il numero di protoni del nucleo è uguale al numero degli elettroni.
I principali gruppi sono individuati da numeri romani (I, II, fino a VIII). In ogni gruppo (colonna) gli elementi hanno caratteristiche chimiche simili, ad esempio i metalli del primo gruppo (litio, sodio, potassio) sono estremamente reattivi, oppure quelli dell'ultimo gruppo (VIII) sono per nulla reattivi e quindi esistono come gas monoatomici.
La tavola viene definita "periodica" poiché alcune caratteristiche chimiche si ripetono periodicamente ad ogni periodo (riga). Ad esempio proprietà periodiche sono: il raggio atomico (le dimensioni dell'atomo), l'energia di ionizzazione (l'energia necessaria per strappare uno o più elettroni all'atomo), l'affinità elettronica ( l'energia liberata dall'atomo quando prende uno o più elettroni) e l'elettronegatività (la capacità dell'atomo di attrarre a sé gli elettroni di eventuali legami chimici).
Metalli, non metalli e semimetalli

Gli elementi della tavola periodica si suddividono in tre gruppi:
- i metalli, che sono la maggior parte e sono tutti gli elementi a sinistra, al centro e a destra fino alla linea spezzata rossa (vedi la tavola periodica a fianco). Sono tutti solidi tranne il mercurio che è liquido (a temperatura ambiente). Sono duttili (si possono ottenere fili) e malleabili (facilmente lavorabili, anche in lamine), buoni conduttori di elettricità (es. fili elettrici di rame) e calore (es. le pentole).
- i non metalli, posizionati a destra della linea spezzata, che sono in natura, a seconda dell'elemento, solidi, liquidi o gassosi. Hanno proprietà diverse, a seconda dell'elemento, ma non hanno le caratteristiche sopracitate dei metalli
- i semimetalli, sono gli elementi vicino alla linea spezzata rossa, con proprietà chimiche intermedie tra metalli e non metalli
Gli elementi che osserviamo nella tavola periodica si formano nel nucleo delle stelle grazie a reazioni di fusione nucleare a partire dall'idrogeno. Gli elementi oltre il ferro però si formano solo in occasione di particolari eventi catastrofici come le esplosioni di supernove.
Riportiamo a titolo di esempio le reazioni nucleari che portano alla formazione dell'elio nel Sole (e in tutte le stelle che sono nello stadio "giovanile" in cui "bruciano" idrogeno.
La fusione nucleare consiste nell’assemblaggio di nuclei piccoli in un nucleo più grande: il processo è accompagnato da emissione di energia.
Le reazioni di fusione nucleare sono all’origine dell’energia solare. Sembra che due diversi processi possano avvenire nel sole: uno nella zona centrale, più calda, e l’altro nella zona più esterna. Le due reazioni procedono con meccanismi differenti ma il risultato finale è uguale: produzione di un nucleo di elio, con eliminazione di due positroni (particella avente la stessa massa dell’elettrone ma carica positiva) e di una enorme quantità di energia.
Sono due le più importanti reazioni nucleari in grado di fornire elio a partire da idrogeno: una è diretta, la cosiddetta catena protone – protone (dominante a temperature più basse); l’altra utilizza carbonio come catalizzatore ed è chiamata ciclo del carbonio, dell’azoto e dell’ossigeno (dominante a temperature più alte). La catena p - p prosegue come segue:


e+ rappresenta un positrone, ovvero un elettrone con carica positiva: esso è una particella di antimateria e interagisce rapidamente con un elettrone dando luogo a due fotoni ad alta energia o raggi gamma; ν rappresenta un neutrino, ovvero una particella neutra con massa ridottissima; γ è un tipo di radiazione dotata di grande energia (come già detto).
La reazione del ciclo CNO procede come segue:

La quantità di energia implicata in un processo di fusione è più alta che in quello di fissione; la bomba a idrogeno, o bomba H, ha un effetto distruttivo più imponente rispetto della bomba atomica, perché la sua energia è prodotta per fusione di nuclei di idrogeno.
La ricerca è impegnata per mettere a punto reattori nucleari basati sul processo di fusione; questi sembrano molto promettenti e presentano innegabili vantaggi rispetto a quello di fissione: quantità praticamente inesauribile del materiale fusibile, resa energetica più alta, assenza quasi totale di contaminazione dell’ambiente. I problemi tecnici nascono dal fatto che, per innescare la reazione, bisogna raggiungere temperature dell’ordine di milioni di gradi e non si conoscono materiali per costruire contenitori che resistano a tali temperature.

Attività
Esercizi (pagina da fare): in questa pagina si trovano esercizi su questi argomenti
Sintesi: in questa pagina trovi una sintesi sull'atomo e la materia che esso forma




