Fisica classica/Entropia
La proprietà di un ciclo reversibile che l'integrale ciclico del rapporto tra il calore, scambiato da un sistema, e la temperatura istantanea durante un ciclo reversibile sia identicamente nullo.
Comporta che nelle trasformazioni reversibili sia una variabile di stato intensiva detta entropia. Infatti se ho due stati termodinamici di equilibrio A e B in tutte le trasformazioni termodinamiche reversibili che collegano tali stati la grandezza assume lo stesso valore.
Nel successivo paragrafo viene dimostrata tale affermazione.
Entropia come funzione di stato
[modifica | modifica sorgente]
Siano A e B due stati di equilibrio di un sistema termodinamico. Consideriamo tre generiche trasformazioni reversibili I e II che portano il sistema dallo stato A allo stato B e la III reversibile che porta il sistema dallo stato B allo stato A.
Consideriamo due trasformazioni cicliche reversibili che passino tra tali stati di equilibrio e per entrambe possiamo scrivere, grazie al teorema di Clausius, che:
Ma anche scomponendo gli integrali:
Sottraendo queste due espressioni:
Cioè nel passaggio da uno stato termodinamico generico A ad uno B, qualsiasi sia la trasformazione reversibile che congiunga i due stati, la quantità:
Dipende solo dagli estremi e non dal percorso fatto è quindi una funzione di stato , che viene chiamata entropia. L'entropia qui è definita a meno di una costante additiva : se io conosco il valore dell'entropia nello stato A, posso calcolarmi l'entropia nello stato B considerando una qualsiasi trasformazione reversibile, che mi porti il sistema dallo stato A a quello B, per cui posso calcolare agevolmente sia il calore scambiato che la temperatura istantanea. Nelle espressioni date la temperatura T che compare è la temperatura con la quale il sistema scambia calore con le sorgenti, che essendo le trasformazioni reversibili la temperatura del sistema coincide con quella del sistema.
L'entropia è una grandezza estensiva, per cui nel caso di un sistema fatto di più parti l'entropia è eguale alla somma delle entropie di tutte le parti che lo compongono. Per il calcolo della variazione di entropia si può utilizzare una qualsiasi trasformazione termodinamica reversibile che collega i due stati.
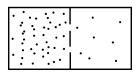
Esempio della espansione libera di un gas perfetto: Consideriamo n moli di un gas perfetto che occupa inizialmente solo il volume di destra attraverso la parete di separazione si espande in maniera isoterma e adiabatica irreversibile fino ad occupare anche il volume di destra e quindi nello stato finale ha la stessa temperatura e occupa tutto il volume . Nella trasformazione irreversibile il calore scambiato è nullo ma non è possibile calcolare la variazione di entropia attraverso una qualsiasi trasformazione reversibile che colleghi lo stato finale e quello iniziale. La trasformazione più semplice è una isoterma reversibile che porti il gas dal volume al volume . In questa trasformazione il calore scambiato con la sorgente a temperatura vale: Quindi: Lo stesso risultato poteva essere ottenuto con qualsiasi trasformazione reversibile che collegasse i due stati iniziale e finale, ad esempio una isocora che porti il sistema ad una temperatura , tale che la pressione in C sia e quindi una isobara porti il sistema nello stato finale C: Mentre nella isobara: Quindi: Avendo utilizzato la relazione di Mayer. Ma essendo la pressione in B eguale a quella in C: ma anche e quindi di conseguenza, anche in questo caso, si ha che la variazione di entropia è: Notiamo che l'entropia è aumentata in quanto il volume è maggiore di quello iniziale, prima della espansione.
L'entropia ha le dimensioni di una energia diviso una temperatura e quindi nel sistema internazionale si misura in .
Universo termodinamico
[modifica | modifica sorgente]La entropia ha un ruolo centrale in termodinamica la sua definizione è una conseguenza del II principio della termodinamica. Come vedremo subito la misura della sua variazione nell'universo termodinamico permette di quantizzare la irreversibilità delle trasformazioni.
Si definisce universo termodinamico il sistema completo comprendente sia le sorgenti presenti che i sistemi termodinamici che scambiano calore ed energia durante le trasformazioni termodinamiche. Nell'universo termodinamico l'energia interna totale non può variare a causa del I principio della termodinamico, per questa ragione fino a quando si parla della sola energia interna non ci eravamo soffermati sul concetto di universo termodinamico.
Entropia ed irreversibilità
[modifica | modifica sorgente]
Consideriamo ora un sistema isolato che compie una trasformazione irreversibile adiabatica dallo stato A allo stato B (rappresentato dalla curva tratteggiata (I) che collega i due stati).
Un esempio di tale trasformazione potrebbe essere oltre all'espansione libera di un gas che abbiamo già visto ad esempio la messa a contatto di due oggetti a temperatura diversa (isolati termicamente dall'esterno). Riportiamo il sistema nello stato iniziale mediante una trasformazione reversibile II. Questo è quindi un ciclo termodinamico irreversibile per cui:
Scomponendo l'integrale:
Essendo la trasformazione I adiabatica irreversibile (per ipotesi):
Mentre essendo la trasformazione II reversibile:
Quindi sostituendo:
Cioè le uniche trasformazioni adiabatiche spontanee possibili, sono quelle per cui l'entropia del sistema o aumenta o rimane eguale a se stessa.
Il ragionamento fatto comporta che se ho un ciclo termodinamico irreversibile e considero oltre al sistema le sorgenti di calore con cui viene effettuato il ciclo che assieme al sistema costituiscono quindi l'universo termodinamico. In un ciclo il sistema anche se compie un ciclo irreversibile ritorna nello stato iniziale quindi la sua variazione di entropia è nulla, essendo l'entropia una funzione di stato. Un discorso diverso vale le sorgenti le quali assorbono a cedono calore al sistema in maniera irreversibile, il segno del calore è l'opposto di quello del sistema, cioè se ad esempio il ciclo si svolge tra due temperature e , detto è il calore positivo preso dalla sorgente , la variazione di entropia della sorgente è (negativa):
Mentre quella della sorgente è positiva e in valore assoluto maggiore della diminuzione di :
In definitiva l'entropia dell'Universo termodinamico aumenta sempre se le trasformazioni sono irreversibili. Vari esempi illustrano meglio quanto detto: un ciclo frigorifero, isocora e adiabatica irreversibile, isocora e isobara irreversibile.
L'aumento dell'entropia del sistema globale, cioè dell'universo termodinamico, è una misura della irreversibilità della trasformazione fatta. Maggiore è tale aumento meno efficiente in senso lato è la trasformazione.
Notare come l'entropia come anche l'energia interna sia definita a meno di una costante arbitraria, ma l'arbitrarietà della costante nel caso dell'entropia viene rimossa dal III principio della termodinamica che stabilisce che allo zero assoluto l'entropia di tutti i sistemi fisici sia nulla.
Il raggiungimento dell'equilibrio termodinamico comporta l'aumento dell'entropia a meno che non avvengano trasformazioni completamente reversibili.
Mentre l'energia dell'Universo non cambia con le trasformazioni, l'evoluzione del tempo ed il raggiungimento dell'equilibrio termodinamico sono accompagnati dall'aumento dell'entropia.
La produzione di calore per attrito si accompagna ad un aumento di entropia pari esattamente al lavoro diviso la temperatura di equilibrio del sistema.
La meccanica statistica definisce l'entropia come proporzionale al logaritmo del numero degli stati dinamici microscopici possibili del sistema. L'aumento dell'entropia nelle trasformazioni spontanee diventa quindi un fatto determinato dalla probabilità immensamente maggiore degli stati di equilibrio termodinamico rispetto a tutti gli stati macroscopici possibili. È possibile il concetto di entropia anche a tutti i sistemi complessi con un numero molto elevato di gradi di libertà.
La degradazione del lavoro meccanico, ma anche di ogni altra forma di energia (chimica, elettrica, etc.) in calore porta ad una trasformazione di tale energia in calore alla temperatura in cui si trova il sistema. Calcolare in questo caso l'aumento di entropia dell'universo termodinamico durante il processo irreversibile è semplice. Infatti l'aumento di entropia si ottiene semplicemente dividendo l'energia trasformata in calore per la temperatura del sistema (nell'ipotesi che sia così grande la capacità termica del sistema da essere trascurabile l'aumento di temperatura). Infatti si potrebbe ottenere la stessa cosa in maniera reversibile fornendo all'universo termodinamico del calore alla stessa temperatura di equilibrio a cui si trova il sistema stesso.
Variazione di entropia nei solidi e nei liquidi
[modifica | modifica sorgente]Il calore scambiato nella trasformazione reversibile che porta un sistema termodinamico da uno stato A a uno stato B per i solidi o i liquidi non dipende da come viene compiuta la trasformazione, cioè se porto un solido dalla temperatura alla temperatura , se la sua capacità termica è indipendente dalla temperatura e vale , il calore da fornire per andare da a è pari , indipendentemente dal fatto se lo faccio in maniera reversibile o irreversibile quindi la variazione di entropia è pari:
Quindi se l'entropia aumenta, mentre diminuisce nel caso opposto. Se La capacità termica dipende dalla temperatura bisognerà tenerne conto, in questo caso bisognerà esplicitare la sua dipendenza dalla temperatura lasciando la capacità termica all'interno dell'integrale. In effetti a bassa temperatura la capacità termica dei solidi diminuisce fino ad annullarsi allo zero assoluto.
Se pongo a contatto due oggetti a temperatura diversa il primo di capacità termica e temperatura il secondo di capacità termica e temperatura raggiungeranno una temperatura di equilibrio pari a:
La variazione di entropia del sistema globale vale:
E' facile verificare numericamente per un sistema che sempre si ha un aumento di entropia nel processo irreversibile di equilibrio termico tra due oggetti a temperatura diversa.
Variazione di entropia di una sorgente di calore
[modifica | modifica sorgente]Per definizione una sorgente di calore non varia la sua temperatura sia che riceva o che ceda calore. Quindi una sorgente di calore che ceda calore diminuisce la sua entropia e la variazione è data dal calore ceduto diviso la sua temperatura termodinamica. Mentre se assorbe calore la sua entropia aumenta del calore ceduto diviso la sua temperatura termodinamica. Notare come a causa della definizione di calore in termodinamica se un sistema acquista calore da una sorgente aumenta la sua entropia, ma contemporaneamente la sorgente diminuisce la sua entropia: poiché il calore passa spontaneamente dalle sorgenti a temperatura più calda a quelle a temperatura più fredda, a meno che la temperatura della sorgente e del sistema non differiscano per un infinitesimo, la diminuzione di entropia della sorgente è sempre inferiore all'aumento del corpo a temperatura più bassa quindi l'entropia totale aumenta. Analogamente se il sistema perde calore verso una sorgente a temperatura più fredda in questo caso l'aumento di entropia della sorgente è sempre maggiore della diminuzione di entropia del sistema a contatto termico, a meno che la temperatura della sorgente e del sistema non differiscono per un infinitesimo. Quindi nelle trasformazioni irreversibili tra oggetti con temperatura macroscopicamente differente si ha sempre un aumento dell'entropia totale del sistema.
Variazione di entropia nei cambiamenti di stato
[modifica | modifica sorgente]I cambiamenti di stato dei gas avvengono a temperatura costante con un calore latente. La variazione di entropia del sistema che cambia di stato è pari al prodotto della massa che cambia di stato per il calore latente diviso la temperatura a cui avviene la trasformazione.
I cambiamenti di stato possono essere delle trasformazioni perfettamente reversibili cioè con variazione di entropia totale nulla. Ma l'eventuale sorgente di calore deve differire dalla temperatura del cambiamento di stato di un infinitesimo, mentre nelle altre trasformazione questa condizione è praticamente impossibile a meno di tempi di attesa molto lunghi, nel caso dei cambiamenti di stato la cosa è meno complicata da un punto di vista pratico.
Calcolo della variazione di entropia nelle trasformazioni dei gas perfetti
[modifica | modifica sorgente]Nel caso dei gas perfetti il calcolo della variazione di entropia è più complesso. Consideriamo un trasformazione di moli di un gas perfetto che dallo stato termodinamico vada in , lo stato A è caratterizzato dalle variabili di stato e lo stato B da Dal I principio della termodinamica, nel caso di una trasformazione reversibile che porti il sistema da , in un tratto infinitesimo :
Ma il lavoro infinitesimo è pari a:
Quindi, la variazione infinitesima di entropia vale:
Quindi la variazione di entropia vale, nella trasformazione revesibile che collega :
Pertanto si ha che, in generale, se sono noti i volumi e le temperature iniziali e finali, cioè si passa dallo stato A e B mediante isocore e isoterme :
Se sono note le pressioni e le temperature iniziali e finali, cioè si passa dallo stato A e B mediante isobare e isoterme:
Se sono note le pressioni e le temperature iniziali e finali, cioè si passa dallo stato A e B mediante isobare e isoterme:
Quindi se la temperatura in A è eguale a quello in B si ha che:
Mentre se il volume in A è eguale a quella in B si ha che:
Mentre se la pressione in A è eguale a quello in B si ha che:
Il ciclo di Carnot
[modifica | modifica sorgente]
Un ciclo di Carnot, essendo costituito da due adiabatiche reversibili quindi isoentropiche e da due isoterme reversibili nel diagramma Entropia temperatura, è un rettangolo con lati paralleli agli assi. Il lavoro compiuto è pari all'area in bianco all'interno del rettangolo ed è quindi pari a:
IL ciclo di raffreddamento liquido-vapore
[modifica | modifica sorgente]
Il raffreddamento mediante compressione di vapore è il ciclo frigorifero più usato per i frigoriferi domestici e industriali, come per i sistemi di aria condizionata. La figura mostra un tipico esempio di un impianto che funziona con questo principio. Il sistema usa un fluido circolante refrigerante come mezzo che assorbe e rimuove il calore dalla regione che deve essere raffreddata e butta via il calore all'esterno. Tutti i sistemi questo tipo si compongono di quattro componenti: un compressore (compressor), un condensatore (condenser), una valvola di espansione (Expansion valve) e un evaporatore. Il fluido nella fase vapore entra nel compressore come vapore saturo cioè alla pressione massima con cui è in equilibrio con la fase liquida. Viene dal compressore portato ad una pressione ed una temperatura maggiore. Il vapore compresso caldo va nel cosiddetto stato vapore vapore surriscaldato ed è ad una temperatura ed una pressione in cui può divenire liquido se viene raffreddato con acqua o un flusso di aria attorno ai tubi in cui circola il fluido. In questa fase il fluido circolante perde il calore e il calore disperso viene portato via dall'acqua o dall'aria.

Il fluido a questo punto è divenuto completamente liquido, un liquido ad elevata pressione. La valvola di espansione (chiamata in genere con il termine inglese trottle) permette una rapida riduzione di pressione. Quindi parte del fluido in maniera adiabatica diventa gas provocando una autoraffreddamento di tutto il fluido: che diventa il punto più freddo del sistema. La miscela fredda di gas e liquido va nell'evaporatore raffreddando eventualmente con un flusso d'aria la regione da raffreddare. L'aria anche s a temperatura maggiore si porta alla temperatura della miscela fredda, l'aria fredda circolando abbassa la temperatura della regione frigorifera.
Per completare il ciclo frigorifero, il vapore del refrigerante entra nel compressore chiudendo il ciclo.

Per molti anni i più comuni fluidi refrigeranti sono stati i Freon dei fluorocarburi stabili, non tossici e non infiammabili. Purtroppo i Freon più leggeri contenenti cloro e fluoro quando vengono dispersi nell'aria raggiungono la stratosfera danneggiando lo lo strato di ozono ivi presente che protegge dalla radiazione ultravioletta del sole. Sono attualmente usati nei condizionatori per auto altri composti come il R-134a che è un freon più pesante.
Il ciclo termodinamico può essere analizzato dal punto di vista del diagramma temperatura-entropia come mostrato in figura
Nel punto 1 del diagramma, il fluido refrigerante entra nel compressore come vapore saturo. Dal punto 1 al punto due in maniera adiabatica e quindi isoentropica compresso ed esce come vapore supersaturo. Dal punto 2 al punto 3 il vapore entra nel condensatore che rimuove il calore. Tra 3 e 4 il vapore si muove all'interno del condensatore diventando un liquido saturo. Il processo di condensazione avviene essenzialmente a pressione costante. Trail punto 4 e 5 il liquidi passa nella valvola di espansione e subisce un'improvvisa diminuzione di pressione: un processo rapido e adiabatico. Tra il punto 5 ed 1 la miscela fredda viene totalmente vaporizzata ed il suo calore latente di evaporazione raffredda la regione di interesse. Il liquido diventa totalmente vapore e in questa forma ritorna al compressore ripetendo il ciclo
Il ciclo non è perfetto a causa dell'attrito del compressore, il gas non è ideale, ma fare un ciclo con un gas è sicuramente meno vantaggioso. Infatti un ciclo frigorifero fatto con un gas perfetto ha in genere un coefficiente di prestazioni minori e la macchina frigorifera risulterebbe molto ingombrante. Il calore specifico per unità di volume di un gas è trascurabile moltiplicato anche per elevata differenza di temperatura è trascurabile rispetto al calore latente di evaporazione di un liquido per unità di volume. I cicli frigoriferi con i gas perfetti sono però utilizzati per liquefare i gas in impianti industriali.
Termodinamica delle corde elastiche
[modifica | modifica sorgente]Anche le corde elastiche hanno delle proprietà che sono ben descrivibili in termini della termodinamica [1]. Consideriamo un elastico che è composto di lunghe catene polimeriche. Le variabili fisiche macroscopiche sono la lunghezza , la tensione e la temperatura . Il legame tra queste grandezze cioè l'equazione di stato del sistema è con buona approssimazione:
Dove è la lunghezza a riposo, è il limite elastico , è una costante che ha le dimensioni di una forza divisa una lunghezza e dipende dal materiale e dalla sua geometria.
Il lavoro fatto da un elastico che passa da una lunghezza ad una lunghezza vale:
Cioè è positivo se la corda si accorcia (), mentre è negativo nel caso contrario. Cioè per allungare la corda è necessario fare lavoro dall'esterno. In prima approssimazione la lunghezza cambia poco con la temperatura e quindi l'energia interna è una funzione lineare della temperatura:
Dove è una costante che dipende dal materiale e la sua geometria.
Per una trasformazione reversibile infinitesima, dal primo principio della termodinamica, possiamo scrivere che:
quindi, essendo reversibile:
Quindi integrando tale espressione si ha che:
La trasformazione isoterma nel piano è una retta con pendenza tanto maggiore quanto maggiore è la temperatura. Nel piano un ciclo che compie lavoro viene percorso in senso antiorario.
La ragione per cui le corde elastiche non vengono usate come macchine termiche o frigorifere è che il raggiungimento dell'equilibrio termodinamico è molto più lento di quello dei gas. Quindi non trovano applicazioni pratiche.
- ↑ Herbert B. Callen, Thermodynamics and introduction to thermostatics, New York, John Wiley & Sons, 1985, pp. 80-81.
















































































